浓度对平衡移动的一个误解
在说明浓度对化学平衡移动影响的实验时;有的书中所采用的化学反应方程是:
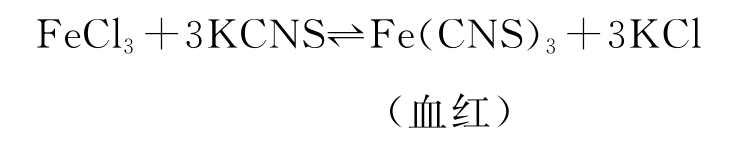
书中试图用增加KCl的浓度,溶液的血红色变浅来说明“增加生成物的浓度,使化学平衡向逆反应方向移动”的道理。有的老师在讲这个问题时,也选用了这个实验。我认为这是一种误解。现在西安师范学校高世雄老师从下面三个方面加以论证说明之。
(1)从电解质溶液化学反应的实质来看
由于离子方程式标志着电解质在溶液里所起的化学变化的实质,上面这个化学反应的离子方程式是:
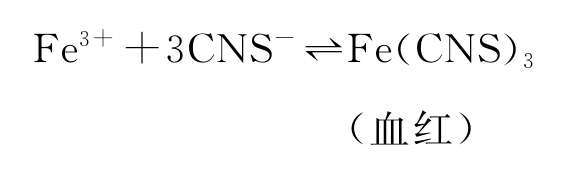
由离子方程式我们可以认为,强电解质KCl(其电离方程式为:KCl=K++Cl-)在这里没有参加反应,因而它与该反应的化学平衡的移动无关。因此对于溶液中的可逆反应来说,应用化学平衡移动原理说明平衡移动方向只适用于加入弱电解质溶液。
(2)从化学实验的结果来看
由FeCl3和KCNS溶液制得的含血红色的Fe(CNS)3溶液,均分为三份,分别加入等量的NaNO3、Na2SO4、KCl这些强电解质晶体,摇荡片刻后,我们看到三个试管中的血红色均变浅(当然,还可以加入不含K+和Cl-的其他强电解质,其效果与加KCl晶体相同)。然而在其分子方程式的产物中,却并没有NaNO3和Na2SO4等物质。这就从另一方面否定了前面那种误解的说法。
(3)从强电解质溶液理论的推导来看
由于KCl、NaNO3、Na2SO4等均属强电解质,它们的加入使溶液中带电荷的离子浓度增加,静电效应增强,溶液的离子强度(其计算公式是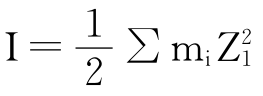 )增加,根据德拜—尤格尔极限公式:
)增加,根据德拜—尤格尔极限公式: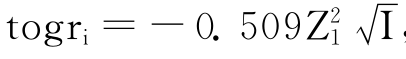 ,可知溶液中Fe3+和CNS-离子的活度系数减少,由活度公式ai=rimi,得到Fe3+和CNS-离子的活度减小,故有Fe(CNS)3的解离度增加,溶液的血红色变浅。由此可知,用增加强电解质KCl溶液的浓度,溶液的血红色变浅不能说明“增加生成物的浓度,使化学平衡向逆反应方向移动”的道理,它只不过是一种“盐效应”罢了。
,可知溶液中Fe3+和CNS-离子的活度系数减少,由活度公式ai=rimi,得到Fe3+和CNS-离子的活度减小,故有Fe(CNS)3的解离度增加,溶液的血红色变浅。由此可知,用增加强电解质KCl溶液的浓度,溶液的血红色变浅不能说明“增加生成物的浓度,使化学平衡向逆反应方向移动”的道理,它只不过是一种“盐效应”罢了。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















