一、采集痰标本的容器
必须采用可密封的、不渗漏的、带螺旋盖的容器(图2-1)收集痰标本。容器的参考规格为直径4cm,高度不低于3cm。痰容器应标明患者姓名、编号(初诊患者门诊序号或随访患者登记号)、检查项目和痰标本序号1、2、3(“1”为当日即时痰、“2”为夜间痰、“3”为次日晨痰)。应向受检者提供符合要求并做了标记的痰盒。

图2-1 痰标本容器
二、痰标本的采集时间
根据痰标本采集的时间,可将标本分为以下三类。
1.即时痰 就诊时深呼吸后咳出的痰液。
2.晨痰 患者晨起立即用清水漱口后,咳出的第2口、第3口痰液。
3.夜痰 送痰前1日,患者晚间咳出的痰液。
三、痰标本的收集方法
对就诊者,临床医护人员应通过解释,使患者充分了解标本质量相对应检测项目的重要性,示范并指导其掌握从肺部深处咳痰的方法;还要告知患者有时需要反复数次才能获得理想的痰标本。如患者识字,可提供宣教材料。正确收集痰液的方法如下。
1.如果患者刚吃过东西,应先用清水漱口。装有义齿的患者在留取痰标本之前应先将义齿取出。
2.深吸气2~3次,每次用力呼出。
3.从肺部深处咳出痰。对于痰量少或者无痰的患者可采取雾化吸入加温至45℃的10% NaCl溶液,使痰液易于排出或鼻咽拭子采集标本。
4.对于小儿,取痰时用弯压舌扳向后压舌,用棉拭子伸入咽部,小儿经舌刺激咳嗽时,可喷出肺部或气管分泌物黏在拭子上,送检。
5.将打开盖的痰盒靠近嘴边收集痰液。
6.拧紧盒盖。
四、痰标本的采集地点
当患者咳嗽、咳痰时,易产生含有结核菌的气溶胶,感染周边人群的概率较高,故采集痰标本时应在远离人群的开放空间或通风良好的留痰室内进行。
五、痰标本的接收与评价
接收标本时,应由检验人员或经培训的专人目视检查标本质量(特别是用于初次诊断的痰标本)。标本量一般为3~5ml,如果痰标本质量好,稍少一些的标本量也可以。收取标本后填写标本接收记录,保存记录备查。如果需要患者重新留痰,应先将现有不合格标本接收并填写接收记录,然后给予患者新的痰盒嘱其重新留痰,不应将现有不合格标本退给患者或门诊。
干酪痰、褐色血痰或含少量新鲜血液的血痰、黏液痰为合格的标本。痰标本不合格者,应予以进一步指导并要求其重新送检。进行细菌学检查时应在实验室登记本和报告单上注明标本性状,以供分析结果时参考。
合格的痰标本应是患者深呼吸后,由肺部深处咳出的分泌物。按性状痰标本可分为以下几种。
1.干酪痰 标本外观以黄色(或奶酪色)、脓样、团块状的肺部分泌物为主,黏度较黏液痰低,制片时较易涂抹;涂片染色后镜检,可发现大量脓性炎症细胞、肺上皮脱落细胞。由于此类标本是由肺部深处咳出,对肺结核的诊断最有价值,故抗酸杆菌(AFB)的检出率较高。
2.血痰 此类标本是在黏液痰或干酪痰标本中混有血液,颜色为褐色或深褐色、鲜红色或伴有血丝;涂片染色后镜检除能够观察到黏液痰或干酪痰的细胞特征外,含新鲜血液的标本中可见到被染色的血细胞。由于含血标本易干扰抗酸杆菌(AFB)镜检的结果,故在制片时应尽量避免挑取含血部分。
3.黏液痰 标本外观以白色、黏稠度较高的肺部和支气管分泌物为主,制片时需仔细涂抹;涂片染色后镜检时,镜下可见支气管内膜纤毛柱状上皮细胞(细胞较长且形态不规则、细胞核和细胞质着色均较深,细胞一端可见着色较浅的纤毛),伴有少量肺上皮脱落细胞(多数为圆形、细胞核较小且着色较细胞质深,核质比>1∶3)、脓性炎症细胞(卵圆形、细胞核占细胞比例较大且着色较深,核质比<1∶1)、口腔脱落细胞及口腔寄生菌。此类标本的抗酸杆菌(AFB)检出率较唾液高。
4.唾液 目视观察标本整体外观,以透明或半透明水样、黏度较低的口腔分泌物为主,标本中有时伴有气泡;涂片染色镜检时,镜下可见少量口腔上皮脱落细胞(形态不规则、细胞核着色较细胞质深,核质比接近或大于1∶2)和口腔内寄生菌,有时可见食物残渣。由于此类标本进行抗酸杆菌(AFB)检查时的检出率很低,用于对患者确定诊断是不合格的标本。
六、培养标本的选择
(一)根据涂片结果进行诊断用标本的选择
1.3份痰标本均为阳性 选取阳性级别高的2份痰标本进行培养。
2.3份痰标本2份阳性 选取2份阳性痰标本进行培养。
3.3份痰标本1份阳性 选取阳性标本和1份质量好的阴性痰标本进行培养。
4.3份标本均为阴性 选取标本性状好的2份痰标本进行培养。
5.3份标本均为阴性且标本性状大致相同 选择按照晨痰、夜痰、即时痰的优选顺序选择2份痰进行培养。
(二)无涂片结果供参考时的选择原则
1.应优先选用标本性状好的痰进行培养。
2.如果标本性状相同,按照晨痰、夜痰、即时痰的优选顺序选择2份痰进行培养。
(三)随访标本
1.优先选择涂片阳性的1份痰标本需要进行培养。
2.如果没有涂片结果供参考或痰标本均为阴性,则按照标本性状、晨痰、即时痰的优选顺序选择1份痰标本进行培养。
(四)其他标本
1.咽拭子 使用消毒的棉棒,应在早晨进食、饮水前收集标本,这种方法适用于不会咳出痰液的受检者(如儿童)。容器中加入几滴灭菌的0.9%氯化钠溶液,保持拭子的湿润。
2.其他呼吸道标本 支气管分泌物(2~5ml)和支气管灌洗液(20~40ml),经支气管活检或者在无菌环境下取得其他活检物,在运输过程中应通过加几滴灭菌的0.9%氯化钠溶液保持组织的湿润。
3.胃灌洗液 无自觉症状的结核病患者(尤其是幼儿)不会咳嗽,有时甚至会将痰误咽入胃内,可采集胃内容物做检测,其阳性率比咳痰高10%左右。该方法用于清晨空腹时,将胃管插入胃内,用注射器抽取胃液。胃灌洗液在儿科常用,必须在清晨空腹收集标本。
4.肺外标本 实验室可能接收各式各样的标本诊断肺外结核,如体液、组织、尿等。广义上,依据不同的处理方法将这些标本分为2类。
(1)无菌采集标本:如脊髓液、心包积液、滑膜液、腹水、血液、骨髓等。应避免中间环节污染杂菌,直接接种。所有液体标本应该在无菌的玻璃容器收集,不加任何防腐剂;脑脊液最适的体积至少3ml,血液5~10ml收集于枸橼酸盐采血管内;标本必须立即送到实验室并尽早处理,或者保存在2~6℃下短时保存;收到标本后应直接接种在液体管中,进行培养。
(2)标本污染残渣和其他污染物:尿液标本应该是清晨中段尿,收集在广口灭菌容器中,至少200ml。精液、前列腺液不加任何添加剂。免疫缺陷患者建议检测非结核分枝杆菌(non-tuberculosis mycobacterium,NTM)。
七、标本储存与运输
(一)储存与运输
1.医疗机构内运送和保存。痰标本收集后应该尽快送检,如果不能立即送检,应将标本置于4℃下冷藏;送检时使用生物安全标本运送盒进行运送。实验室收到标本,应尽快涂片检查,以便根据涂片结果选择标本。在等待涂片结果时,应将标本置于4℃下短时保存,7d内必须进行培养。
2.若需要在医疗机构之间进行运送,应按照有关规定取得相关许可,然后进行冷藏运送(冷藏但不冷冻)。
3.在冷藏的条件下,从留取标本至开始培养不应超过7d。
(二)运输包装要求
应该使用符合生物性物质B类(诊断样本或临床样本)(UN3373)要求的包装,包括以下3层。
1.初始包装(即装痰的容器) 标本容器并附有足够的吸附材料,可吸附泄漏时产生的所有液体。
2.第二层包装 耐用的、防水的、防泄漏的包装,以封闭和保护初始包装。几个垫开的初始包装可以放在同一个第二层包装内,但是必须有足够的吸附材料以吸附发生泄漏时产生的所有液体。
3.外包装 第二层包装应该放在外层包装内,并有合适的垫子。外包装保护内容物,以免受外界的影响,如运输时的物理损坏。冰袋应该放在第二层包装外,且保证冰袋防泄漏。
八、涂 片
(一)直接涂片法
1.涂片制备
(1)使用一端有磨砂面的无划痕的新玻片,经脱脂(以95%乙醇擦拭或浸泡)干燥、清洁后备用。
(2)用2B铅笔在磨砂面上注明实验序号及标本序号。
(3)确保玻片上的编号与痰盒上的编号相同。
(4)小心打开盛载痰标本的容器,防止产生气溶胶或发生标本外溢。
(5)仔细观察标本,使用折断的竹签茬端,挑取痰标本中干酪样、脓样或可疑部分0.05~0.1ml,于玻片正面2/3中央处均匀涂抹成10mm×20mm左右的卵圆形痰膜(图2-2)。
(6)痰膜朝上静置自然干燥后(一般约30min)进行染色镜检。
(7)为保证检验人员的安全,严禁在涂抹痰标本的同时对载玻片进行加热。涂抹完毕后的痰标本,在结果报告前应暂时保留。

图2-2 制备好的痰涂片
2.标本玻片的制备
(1)脓液:同痰液涂片法。
(2)病理组织或干酪块直接镜检:先将组织用研磨器研磨后再进行涂片。
(3)尿液:送检标本应首先静置2~4h,取沉淀部分20~50ml,3 000g离心20~30min,取沉淀涂片。
(4)胸腔积液、腹水标本:参照尿液涂片法。
(5)脑脊液:无菌操作收集脑脊液,置冰箱或室温24h,待薄膜形成后进行涂片;或将脑脊液3 000g离心20~30min,取沉淀物涂片检查。
(6)粪便:标本与生理盐水混合后,充分振荡使之成为混悬液;定性滤纸过滤后,滤液经3 000g离心20~30min;取沉淀物进行涂片检查。
(7)咽喉棉拭子:棉拭子放入无菌试管,加入适量生理盐水浸泡,并强烈振荡,取出棉拭子后,液体再于3 000g离心20~30min,取沉淀物进行涂片检查。
(8)染色、镜检和报告参照痰标本相应方法进行。
(二)集菌涂片法
1.漂浮集菌涂片法 留取深咳痰或12~24h痰液标本,经高温(85℃水浴30min)液化或高压蒸汽(1.0kg/cm2,121℃,15~20min)灭活处理,待冷后,取5~10ml盛于容积为100ml的玻璃容器内(口径约2cm),加灭菌蒸馏水20~30ml,总体积勿超过容器的1/3,加二甲苯0.3ml,盖紧瓶盖(无瓶盖瓶口加盖玻璃纸或封口膜以防止污染和液体外溢),放振荡器上振荡10min,加蒸馏水置满瓶口,把已编号的载玻片盖于瓶口上,使液体油膜层与玻璃片紧密接触,放置30min,取下载玻片,自然干燥,火焰固定,染色镜检。
2.离心沉淀集菌涂片 留取深咳痰或12~24h痰液标本,经高温(85℃水浴30min)液化和121℃高压蒸汽灭菌15min,或煮沸30min,待冷后,取5~10ml经3 000g离心20~30min,使结核菌集中于试管底部,取沉淀物涂片,自然干燥,火焰固定,染色、镜检。
九、染色和镜检
(一)萋尔-尼尔逊(Ziehl-Neelsen,Z-N,萋-尼)染色法
1.萋-尼(Z-N)染色原理 抗酸菌具有耐受酸性介质脱色的生物性状。此类细菌在苯酚的协同作用下,被复红染色剂着色,能够耐受酸性乙醇脱色,显微镜观察时保持红色;而其他脱落细胞或标本中的非抗酸菌被酸性乙醇脱色后,可被复染剂亚甲蓝染为蓝色。抗酸杆菌(AFB)抗酸染色特性还与菌体细胞结构的完整性有着密切联系。
2.染液配制
(1)0.8%碱性复红染液
①碱性复红乙醇储存液:8g碱性复红溶于95%乙醇溶液100ml中。
②5%苯酚溶液:5g苯酚溶于100ml蒸馏水中。
将10ml碱性复红乙醇储存液与5%苯酚90ml水溶液混合,即为碱性复红染色应用液。
(2)5%盐酸乙醇脱色液:5ml浓盐酸与95ml 95%乙醇混合。
(3)0.06%亚甲蓝复染液
①亚甲蓝储存液:0.3g亚甲蓝溶于50ml 95%乙醇中,完全溶解后加蒸馏水至终体积100ml。
②亚甲蓝复染液:以蒸馏水5倍稀释0.3%亚甲蓝储存液,即得亚甲蓝复染液。
3.染色方法
(1)涂片自然干燥后,放置在染色架上,相邻玻片的距离应保持在10mm以上;火焰固定(在5s内将玻片置于火焰上来回烘烤4次)。
(2)滴加苯酚复红染液,盖满痰膜,火焰加热至出现蒸汽后,脱离火焰,保持染色5min。染色期间应始终保持痰膜被染色液覆盖,必要时可续加染液。加温时勿使染液沸腾。
(3)流水自玻片一端轻缓冲洗,冲去染色液,沥去标本上剩余的水。
(4)自痰膜上端外缘滴加脱色剂布满痰膜,脱色3min;如有必要,需流水洗去脱色液后,再次脱色至痰膜无可视红色为止。
(5)流水自玻片一端轻缓冲洗,冲去脱色液,沥去玻片上剩余的水。
(6)滴加亚甲蓝复染液,染色30s。
(7)流水自玻片一端轻缓冲洗,冲去复染液,沥去玻片上剩余的水。待玻片干燥后镜检。
(8)一张染色合格的痰玻片,由于被亚甲蓝染色而呈亮蓝色。将染色后的玻片放置在报纸上,应透过痰膜能够看清报纸上的文字,否则表明该玻片涂抹过厚或染色过程可能存在问题。
4.显微镜检查
(1)使用10×目镜双目显微镜读片。
(2)取染色完毕且已干燥的玻片,痰膜向上放置在玻片台上并以卡尺固定。
(3)首先使用40×物镜,转动卡尺移动玻片至痰膜左端,将光线调节至适当亮度,调节焦距至可见细胞形态。
(4)移开40×物镜,在玻片上滴1~2滴镜油,使用100×油镜进行细致观察。在淡蓝色的背景下,抗酸菌呈红色,其他和细胞呈蓝色。为防止抗酸杆菌的交叉污染,严禁油镜镜头直接接触玻片上的痰膜。
(5)读片时,首先应从左向右观察相邻的视野;当玻片移动至痰膜一端时,纵向向下转换一个视野,然后从右向左观察,依此类推(图2-3)。通常10mm×20mm大小的痰膜,使用100×油镜,每横行可观察100个视野,观察3行则约为300个视野。
(6)仔细观察完300个视野,一般需要5min以上。每个工作日,一位镜检人员连续阅读10~12张玻片后,应休息20min左右。

图2-3 镜检读片移动方式
5.镜检结果报告
(1)结果分级报告标准
抗酸杆菌阴性 (-):连续观察300个不同视野,未发现抗酸杆菌。
抗酸杆菌阳性(报告抗酸菌菌数):1~8条/300个视野。
抗酸杆菌阳性(1+):3~9条/100个视野。
抗酸杆菌阳性(2+):1~9条抗酸杆菌/10个视野。
抗酸杆菌阳性(3+):1~9条抗酸杆菌/每个视野
抗酸杆菌阳性(4+):≥10条抗酸杆菌/每个视野。
(2)报告(1+)时至少观察300个视野,报告(2+)至少观察100个视野,报告(3+)、(4+)时至少观察50个视野。
(二)荧光染色显微镜检查法——金胺O染色法
1.原理 与抗酸染色类似,利用金胺O能与所有分枝杆菌(包括部分寄生虫)细胞壁上脂质分枝菌酸(mycolic acid)牢固结合,使分枝杆菌染成黄亮色,试剂高锰酸钾用于消除非特异性荧光背景,金胺O染色后的涂片只要除去镜油,可重复进行抗酸染色。
2.染液配制
(1)金胺O:金胺O 1g,苯酚50ml,乙醇100ml,补蒸馏水至1 000ml。
(2)脱色剂:3%盐酸乙醇。
(3)复染剂:0.5%高锰酸钾溶液。
3.涂片制备 同萋-尼染色显微镜检查法。
4.染色方法
(1)玻片经火焰固定后,滴加染色剂盖满玻片,染色30min;用流动水自玻片一端轻缓冲洗,洗去染色液,沥去玻片上剩余的水。
(2)痰膜上端外缘滴加脱色剂,盖满玻片,流水自玻片一端缓冲轻洗,洗去脱色剂。
(3)加复染剂复染1~2min,沥去复染液,流动水自玻片一端轻缓冲洗去复染液后,自然干燥,准备镜检。
5.显微镜检查 玻片放置在玻片台上并以卡尺固定后,首先以10×目镜、20×物镜进行镜检,发现疑为抗酸杆菌(AFB)的荧光杆状物质,使用40×物镜观察细菌细胞形态确认。在暗背景下,抗酸菌发出黄色或橙色荧光,呈杆状略弯曲。
6.荧光染色镜检结果分级报告标准
(1)结果分级报告标准
荧光染色抗酸杆菌阴性(-):0条/50个视野。
荧光染色抗酸杆菌阳性(报告抗酸菌菌数):1~9条/50个视野。
荧光染色抗酸杆菌阳性(1+):10~99条/50个视野。
荧光染色抗酸杆菌阳性(2+):1~9条抗酸菌/每个视野。
荧光染色抗酸杆菌阳性(3+):10~99条抗酸菌/每个视野。
荧光染色抗酸杆菌阳性(4+):≥100条抗酸菌/每个视野。
(2)报告(2+)至少观察50个视野,报告(3+)及以上的阳性结果至少观察20个视野。
(3)荧光染色镜检应在染色后24h内进行;如需放置较长时间后镜检,应将涂片放置于4℃保存,及时镜检。
(三)罗丹明B+金胺O染色法
1.染色液配制
(1)金胺O-罗丹明B染色液:金胺O 0.15g,罗丹明B 0.75g,甘油75ml,苯酚10ml,溶于50ml蒸馏水中,等完全溶解后过滤,室温保存。
(2)脱色剂:3%盐酸乙醇。
(3)复染剂:0.5%高锰酸钾溶液。
2.玻片的制备 同萋-尼染色显微镜检查法。
3.染色方法
(1)涂片经火焰固定后加染色剂染色10~20min;流动水自玻片一端轻缓冲洗去除染色液。
(2)加脱色剂脱色至无色,流动水自玻片一端轻缓冲洗去除脱色液。
(3)加复染剂复染3min,流动水自玻片一端轻缓冲洗去除复染液后自然干燥,准备镜检。
4.镜检和报告 参见金胺O染色法。
十、玻片的保存
萋-尼染色玻片阅读完毕后,应及时用擦镜纸轻轻在涂片上揭取数次,彻底去除玻片上的镜油。经脱油、干燥后的玻片,按实验室序号及涂片编号放置在玻片盒中,存放在阴凉干燥的环境中避光保存,以备复检或质控抽检。
荧光染色的玻片,玻片盒中放置干燥剂后密封放置在4℃冰箱避光保存。
荧光染色的涂片进行盲法复检复核时,应首先将复检涂片脱色后进行萋-尼染色后,重新阅读。
(一)涂片染色镜检制备注意事项
1.一张载玻片上只能涂抹一份痰标本。
2.每张载玻片只能使用一次,不得清洗后再次用于抗酸杆菌(AFB)涂片检查。
3.涂抹后的痰膜不能太厚或者太薄,透过痰膜看报纸上的5号字时,字迹较模糊为适宜的厚度;看不见5号字或很清晰,则表明该玻片涂抹过厚或过薄。
4.由于香柏油(cedarwood oil)能够溶解复红染料,使萋-尼染色退色,并且容易干燥凝结,对油镜头造成损害;故禁止使用香柏油,必须使用显微镜专用的镜油(英文名:immersion oil for microscopy)。镜油折射系数(RI)应>1.5,20℃黏度系数应为100~120mPa·s。
5.采用荧光染色法镜检抗酸杆菌(AFB),只限于那些工作量较大(每人日读片数超过25张),具备荧光显微镜,且镜检人员接受过荧光染色镜检培训的实验室开展。
6.采用荧光染色时,荧光随着时间而衰减。故荧光染色后的涂片应于当日镜检;如果玻片数量过多,应将涂片放置于4℃避光保存,次日必须完成镜检。
(二)抗酸杆菌(AFB)痰检假阳性结果的预防措施
1.必须使用新玻片进行涂片检查。
2.每个标本均使用一个新竹签完成制片涂抹。
3.所有染液均经过滤。
4.染色时玻片彼此保持一定距离,相互彻底分隔开。
5.严禁使用染色缸染色。
6.染色时勿使玻片上的染液干燥。
7.滴加染色液或镜油时,避免容器滴口直接接触痰膜。
8.严禁物镜镜头直接接触痰膜。
9.作为对照,可采用已知结果为阴性的玻片完成染色镜检过程。
10.完整、准确地标注痰盒、玻片和登记实验登记本。
11.登记前、后对检验单和标本盒上的标注进行仔细核对。
12.准确记录和报告结果。
(三)抗酸杆菌(AFB)痰检假阴性结果的预防措施
1.确认标本是痰而非唾液。
2.确认每份标本至少有3ml。
3.选择脓样、干酪样、黏液分泌物涂抹制备玻片。
4.制备玻片时标本涂抹均匀,不要太厚或太薄。
5.使用高质量染料、严格按照配方配制染液。
6.严格按照操作程序完成染色过程。
7.判断结果为“阴性”前,必须阅读规定要求的视野数。
8.作为对照,可采用已知结果为阳性的玻片,完成染色镜检过程。
9.完整、准确地标注痰盒、玻片和实验登记本。
10.登记前对检验单和标本盒上的标注进行仔细核对。
11.准确记录和报告结果。
十一、试剂和材料
为保障痰涂片镜检工作的连续性,各实验室应根据实际工作负荷储存一定数量的实验耗材和相应试剂,储备量一般应比平均工作量高20%作为缓冲。每检查1 000份标本所实际消耗和应该储备的耗材和试剂见表2-1。
表2-1 实验室准备耗材(每检查1 000份标本)
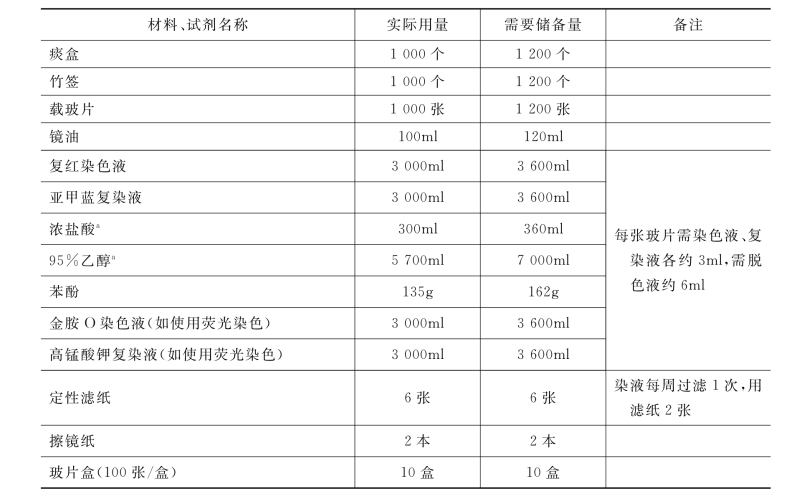
a.盐酸、乙醇的消耗量需根据脱色情况调整
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















