为了进一步验证miRNA在组织细胞内的表达水平,目前常用来检测miRNA表达的技术主要有以下几种:Northern blot杂交;原位杂交;Real-Time定量PCR(qPCR)。其中,Real-Time定量PCR主要有2种方法:poly(A)聚合酶加尾法Real-Time定量PCR和Stem-loop Real-Time定量PCR。Real-Time qPCR法采用的信号检测模式主要有两种:荧光染料渗入法和TaqMan探针法。前者成本低,但特异性差;后者特异性好,但每种miRNA都需要设计一个对应的TaqMan探针,成本相对较高。这几种技术各有利弊,可以相互结合应用,来反映细胞内miRNA的真实表达水平。
(一)poly(A)聚合酶加尾法Real-Time定量PCR
1.poly(A)聚合酶加尾法Real-Time定量PCR的基本原理 目前miRNA的检测方法主要有Northern Blot等基于分子杂交的方法,这些方法敏感度低、耗时长、RNA的用量较大。用Real-Time定量PCR技术对miRNA进行检测,具有快速、特异性强、灵敏度高等优点。poly(A)聚合酶加尾法Real-Time定量PCR是先用poly(A)聚合酶(PAP)处理总RNA,使miRNA的3'端加上一段poly(A)尾巴,然后用5'端含有接头序列的poly(T)引物进行反转录,使第一链cDNA加上一段接头,为随后的PCR扩增提供反向通用引物序列,再利用一条与miRNA序列特异的正向引物就可实现PCR扩增。以下用miRNA qPCR Detection Kit对miRNA进行检测(图2-14)。

图2-14 poly(A)聚合酶加尾法实时定量PCR检测miRNA的原理
2.实验材料
(1)主要实验仪器:冷冻离心机、常规PCR仪、分光光度计、电泳系统、Real Time PCR Detection System。
(2)主要实验试剂:Trizol、RNA级氯仿、冷冻异丙醇及冷冻的75%乙醇、DEPC灭菌水、液氮、10×Mops、甲醛、10×RNA电泳缓冲液、miRNA qPCR Detection Kit。
3.实验方法
(1)RNA的提取(见核酸的提取与纯化)。
(2)miRNA3’端进行加“Poly A”处理
1)融解加“PolyA”反应所需的试剂,上下轻微颠倒混匀,短暂离心后放置冰上待用。
2)PolyA Reaction反应液的配制
在冰上的预冷无RNase的反应管内加入以下试剂至总体积20μl。
在反应中使用的总RNA必须含有小分子RNA。
总RNA使用量可在100ng至10μg调整,如使用纯化的小分子RNA,其使用量可在10ng至1μg之间调整。
表2-11 PolyA反应液配制

(3)PolyA反应:混匀配制的反应混合液,短暂离心后在37℃反应15min。所得的反应液可以直接进行下游实验,也可以放置-20℃短暂保存,如需长期保存建议存放于-80℃。
(4)Poly A化的RNA进行反转录反应
1)融解反转录反应所需的试剂,上下轻微颠倒混匀,短暂离心后放置冰上待用。
2)RNA-Primermix的配制反应:在冰上预冷的无RNase的反应管内加入以下试剂至总体积13μl(表2-12)。
表2-12 RNA-引物混合液的配制反应

3)混匀RNA-引物混合液,短暂离心,直接65℃变性10min后立即放置冰上至少2min。
4)配制反转录反应液:在RNA-引物混合液反应管内加入以下试剂至总体积25μl(表2-13)。
5)反转录反应:混匀配制的反应mix,短暂离心后在42℃反应60min,再进行85℃5min灭活处理。所得的单链cDNA放置于-20℃保存。
表2-13 配制反转录反应液

(5)qPCR检测miRNA
1)miRNA检测引物设计:因为miRNA序列长度一般都在18~24bp,所以其检测的正向检测引物一般都直接选用其miRNA序列或为增加其检测的特异性而特殊设计的序列:如有的miRNA GC含量偏高或引物易形成引物二聚体,其引物可为miRNA3’端去除几个碱基后整理的序列。逆向引物则可选择通用引物即可。
2)miRNA qPCR 正向引物设计举例(以小鼠mmu-miR-125b-5p为例):
在miRNA Database中查找检测的miRNA序列,如图2-15所示:
miRNA Database:http://microrna.sanger.ac.uk/sequences/search.shtmL
则其正向检测引物可为:
miRNA序列 ucccugagacccuaacuuguga
Primer序列 tccctgagaccctaacttgtga(Tm:58.8)

图2-15 在miRNADatabase中查找检测的miRNA序列
3)融解2×qPCRmix(如有必要,融解50×ROXReference Dye)上下轻微颠倒混匀,短暂离心后放置冰上待用。冰上进行qPCR反应液的配制(所有miRNA进行复孔测试,同时进行单孔NTC(No template control)测试)(表2-14)。
表2-14 定量PCR反应液配制

4)2×qPCRmix设定为总反应体积的一半,其他组分请按最适比例进行调整。如需变更总反应体积,请保持最适条件下各组分的比例。
5)Rox Reference Dye使用在需要用Rox校正的Real-Time PCR仪,如ABI的定量PCR仪。
6)引物终浓度可在0.2~0.4μmol/L范围内调整,一般条件下0.2μmol/L的量即可达到理想的效果。
7)第1链cDNA通常需要稀释后再使用,防止反转录体系对qPCR体系的影响。
8)充分混匀qPCR反应液,添加至PCR反应管中,短暂离心,确保所有试剂到反应管底部。
9)qPCR反应,使用标准的三步法进行检测(表2-15)。
对于用SYBR Green染料法进行的qPCR的检测的反应都需要在循环结束后立即进行融解曲线分析(表2-16)。
表2-15 定量PCR反应条件

表2-16 定量PCR融解曲线分析

4.实验注意事项
(1)2×定量PCR反应液中采用的DNA聚合酶为经过特殊修饰的热启动酶,95℃10min能充分的激活酶活性。
(2)因miRNA的特殊性从而导致了其引物的特殊性,在检测时应严格控制退火温度,防止出现非特异性扩增。
(3)进行反转录的Oligo dT接头其长度为53bp,为此PCR扩增得到的片段长度一般在75bp左右(miRNA序列一般为22bp左右),所以延伸只需10sec即可。对产物的融解曲线判断可以发现其Tm值一般都在79~83℃,如果超出此范围,建议使用别的方法来验证产物的特异性(如电泳)。如使用的为不同公司的定量PCR仪,请按照不同的仪器要求,调整延伸时间及其融解曲线分析的条件。
5.实验结果实例 以下是用miRNA qPCR Detection Kit检测人组织中miRNA的表达水平。
所选的miRNA及其扩增长度信息如表2-17(图2-16)。
(二)Stem-loop实时定量PCR
1.Stem-loop实时定量PCR的基本原理 传统实时定量PCR只能检测到miRNA前体,而Stem-loop实时定量PCR技术可以解决这一问题。Stem-loop实时定量PCR是一项高特异度、敏感度的检测miRNA表达的实验技术,包括设计具有茎环(stem-loop)结构的反转录引物和用miRNA荧光标记的特异分子探针进行实时PCR二个关键步骤。该技术具有以下优点:高度特异性,对序列高度同源的miRNA也可精确区分,能检测只有一个碱基差别的不同miRNA的表达水平;超宽的定量线性范围和高度的检测灵敏度;样品消耗少,仅需1~10ng的总RNA;适用范围广,总RNA、细胞裂解物以及纯化的RNA都可用于miRNA的定量检测。
MicroRNA的RT-PCR一般使用茎环结构的引物,这种具有茎环结构的引物针对所需检测的目的microRNA设计,具有特异的序列。内参使用的是小RNAU6,U6的反转录使用的是随机引物。将反转录的产物作为real-timePCR的模板,检测目的microRNA的引物是针对目的microRNA的特异的上下游引物,检测内参使用的是针对U6的特异的上下游引物(图2-17)。
表2-17 人组织中miRNA的基本信息

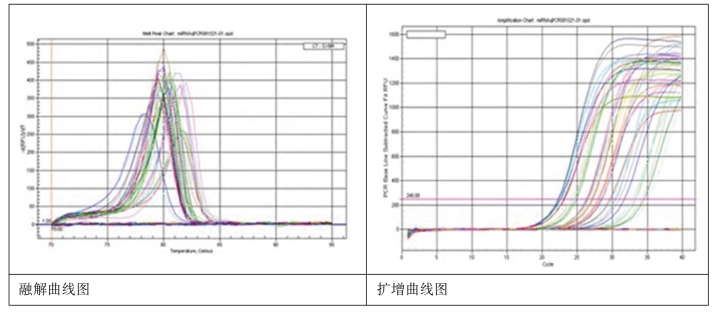
图2-16 20个miRNA及其内参U6的扩增曲线及其融解曲线结果

图2-17 Stem-loop实时定量PCR检测miRNA的原理图
2.实验过程
(1)用Trizol抽提总RNA,抽提方法同普通的RNA的Trizol抽提,只是在用异丙醇处理时需要4℃过夜。将抽提得到的RNA置于-80℃保存。
(2)将抽提的RNA进行反转录。反转录的体系一般使用12.5μl的体系。
具体的体系如下:
无RNase水
总RNA:0.625μg
反应缓冲液:2.5μl
dNTPs:2.5μl
RNase抑制剂:0.625μl
氯化镁:1.5μl
Primer:0.5μl
逆转录酶:0.625μl
具体的操作是事先计算好需要的模板量,以及所要的无RNase水的量,在PCR小管中加好需要的模板量以及量,并将剩下的模板立即置于-80℃保存。再按照反转录的体系做好总的MIX,再分装到每个PCR小管内。
(3)将PCR小管置于PCR仪上反转,反转的具体程序如下:25℃5min,42℃60min,70℃15min。4℃储藏。
(4)反转录的cDNA作为实时PCR检测的模板,由于实时PCR检测灵敏性,要求每个样需要3个重复。
每一个反应的用量如下:
SYBR 5.0μl
引物混合物 0.2μl
cDNA 1.0μl
水 3.8μl
(5)在八连管中先加入模板,加入3.4μl的cDNA模板。
(6)根据需要检测样本的个数,计算所需要的SYBR、引物混合物、水量,具体的计算过程为:试剂单反应量X检测样本个数X3.4,根据计算需要的量制作混合液。将混合液加入每个八连管的小管中。
(7)将对应的每个八连管的小管取出10μl加入96孔板,每个小管对应96孔板的3个孔,即3个重复孔。
(8)加完样品后,用专用的封膜覆盖96孔板,用专用的刮板覆盖严实。
(9)上机检测。具体PCR程序如下:
50℃2min;
95℃5min;
95℃30s;
60℃40s;
72℃30s;
95℃15s;60℃30s;95℃15s。
3.实验注意事项
(1)由于实时PCR的检测十分灵敏,因此它对RNA定量的准确性要求较高,一般RNA的定量多采用3复孔定量。
(2)无论在反转录或实时PCR加样时要求加样一定要准确。
(3)在将八连管的mix加入96孔板前一定要充分混匀,一般采取的策略是将八连管一剪为二,置于上振荡混匀,振荡的转速不要太高,以免将管内的液体溅到盖子内。
(三)Northern blot杂交
MicroRNA是一类很小的分子,部分microRNA表达水平可能很低,因而需要极为灵敏而定量的分析工具。由于其分子很小,用RT-PCR的方法来定量研究有一定困难,特别是重复性较差,步骤繁琐等。目前多数研究人员采用Northern Blot,它是一种重复性好、灵敏高、直接的方法,可以用来检测microRNA的存在、表达量的变化等。而由于放射污染等原因,同位素标记的探针的使用有一定的局限性。
1.基本原理 将待检测的RNA分子变性后,通过尿素变性聚丙烯酰胺凝胶电泳进行分离,继而按其在凝胶中的位置转移到尼龙膜上,固定后再与同位素、地高辛或其他标记物标记的DNA或RNA探针进行反应。如果待检物中含有与探针互补的序列,则二者通过碱基互补的原理进行结合,游离探针洗涤后用自显影或其他合适的技术进行检测,从而显示出待检的片段及其相对大小。Northern Blot可用于检测样品中的RNA及其含量,了解基因的状态,如是否有点突变、扩增重排等。
2.实验过程
(1)提前配制无过硫酸铵和TEMED的15%的尿素-PAGE胶的混合液,即
50ml预制胶:
尿素:24g
40%丙烯酰胺:18.75ml
5xTBE缓冲液:10ml
双蒸水:0ml
(2)器皿的清洗:器皿同Western Blot装置。
用清水冲洗干净,乙醇擦干3%;
H2O2填充浸泡电泳槽、玻璃片、梳子10min;
用0.1%DEPC处理过的水冲洗电泳槽,梳子和玻璃片。
用无RNAase擦海绵和其他相关器材。
(3)安装配胶装置。
(4)配胶:取10ml预制剂,加入33.3~45μl的过硫酸铵和10~20μl的TEMED,混匀,加入玻片中,加入10或15齿梳子。30~60min即可凝好。
(5)RNA样品的准备:小RNAs(大约107细胞)(或者总RNA20~200μg)在18μlDEPC水加入2μl10xRNA上样缓冲液。95℃加热5min,冰上冷却。瞬时离心收集RNA样品。
(6)电泳:(装置同Western Blot电泳装置),电泳液1xTBE。
15%尿素-PAGE在电泳液1xTBE进行电泳。电压180V直到溴芬兰到达胶的底部。在上样之前,300V预电泳10min(防止胶漏同时活化胶),然后用电泳液1xTBE冲洗孔,将尿素冲出后然后小心、迅速加样。其中溴芬兰的对应的分子量为13bp左右,二甲苯青FF对应的为40bp左右。
(7)转膜(装置同Western Blot转膜装置),转膜液为0.5xTBE。
1)将胶浸泡在0.5xTBE大约10min。
2)用溴乙锭(0.5μg/ml)染胶10min后,用紫外凝胶观测RNA电泳情况。用0.5xTBE洗胶5min。
3)用铅笔标记好转膜的面,将尼龙膜和两片厚滤纸浸泡在0.5xTBE大约10min。
4)制备凝胶、膜夹层。将滤纸、胶、膜、滤纸形成三明治结构,注意胶应该靠近阴极侧。注意每层间不能有气泡。
5)装配好转膜装置,装置同Western Blot转膜装置。
6)于冰上300mA转膜1h。
7)把膜(RNA面朝上)放在紫外交联仪中使用4000JUV进行交联。
8)将膜夹在厚的滤纸中间,80℃烘烤0.5~2h,可以轻压,以防止膜发生翻卷。
9)如果可以直接做,则放在室温即可;也可以储存在4℃,直到使用(可储存6个月)。
10)亚甲蓝(methylene blue)染色3~5min,在可见光下黄色滤光片对膜照相。
(8)杂交
1)在杂交炉中37~42℃的杂交液(7%SDS,0.2mNa2HPO4)中预杂交1h,然后将膜放入杂交袋,然后加入配好浓度的地高辛标记探针,在杂交炉中37~42℃杂交过夜。
2)地高辛标记探针使用浓度:将10μl的25μM的公司原液稀释10倍后分装储存,取储存探针液(2.5μmol/L)20μl/6ml(U6内参)或2.7~27μl储存液/10ml杂交液(根据miRNA的量或丰度定)。
3)37~42℃洗膜液(2×SSC,0.1%SDS)洗膜3次,每次15min。
4)室温MABT(0.1mmol/L马来酸,0.15mNaCl,0.3%Tween-20,pH7.5)洗膜3次,每次5min。
5)室温用封闭液(用MAB10倍稀释10×封闭液)封闭1h。
6)室温加入抗地高辛抗体40min(1∶10000~1∶5000封闭液)。注意:抗体用之前,应该以12000r速度离心5min。
7)用MABT液洗膜2次,每次15min。
8)膜在检测液(0.1mTris-HCl,0.1mNaCl,pH9.5)中平衡5min。
9)配化学发光液(1∶100),有RNA的膜面向上放入杂交袋中,加入1ml配好的化学发光液,挤出气泡,封口,孵育5min。
10)挤出化学发光液,封口,37℃孵育5~15min。
11)曝光2min至1h(根据情况定)。一般内参U6在5min内即可显影。
3.实验注意事项
(1)配胶时,由于浓度较大,所以尿素比较难溶,尿素的溶解不能加热,可以采用振荡或颠倒离心管;配好的无过硫酸铵和TEMED的15%的尿素-PAGE胶可以储存在室温或4℃冰箱中(可储存1个月左右)。
(2)电泳前,应该按照步骤将装置尽量进行无RNAase处理。
(3)RNA上样前,300V预电泳10min(防止胶漏,同时活化胶),然后用电泳液1xTBE冲洗孔,将尿素冲出后然后小心、迅速加样。此操作需要一定的训练,因为加样孔中很快会析出尿素,一旦有尿素析出对RNA电泳的形态会有一定的影响。
(4)LNA探针使用前进行分装,然后冻存于-70℃冰箱中。
(5)不同miRNA杂交的温度和时间不同,需要进行条件的摸索。一般内参温度为42℃。
(6)尼龙膜紫外交联和烘烤后,可以在4℃冰箱中保存半年以上。
(四)原位杂交
原位杂交分为细胞和组织内原位杂交,该技术检测miRNA表达,可更直观地展示出miRNA的时空表达模式。它不仅可以检测不同细胞系单个细胞中的miRNA表达,还可在不经分类和分离的情况下,比较不同细胞系中miRNA的表达水平。它是分析miRNA表达组织和时序特异性的有力工具。
1.实验仪器 恒温箱,正立荧光显微镜,摇床。
2.实验试剂 Let-7探针;3′-末端标记试剂盒、抗地高辛抗体、NBT/BCIP;蛋白酶K;甘氨酸、绵羊血清、牛血清白蛋白、三乙醇胺、甲酰胺、乙酸酐和Tween-20为常规试剂。
3.实验方法
(1)地高辛标记杂交探针
1)用末端转移酶将LNA(Locked Nucleic Acid,铆定核酸)修饰的探针的3′-末端标记上地高辛-ddUTP并将其配置成1μM。后放置在-20℃保存。
2)标记反应体系如下(表2-18)。
表2-18 地高辛标记探针反应体系

3)混匀后离心37℃孵育15min后放置在冰上。
4)加入2μl0.2mEDTA(pH8.0)终止反应。
5)用G25层析柱纯化探针。
(2)分子杂交
1)二甲苯脱石蜡10min×2次,然后用梯度乙醇脱水(100%,95%,80%,75%,每次5min),然后用双蒸水洗两次。
2)将组织载玻片浸入0.2N的HCl内5min,PBS洗涤,40g/ml蛋白酶K25℃消化20min,0.2%甘氨酸/PBS洗涤,PBS洗涤两次,用4%的多聚甲醛室温固定10min。
3)PBS洗涤5min×2次,常温条件下用乙酸酐/三乙醇胺(6.25μl乙酸酐,5.2μlof12NHCland14μl三乙醇胺/1mlddH2O)处理10min,PBS洗涤5min×4次,5×SSC洗涤5min×2次。
4)每张切片加预杂交液(60%甲酰胺,5×SSC,0.1%Tween-20,9.2mmol/L枸橼酸,50g/ml肝素,500g/ml酵母tRNA,pH6.0)20μl,恒温箱49.5℃放置2h。
5)吸取多余液体,加杂交液(2μl的探针放入100μl预热的杂交缓冲液),将盖玻片盖于切片上,恒温箱49.5℃过夜。
(3)杂交信号的检测
1)杂交后揭掉盖玻片,5×SSC洗涤切片5min×2次,50℃条件下50%甲酰胺/2×SSC洗涤20min×3次。
2)TBST(0.1mmol/LTrispH7.5,0.15mmol/LNaCl,0.1%Tween-20)洗涤切片5min×5次后,滴加封闭液(2%羊血清,2mg/ml牛血清白蛋白/TBST)封闭1h。
3)甩去多余液体,滴加抗地高辛抗体(用封闭液稀释1∶1000),4℃放置16h。
4)用TBST洗涤切片10min×4次,染色液(100mmol/LTris-HClpH9.5,50mmol/LmgCl2,100mmol/LNaCl,0.1%Tween-20)洗涤10min×2次,然后将新鲜配制的颜色反应缓冲液氮蓝四唑/5-溴-4-氯-3-吲哚磷酸二钠盐(NBT/BCIP)(1ml染色液,2.4μlof100mg/mlNBT,3.5μlof50mg/mlBCIP,1mMlevamisole)滴在玻片上,孵育4~48h,注意避光和防止干燥。
5)将切片放入终止缓冲液(1×TEpH8.0)中终止反应后,显微镜观察细胞着色情况,拍摄照片。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















