3.3.1 Cu,Zn-SOD的活性中心及其催化机理
3.3.1.1 Cu,Zn-SOD的活性中心氨基酸残基的保守性
从1980年获得的2 分辨率电子密度图中,可以比较清晰地看到牛血红细胞Cu,Zn-SOD活性中心附近氨基酸位置的排列,如图3-14所示,结合底物O2-的是一个椭圆形的“口袋”,长15
分辨率电子密度图中,可以比较清晰地看到牛血红细胞Cu,Zn-SOD活性中心附近氨基酸位置的排列,如图3-14所示,结合底物O2-的是一个椭圆形的“口袋”,长15 ,宽9
,宽9 ,深6
,深6 ,口袋外缘一边由Thr135,Gly136,Ala138和Gly139组成,另一边由Gly59,Pro60,His61以及Phe62和Asn63组成,Lys134和Arg141的侧链锁住口袋两侧,口袋底部是Cu,Zn,Asn81以及His118,His44,His78和His69。高分辨率的谱已经揭示人红细胞、酵母和麦胚的Cu,Zn-SOD与牛红细胞Cu,Zn-SOD的活性中心构象是相同的。对SOD中金属辅基配位场几何构型研究是探讨活性中心结构的重要方面,应用ESR,NMR,化学修饰结合X射线晶体结构分析,确定了Cu是与四个His残基咪唑环的N原子构成近似四方平面的配位结构,Cu和Zn之间通过共同连接His61而形成“咪唑桥”结构。
,口袋外缘一边由Thr135,Gly136,Ala138和Gly139组成,另一边由Gly59,Pro60,His61以及Phe62和Asn63组成,Lys134和Arg141的侧链锁住口袋两侧,口袋底部是Cu,Zn,Asn81以及His118,His44,His78和His69。高分辨率的谱已经揭示人红细胞、酵母和麦胚的Cu,Zn-SOD与牛红细胞Cu,Zn-SOD的活性中心构象是相同的。对SOD中金属辅基配位场几何构型研究是探讨活性中心结构的重要方面,应用ESR,NMR,化学修饰结合X射线晶体结构分析,确定了Cu是与四个His残基咪唑环的N原子构成近似四方平面的配位结构,Cu和Zn之间通过共同连接His61而形成“咪唑桥”结构。
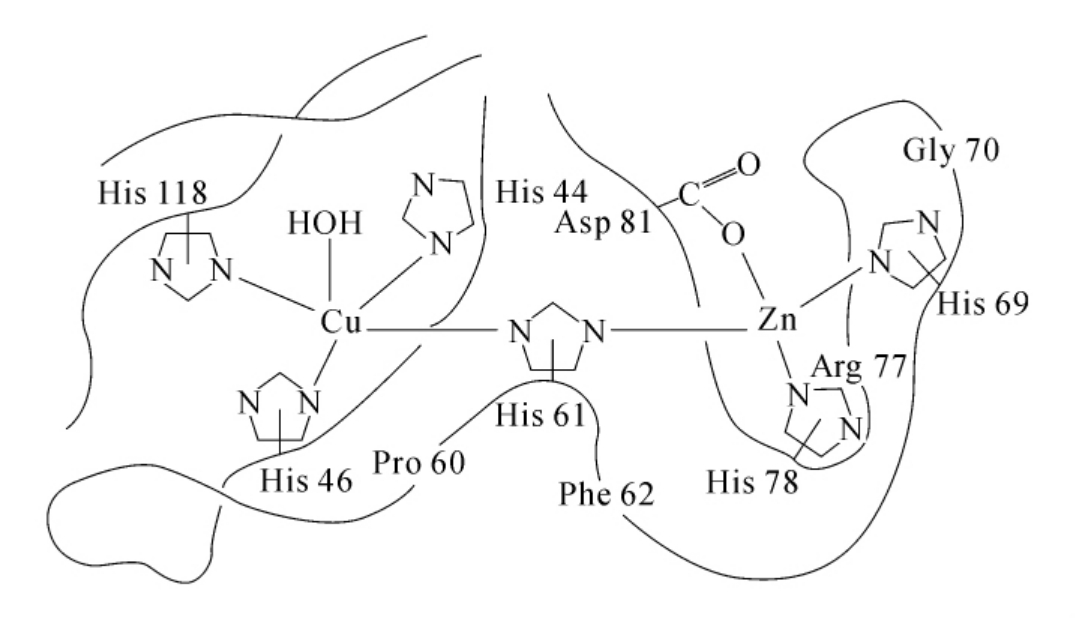
图3-14 牛红细胞Cu,Zn-SOD活性中心的“咪唑桥”结构示意图
如图3-14所示,Cu,Zn-SOD活性中心中,Cu2+被四个组氨酸残基His44、His46、His61和His118的咪唑环上的N原子配位,另外一个水分子中的O在轴向与Cu2+配位构成一个畸变的N4O四方锥结构,而Zn2+被His61,His69,His78咪唑环上的N原子和Asp81的一个羧基O原子配位形成一个近似N3O四面体的结构。His61的咪唑起着桥的作用,将Cu2+,Zn2+连接起来,Cu2+与Zn2+之间间距为6.3 。
。
当除去或与其他金属离子取代SOD活性中心结构中的Zn2+时,SOD仍然保持较高的活性,但是当Cu2+被除去或者被其他金属离子取代时,则酶活性几乎丧失,表明Cu2+是具有活性不可缺少的因素。
在应用组氨酸C-2质子交换技术和γ-线扰动角关联(PAC)技术研究酵母Cu,Zn-SOD中金属与酶蛋白的配位关系后,有人对活性中心的“咪唑桥”结构提出疑义,认为H63(即相对于牛酶中的H61)很可能单独与Zn配位。由于不同来源的Cu,Zn-SOD之间具有结构的同一性,所以推测由酵母酶得到的结论可以推广到其他来源的Cu,Zn-SOD,即酶的活性中心不一定呈现“咪唑桥”结构特征。
“咪唑桥”结构的提出是基于X射线晶体结构分析,而酵母酶的工作是基于溶液构象研究,晶体结构与溶液构象之间出现某些差别是可以理解的,更重要的是“咪唑桥”活性中心绝非刚性的固定结构,而应该是一种柔韧的灵活的连结,任何化学、物理的因素都可能影响它,而这种若即若离的结构灵活性可能正是酶发挥催化功能所必需的。
ESR和电子能谱测定Cu,Zn-SOD中Cu的超精细偶合常数A11为0.143cm-1,这是典型五配位Cu配合物的值。而NMR对Cu,Zn-SOD水溶液中水的质子交换弛豫时间测定,发现Cu与组氨酸咪唑环N原子构成的四方平面配位场的轴向位置上还结合有1分子H2O,从2 分辨率电子密度图上也发现Cu的轴向位置上有1水分子的吸收峰,而Fe-SOD和Mn-SOD的金属离子上也都结合有1个水分子,这1个水分子的存在可能与催化机理有关。
分辨率电子密度图上也发现Cu的轴向位置上有1水分子的吸收峰,而Fe-SOD和Mn-SOD的金属离子上也都结合有1个水分子,这1个水分子的存在可能与催化机理有关。
利用高分辨率的H NMR谱,ESR,NMR化学修饰等方法结合X射线晶体结构分析,不同来源的SOD分子的活性中心结构大体相同。各种来源的SOD的Cα骨架结构极其相似,只有少数的残基发生变化。图3-15为各种来源的Cu,Zn-SOD活性中心结构图。
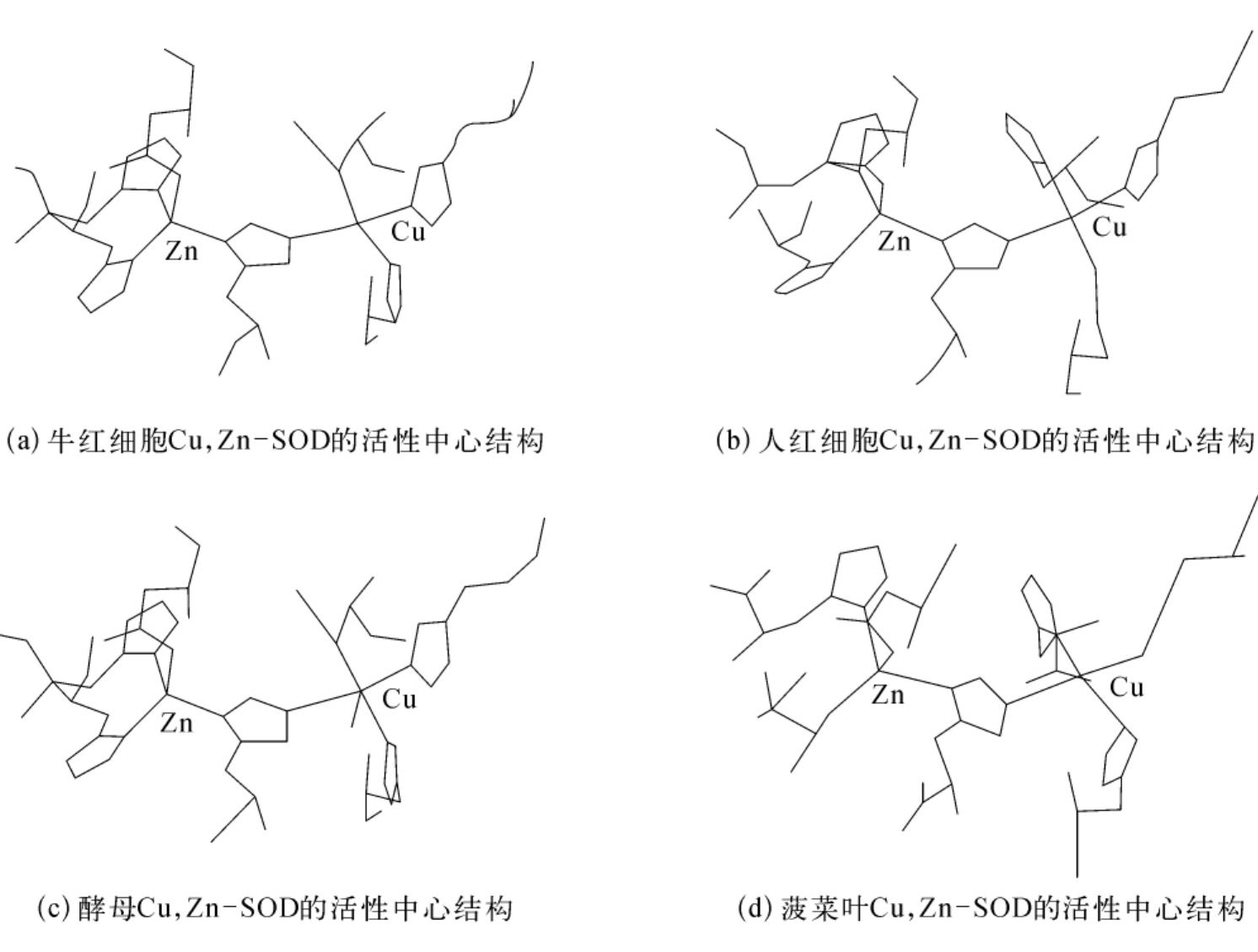
图3-15 不同来源的Cu,Zn-SOD活性中心结构图
3.3.1.2 Cu,Zn-SOD的活性中心的金属结合位点
A.人Cu,Zn-SOD及其突变体M4SOD单体的金属结合部位
通过改变疏水界面亚基的疏水残基制备了一些人SOD的单体,这些变异尽管远离活性中心但是却极大地减少了催化效率。4个疏水残基(50苯丙氨酸,51甘氨酸,148缬氨酸,151异亮氨酸)突变成2个谷氨酸和2个赖氨酸,虽然保持和天然二聚体SOD相同的电荷,却仅保持25%的活性。
图3-16描绘了金属结合位点。所有的金属配体都有明显的结构,Cu(Ⅰ)与His46,His48,His120相协调,His63的Nε2原子质子化并通过Nδ1和锌结合,进一步与His71,His80和Asp83结合,呈现出通常的四面体配位。Cu(Ⅰ)离子从N的三个配体形成的平面向与His63的Nε2质子相反的方向上偏离0.4 ,这个质子位于距铜2.9
,这个质子位于距铜2.9 处。这会导致扭曲的三角配位几何体从Cu原子背离120°。His63位于活性中心腔的中间,从Arg143的胍基和腔的开口处掩蔽Cu(Ⅰ)离子,在这个结构中,Cu(Ⅰ)离子完全被蛋白原子埋藏在没有溶剂可及的表面。
处。这会导致扭曲的三角配位几何体从Cu原子背离120°。His63位于活性中心腔的中间,从Arg143的胍基和腔的开口处掩蔽Cu(Ⅰ)离子,在这个结构中,Cu(Ⅰ)离子完全被蛋白原子埋藏在没有溶剂可及的表面。
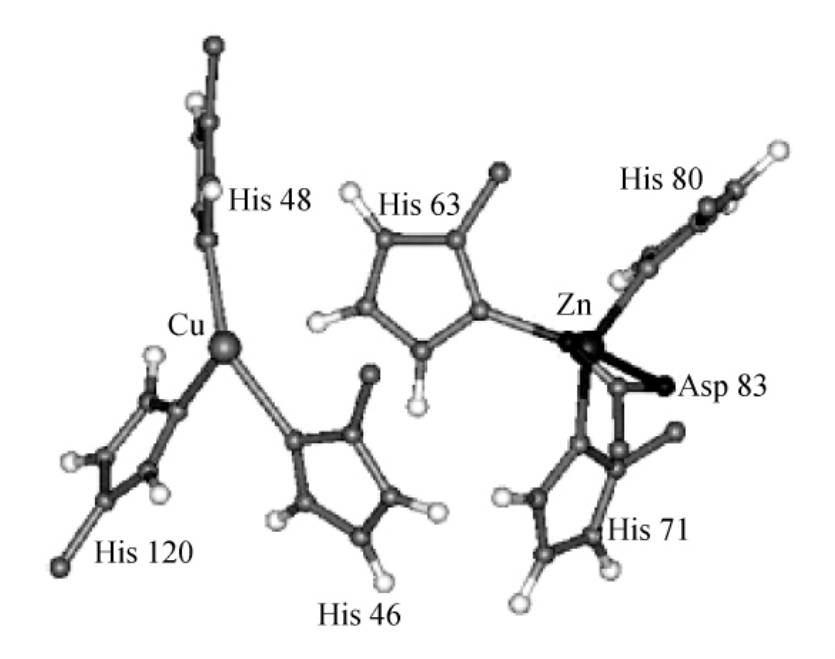
图3-16 还原型人Cu,Zn-SOD突变体M4SOD的金属离子和其配体的结构
(摘自Banci I B,et al.JBIC,1999)
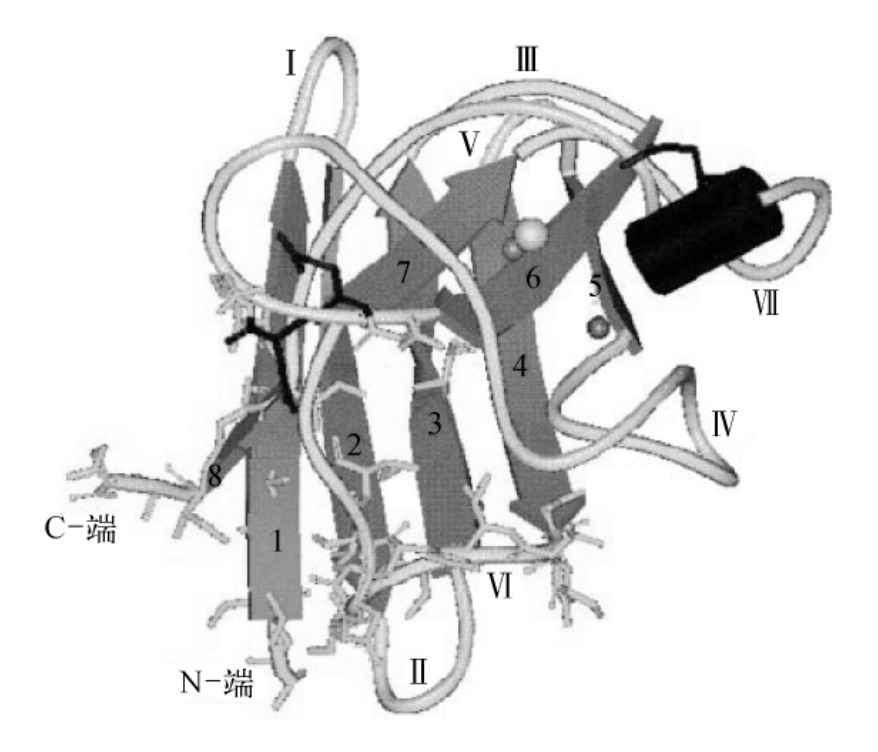
图3-17 Q133M突变体Cu,Zn-SOD二级结构图
(摘自Getzoff E D,et al.Nature,1983)图中标示出折叠及环的编号和位置(该编号与正常Cu,Zn-SOD相同)
B.牛红细胞Cu,Zn-SOD5RN中的金属位点
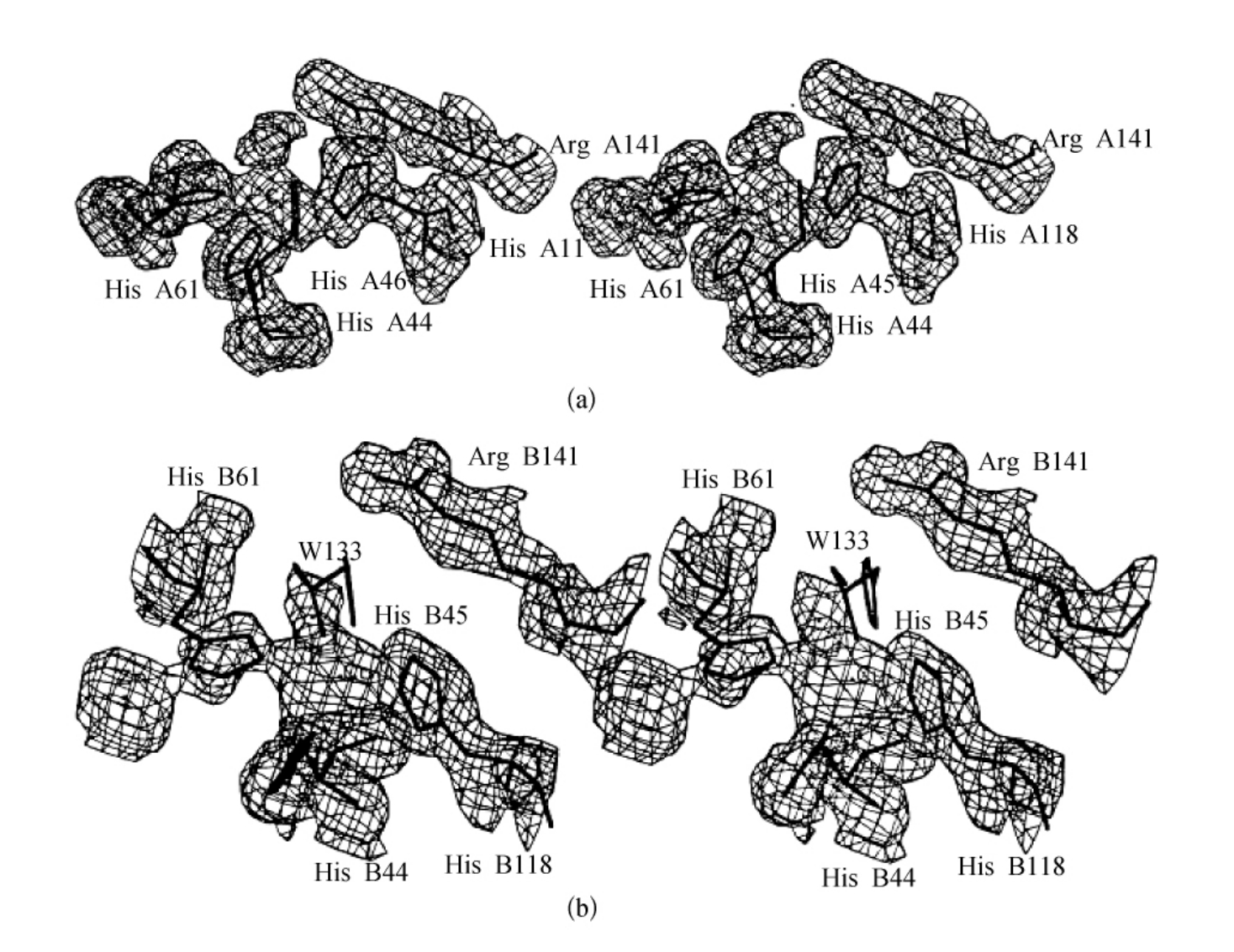
图3-18 SOD5RN A,B亚基中Cu位点的不同(3F0-2FC)傅里叶图的立体概貌
为清晰起见,忽略了His46残基的电子密度。(摘自S Mangani,et al.JBIC,1998)
图3-18显示了SOD5RN A,B亚基中金属位点的不同3F0-2FC傅里叶图的立体概貌。正如已经在还原型牛Cu,Zn-SOD(pH为7.5)结构中观察到的,在A亚基中Cu(Ⅰ)与四个His相连,并且通过His61桥与Zn相连,其Cu与His61的Nε2的距离仍然为2.2 ,另一方面,B亚基中的His61出现了紊乱,以致它的Nε2与Cu的距离为2.4
,另一方面,B亚基中的His61出现了紊乱,以致它的Nε2与Cu的距离为2.4 。然而,A亚基最重要的特点是铜离子附近额外的高电子云的出现,这种高电子云并不是通常在凹槽中找到的水分子所产生的。然而,电子云图谱清晰地表明,剩余的金属被4个His侧链所连接,连接距离为从2.1
。然而,A亚基最重要的特点是铜离子附近额外的高电子云的出现,这种高电子云并不是通常在凹槽中找到的水分子所产生的。然而,电子云图谱清晰地表明,剩余的金属被4个His侧链所连接,连接距离为从2.1 ~2.3
~2.3 。
。
在B亚基中却出现了不同的情况,铜原子被这4个His围着,同时,水分子占据了铜的第五位置,且与铜保持2.5 的距离,然而在图3-18(b)中可以看到水分子跟其他链的电子云一样,都很分散,这表明它们所处的状态是紊乱的。另外,His61的咪唑环偏离在Cu与Zn之间的最佳桥位。Nε2处于铜与水分子之间的连线的中点处,Cu和水分子与Nε2的距离均是2.4
的距离,然而在图3-18(b)中可以看到水分子跟其他链的电子云一样,都很分散,这表明它们所处的状态是紊乱的。另外,His61的咪唑环偏离在Cu与Zn之间的最佳桥位。Nε2处于铜与水分子之间的连线的中点处,Cu和水分子与Nε2的距离均是2.4 。
。
表3-3 pH 5.0条件下的还原性Cu,Zn-SOD的Cu(Ⅰ)和Zn(Ⅱ)的配位球的键长和键角比较
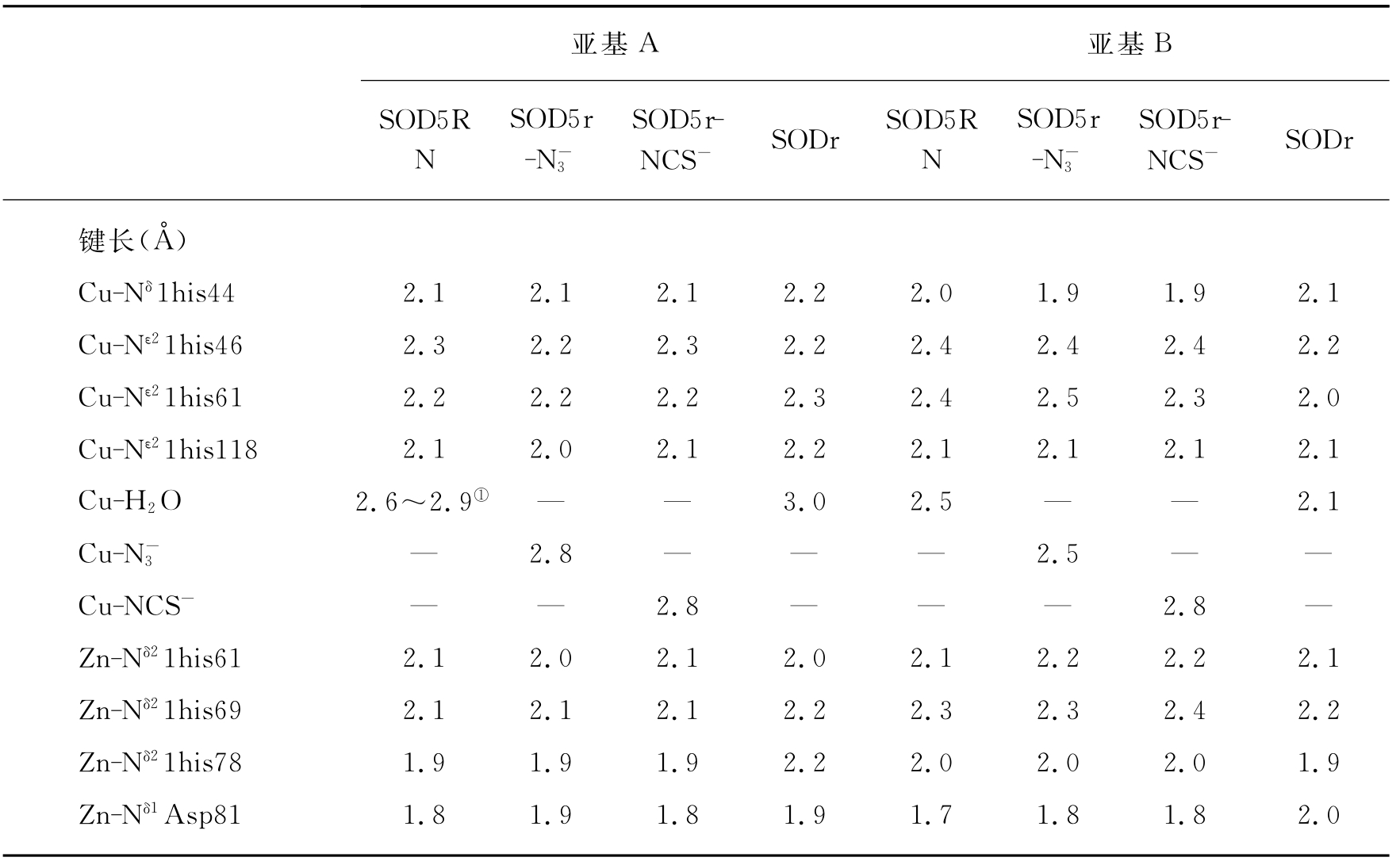
①pH为7.5条件下的还原性Cu,Zn-SOD的键长对比。
最后值得一提的是,A,B亚基中不同的铜连接是跟两亚基的不同晶体环境有关的。事实上,通过对分子接触的分析,发现A亚基的两个环(环Ⅳ和Ⅶ)用11个残基组成了16次接触,而在B亚基中,有2个残基在环Ⅶ中的残基形成了6次接触,分子间的接触是由环Ⅳ和Ⅶ促成的;而这两环又是构建活性部位所需蛋白质的外在部分。环的编号及位置见图3-17。
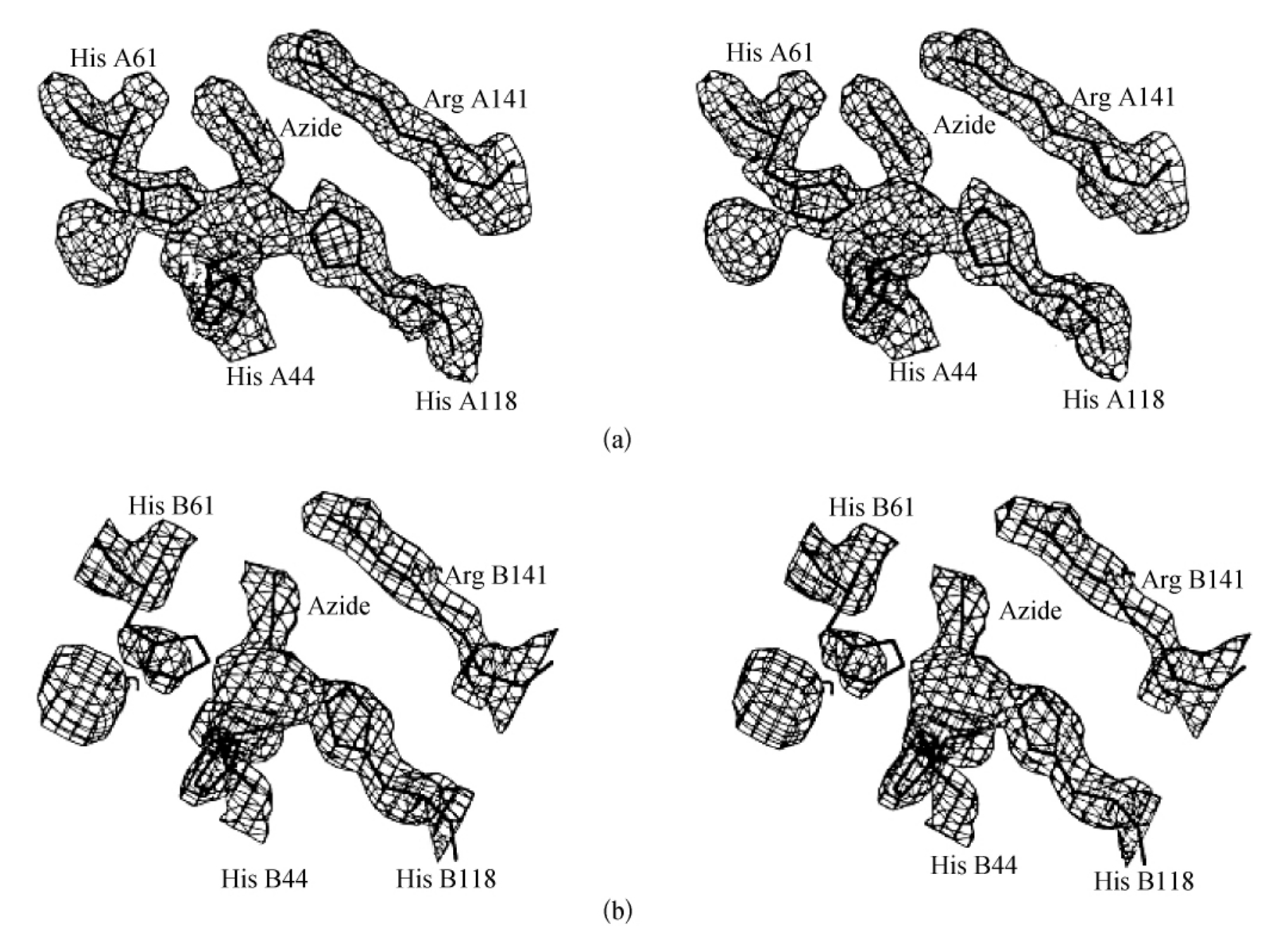
图3-19 SOD5RAZ中A,B亚基中铜位点的不同(3F0-2FC)傅里叶图
为清晰起见,忽略了His46残基的电子密度。(摘自S Mangani,et al.JBIC,1998)
C.牛红细胞Cu,Zn-SOD5RSCN中的金属位点
图3-20(a)、(b)显示了SOD5RSCN A,B亚基中的Cu位点的不同傅里叶图。尽管B亚基中的电子云不够强烈,仍然可以清楚地看到细长的电子云从铜延伸到活性部位的位点。A,B亚基位点中的SCN-被固定于电子云中,并且被修正为其最近原子与Cu(Ⅰ)的距离为2.6 。
。
A亚基中铜也表现得更有规则,且几何图形更接近三角双锥(His61和His118处于轴心配体上)。然而B亚基是一个扭曲的四面体结构,有SCN-轻微的作用。在A亚基中,His61与Cu(Ⅰ)连接且之间距离为2.2 ,然而在B亚基中,His61处于SCN-的N与Cu之间的中点处(距离分别为2.5
,然而在B亚基中,His61处于SCN-的N与Cu之间的中点处(距离分别为2.5 和2.3
和2.3 )。再次表明His61咪唑环的紊乱状态并且与Cu分离。
)。再次表明His61咪唑环的紊乱状态并且与Cu分离。
3.3.1.3 Cu,Zn-SOD的活性中心的活性通道
(1)活性通道。图3-17标示出了Cu,Zn-SOD二级结构的环及折叠的位置及编号。活性通道由53~60的氨基酸残基组成的环(Ⅳ)和环130~143的氨基酸残基组成的环(Ⅶ)的一部分组成。后者带有电荷。这些保守的氨基酸残基提供的静电势使得底物可以运动到反应位点。这个环是有序的,Thr137,Glu132,Lys136和Gln133在3F0-2FC图中有确定的电子密度。
但是,侧链Arg143决定着超氧化物的正确取向,它在催化腔内是非常保守的,并且电子云高度无序。
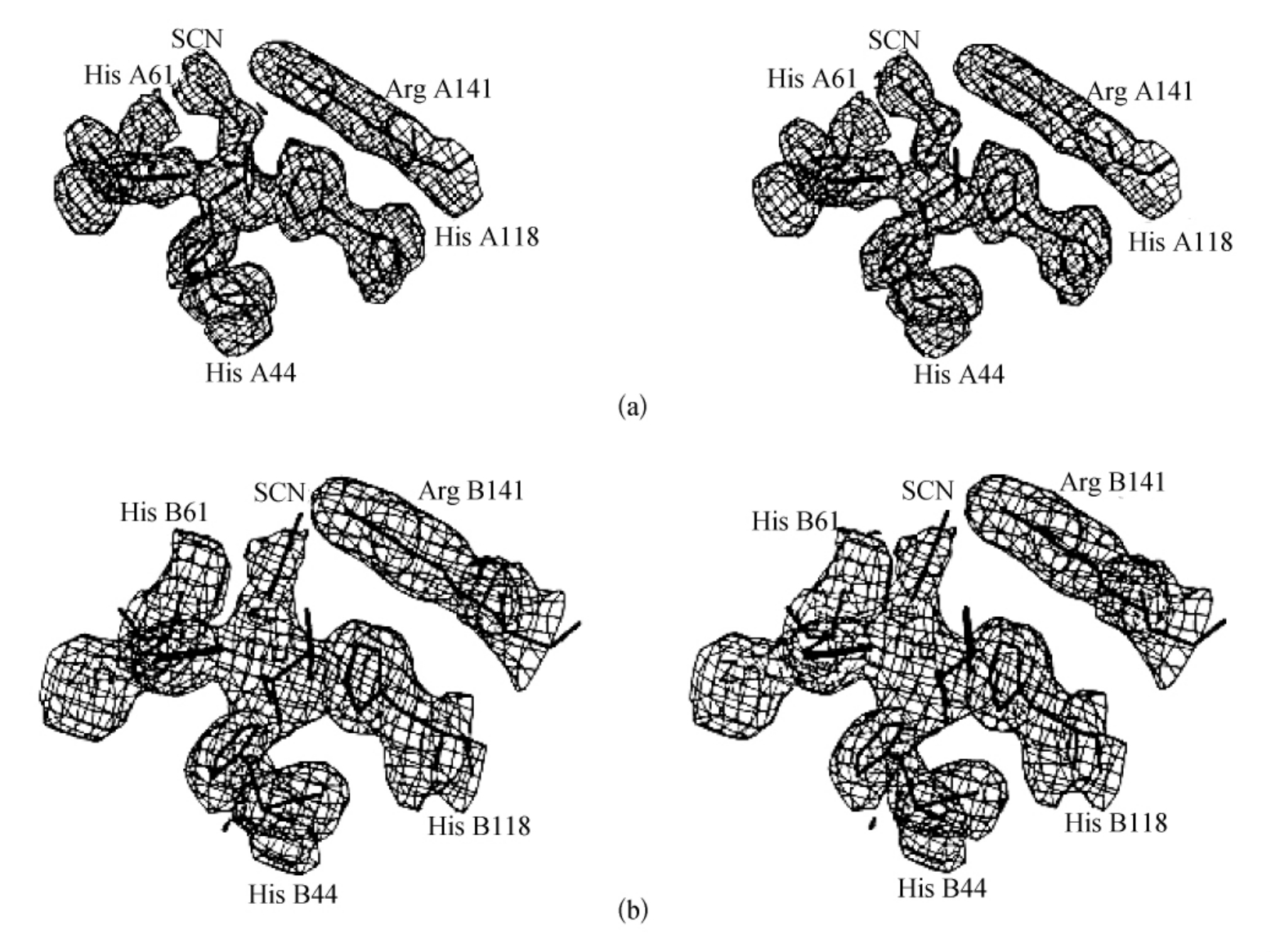
图3-20 SOD5RSCN A,B亚基中的Cu位点的不同(3F0-2FC)傅里叶图
为清晰起见,忽略了His46残基的电子密度。(摘自S Mangani,et al.JBIC,1998)
由于环(Ⅳ)的变动使得活性腔的宽度和深度比野生型Cu,Zn-SOD的略微增加,在野生型Cu,Zn-SOD中宽度是21 ,深度是11
,深度是11 ,而现在宽度变为23
,而现在宽度变为23 ,深度变为13
,深度变为13 。另外第二个活性位点内137位的苏氨酸和143位的精氨酸的Cα的距离增加到2
。另外第二个活性位点内137位的苏氨酸和143位的精氨酸的Cα的距离增加到2 。有趣的是,这些结果和还原型单体溶液的结构形成了强烈的对比,在还原型单体溶液结构中正好相反。实际上,在还原型单体溶液结构中缝的宽度比在人的氧化型二聚体SOD中减少到了3
。有趣的是,这些结果和还原型单体溶液的结构形成了强烈的对比,在还原型单体溶液结构中正好相反。实际上,在还原型单体溶液结构中缝的宽度比在人的氧化型二聚体SOD中减少到了3 。在其他Cu,Zn-SOD中,活性通道结构是非常有序的,在蛋白质表面,水分子和金属位点相结合。
。在其他Cu,Zn-SOD中,活性通道结构是非常有序的,在蛋白质表面,水分子和金属位点相结合。
(2)活性通道的构象及组成。已知Cu,Zn-SOD的活性受到活性通道静电区域的高度影响,这个区域可以使得底物向活性区域的铜离子靠近。每个亚基分子的两个部分都包括这个通道的构象:①环(Ⅶ),这个环中带负电荷和正电荷残基组成了正确的静电区域来吸引阴离子的亚基;②环(Ⅳ)中Cys57和Cys146位的半胱氨酸的二硫键。该二硫键的存在对二聚体酶的构象的改变有很大的关系,并且它是高度无序的。
在野生型Cu,Zn-SOD中,Arg143通过和环(Ⅳ)中的Cys57的羰基氧形成一个氢键来与环(Ⅳ)相互作用,这个氢键对Arg143在腔内的定位是非常重要的。这个重要的催化残基的侧链的无序性是由环(Ⅳ)中的二硫键的高度灵活性所导致的。亚基的Cys57无序使得Arg143不在环(Ⅳ)上,这就是它具有高水平移动性的原因。
(3)人Cu,Zn-SOD单体突变体的活性通道。通过改变疏水界面亚基的疏水残基制备了一些人SOD的单体,这些变异尽管远离活性中心但是却极大地减少了催化效率。4个疏水残基(Phe50,Gly51,Val148,Ile151)突变成2个Glu和2个Lys,虽然保持和天然二聚体SOD相同的电荷,却仅保持25%的活性。
单体在腔的大小尤其是腔内活性位点的入口的宽度是不同的。对其溶液进行共振离子化质谱法分析,发现结构的一端是Thr58位,另外一端是Lys136。这个入口的宽度比在二聚体中的宽度有所减少,在HSOD中Thr58的CO-Nξ到Lys136的距离是15 ,M4SOD中是13
,M4SOD中是13 ,在E133QM2SOD中是11
,在E133QM2SOD中是11 。可以注意到一个有趣的现象,就是随着这些酶的活性的减少,与之相关的宽度也在减小。
。可以注意到一个有趣的现象,就是随着这些酶的活性的减少,与之相关的宽度也在减小。
短的α-螺旋构成环(Ⅶ)的初始结构,实际上是一个小的但有意义的轴向移动,它的初始部分(残基132和133)使得它向酶活性部位通道相反方向的靠近,这个移动促成了活性部位的入口的宽度减少,并且造成广泛的氢键网络在静电环内的重排,从而影响带电侧链的构象。
带电残基的最主要的变化发生在:静电环的132位的带电的Glu残基和位于催化腔的相反方向的Arg143。前一个残基与Lys136之间形成一个强的氢键相互作用,也可以和Glu133形成一个强的氢键相互作用。这两个Glu带负电的羧基均指向Lys136。这是由于Glu132侧链的大的移动造成的,Glu132比在HSOD中更靠近铜离子,现在位于活性中心通道的一个边缘,在这个入口处产生了更多的负电势。在E133QM2SOD中,也观察到Glu133的尽管比较小但相似的移动,因此,这种重新定向是单体化的结果。另一方面,在HSOD中,Glu132指向溶剂并且不和Lys136发生任何作用。
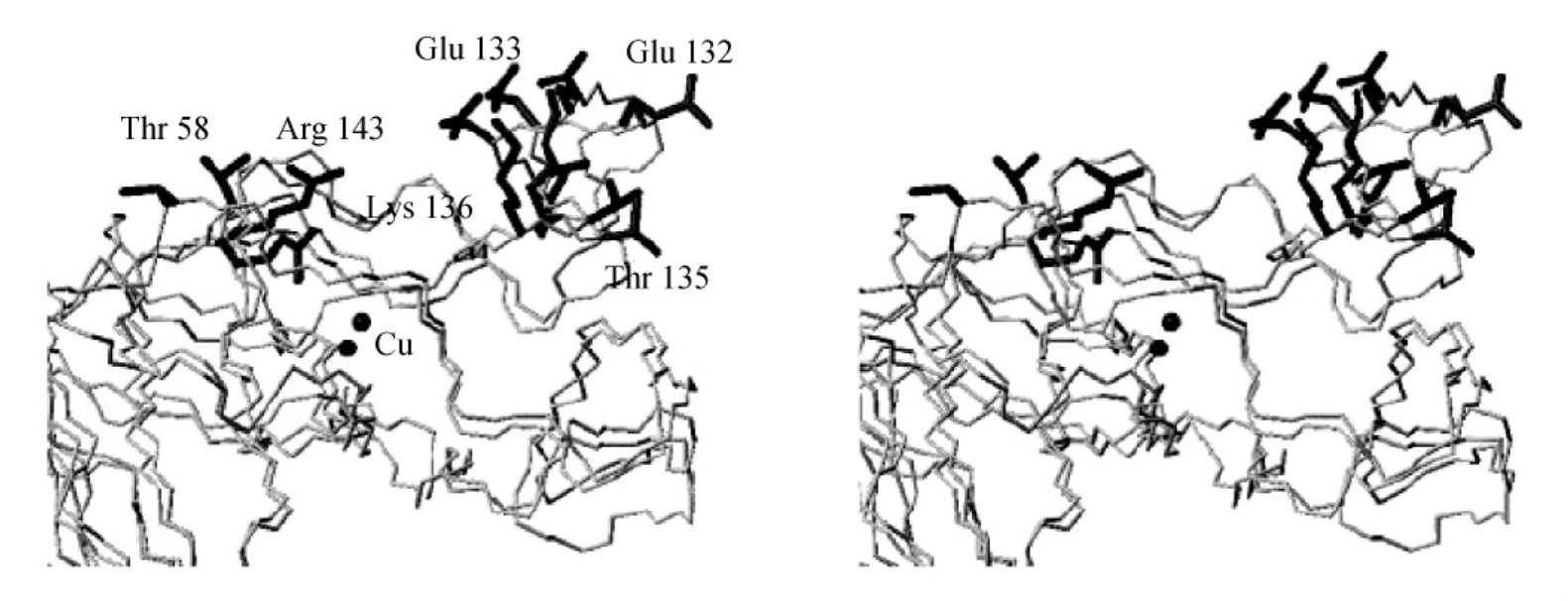
图3-21 还原型M4SOD的静电环的活性中心通道的立体图,和氧化型的人Cu,Zn-SOD的一个亚基
(摘自Banci I Bertini,et al.JBIC,1999)
活性部位的催化腔的深处有Arg143和Thr135,在所有的二聚体的酶的晶体结构中这种定向效应在侧链上是很保守的。和Arg143的NηH2基团与Cys57羰基氧及Thr58的羰基氧形成氢键。在M4SOD中,前一个氢键被破坏掉,但是在整个结构中与Thr58CO之间的相互作用仍然存在。在M4SOD中,由于50~68之间的环的无序,Cys57和Thr58也是高度无序的,并且与HSOD中的构象不同。因此,虽然Arg143和Thr58之间的氢键是保守的,但Arg143却改变了构象。它的侧链离开铜离子向活性区域开口靠近,胍基氮大约离Cu(Ⅰ)有9 (在HSOD为6
(在HSOD为6 ),因此从溶液中隐藏了金属位点。与HSOD相比,E133QM2SOD的X-射线衍射结构和溶液结构中均观察到,Arg143位置远离铜离子。
),因此从溶液中隐藏了金属位点。与HSOD相比,E133QM2SOD的X-射线衍射结构和溶液结构中均观察到,Arg143位置远离铜离子。
所有的结构中,Thr135的构象是必不可少的,这个残基对着Arg143,并且和Arg一起形成活性中心的较深的第二个瓶颈结构。在M4SOD中,尽管它与HSOD具有相同的电荷,这个瓶颈的宽度比HSOD的要窄,这与M4SOD的酶活性减少是一致的。
在E133QM2SOD中,用Gln代替Glu133,可以导致Thr135发生轻微的移动,这个苏氨酸与谷氨酰胺可以产生强的氢键相互作用,这个轻微的改变可以打开活性区域的入口,因此,这个突变除了可以减少活性中心入口处的负电荷外,还可以增加入口的宽度。
总的来说,单体化导致环(Ⅳ)的无序性增加,这可以从α-螺旋的定向效应的改变以及静电环的重排反映出来。随之而来的,入口处的宽度减小,荷电残基形成氢键的模式发生改变。后者的特性促成蛋白质表面的静电势发生改变,这是超氧化物扩散进入活性位点的决定因素。因此,单体诱导结构改变,这个改变可以是空间结构的改变,也可以是活性区域静电势的改变。
3.3.1.4 Cu,Zn-SOD的催化机制
组氨酸是首先被发现与金属辅基Cu和Zn相连且与酶的催化活性直接相关的氨基酸残基。这主要来自三方面的实验证据:一是光敏氧化失活,二是化学修饰观察,三是辐射失活实验。
在有光敏染料亚甲蓝存在的条件下,去除Cu,Zn后的酶蛋白经光照后组氨酸残基遭到破坏,这时再加入Cu、Zn离子,酶活性不能修复。用组氨酸特异性试剂重氮1H-四唑(DHT)修饰发光细菌中提取的Fe-SOD,发现经DHT修饰后的酶完全失去活性,而且去Fe后的酶蛋白经修饰后再加入Fe就不能重组复活。对牛红细胞Cu,Zn-SOD的重组研究表明,去除Cu,Zn后的酶蛋白经较低剂量γ-射线照射后就丧失了再与Cu、Zn重组复活的能力。
其次是半胱氨酸和—SH基,Malinowski和Fridovich用对-氯汞苯磺酸修饰半胱氨酸—SH基后,发现牛红细胞Cu,Zn-SOD、麦胚Cu,Zn-SOD和猪血红细胞Cu,Zn-SOD并不丧失活性,对鸡肝Cu,Zn-SOD的修饰也得到同样的结果。顺丁烯二酰亚胺氮氧自由基旋标(Maleimido)可以特异性地与蛋白质分子中半胱氨酸的巯基结合,并根据巯基所处不同环境给出特征性的ESR波谱,对牛红细胞Cu,Zn-SOD的游离巯基进行自旋标记,只能给出弱固定化的ESR信号,表明该巯基并不是包埋在蛋白质分子疏水内部而是位于比较接近溶剂的表层中,标记后的酶仍然有酶活性,其紫外图谱也未发生大的变化,表明巯基与酶的活性无直接联系。
 的氧化速率的限制阶段是它在活性腔内的扩散,在腔内的扩散速率要比在水中高。
的氧化速率的限制阶段是它在活性腔内的扩散,在腔内的扩散速率要比在水中高。 靠近Cu2+,直到达到不发生化学键的生成就可以发生电子传递的距离。这种机制还不是很清楚。铜离子没有被水分子结合是很重要的,这样铜离子可以很容易地移动到
靠近Cu2+,直到达到不发生化学键的生成就可以发生电子传递的距离。这种机制还不是很清楚。铜离子没有被水分子结合是很重要的,这样铜离子可以很容易地移动到 ,这个几何结构使得靠近过程更容易发生。还原型的催化中心有着和氧化型的催化中心相同的带电区域,
,这个几何结构使得靠近过程更容易发生。还原型的催化中心有着和氧化型的催化中心相同的带电区域, 的扩散速率也是相同的。实际上的最初反应,包括氧化型和还原型的酶以及低浓度的
的扩散速率也是相同的。实际上的最初反应,包括氧化型和还原型的酶以及低浓度的 ,同时氧化型酶和还原型酶有着相同的反应速率。当
,同时氧化型酶和还原型酶有着相同的反应速率。当 靠近还原型的酶时,它和His63的N2的质子键合,一旦Cu(Ⅱ)形成,它和His63结合。质子从His63的N到
靠近还原型的酶时,它和His63的N2的质子键合,一旦Cu(Ⅱ)形成,它和His63结合。质子从His63的N到 之间传递,使得Cu(Ⅱ)和His63的N之间的键的重新形成产生了障碍。当
之间传递,使得Cu(Ⅱ)和His63的N之间的键的重新形成产生了障碍。当 处于高浓度时,限制阶段是质子的传递速率,这个已经用同位素标记法H/D对活性速率的影响所证明。一个完全的反应的所有阶段都包括质子梯度这样一个限制过程,和其他的扩散一样控制着反应过程。当
处于高浓度时,限制阶段是质子的传递速率,这个已经用同位素标记法H/D对活性速率的影响所证明。一个完全的反应的所有阶段都包括质子梯度这样一个限制过程,和其他的扩散一样控制着反应过程。当 靠近Cu(Ⅰ)时,碰到了His63的质子,然后发生电子传递过程。水分子中释放出一个质子,同时生成的Cu(Ⅱ)和H
靠近Cu(Ⅰ)时,碰到了His63的质子,然后发生电子传递过程。水分子中释放出一个质子,同时生成的Cu(Ⅱ)和H ,H2O2释放而不再与Cu(Ⅱ)结合,就像水分子一样,这在Cu,Zn-SOD的X射线结构中也可以观察到。
,H2O2释放而不再与Cu(Ⅱ)结合,就像水分子一样,这在Cu,Zn-SOD的X射线结构中也可以观察到。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















