免疫共沉淀技术依赖于一种抗体对含有饵蛋白的复合物的稳定而特异的结合。抗体在实验中与蛋白饵相互作用从而提供了一种将复合物固定到固体基质上的方法,杂蛋白可以被洗掉。饵复合物中的目标蛋白通过Western blot来鉴定。免疫共沉淀的过程概括如下(图9-7)。
细胞裂解物不仅包含诱饵/目标蛋白复合物,还含有很多杂蛋白(小三角形)。诱饵蛋白通过特异性的抗体锚定。抗体-诱饵-目标固定于偶联在琼脂糖珠子上的Protein-A上。然后将杂蛋白从珠子上洗掉,抗体、诱饵蛋白和目标蛋白通过煮沸而洗脱下来。
首先用编码了的饵蛋白、可能的配基及目标蛋白的质粒共转染细胞。将这些细胞用柔和的去垢剂处理,形成一个含有饵蛋白、目标蛋白和很多杂蛋白复合物的混合裂解产物。接着将一种能特异性识别饵蛋白的抗体加入到裂解物中,形成新的抗体-诱饵蛋白-目标蛋白复合物。然后通过抗体将蛋白固定到偶联了Protein-A的琼脂糖珠子上,Protein-A可以牢固地结合多种抗体的保守区域。随后,很多没有固定到珠子上的蛋白被洗掉。最终,通过在SDS中煮沸,诱饵-蛋白复合物从珠子上洗脱并解离下来,通过Western blot检测可以确认是否存在目标蛋白。转染细胞常用HEK293细胞,因为这种细胞易于培养并且转染效率高。如果需要也可使用其他合适的细胞系。
理想情况下,将看到所有转染样品中有等量诱饵蛋白而在其他样品中不存在诱饵蛋白,这决定于内源性水平以及抗体是否直接于诱饵蛋白或者标签直接作用。目标蛋白应该只出现在诱饵蛋白明显沉淀的样品中,而在未转染目标蛋白的样品中减弱或不存在。这个结果说明,在转染细胞里目标蛋白和诱饵蛋白可以相互作用。值得注意的是这并不意味着蛋白彼此直接结合,因为有很多其他蛋白参与到诱饵-目标蛋白的相互作用。在本书的其他章节中有很多体外技术可以解释这个问题。而且,这个实验数据还无法解释蛋白的体内相互作用,因为涉及细胞系的选择或蛋白过表达一些相关问题。在未转染的细胞或动物组织里做共定位实验(比如选择共聚焦显微镜)和免疫共沉淀是帮助解决这个重要问题的常规方法。
除了用转染的细胞,还可以用细胞系或组织表达的内源蛋白做免疫共沉淀。这样做的优势是避免了过表达对细胞内环境的改变,并且消除了外来的接头和标签序列。然而,这类免疫共沉淀实验将更加困难,因为需要细胞表达足够多的内源性目标蛋白才能满足高质量抗体的需要,并且实验中缺乏好的阴性对照。此外,如果蛋白相互作用可能被药物的刺激或细胞的培养条件影响,那么应该在免疫共沉淀实验中加以验证。
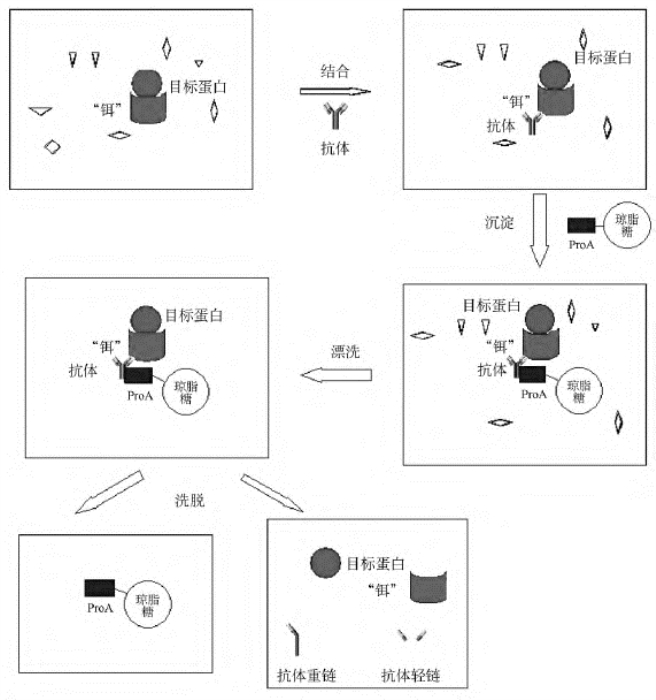
图9-7 免疫共沉淀
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















