三、荧光免疫显微技术
荧光免疫显微技术是以荧光显微镜为检测工具的荧光免疫抗体技术。
(一)基本原理
荧光免疫显微技术的基本原理是于待测标本切片上加入特异性荧光抗体,与组织或细胞表面的抗原进行反应,反应结束后洗涤去除游离的荧光抗体等杂质后,用荧光显微镜观察呈现特异性荧光的抗原抗体复合物及其部位。
(二)技术类型
根据标记物和反应程序的不同,临床上通常把荧光免疫显微技术分为以下几种类型:
1.直接法 直接将特异性荧光抗体滴加于待测标本片上,使之与抗原发生特异性结合。本法常用于细菌、病毒等病原体的快速检测以及肾脏、皮肤活检等病理检查。其特点是操作简便,特异性高,非特异性荧光少。但敏感度偏低,且每检查一种抗原需制备相应的特异荧光抗体(图6-14)。
2.间接法 间接法比直接法的敏感提高约5~10倍,制作一种荧光抗抗体即可检测多种抗原抗体系统,但易产生非特异性荧光。
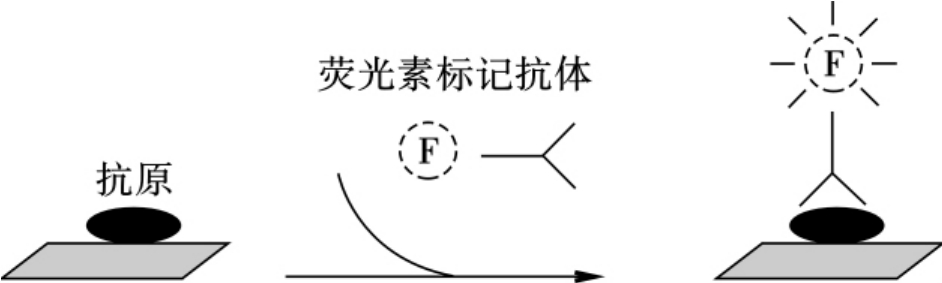
图6-14 荧光直接法原理示意
【原理】
将特异性抗原固相化,加入待测标本,标本中第一抗体(抗体)与抗原结合,洗涤后加入荧光素标记的第二抗体(抗抗体)与抗原抗体复合物中的第一抗体结合,洗涤后用荧光显微镜观察特异性荧光(图6-15),以检测未知的抗体。
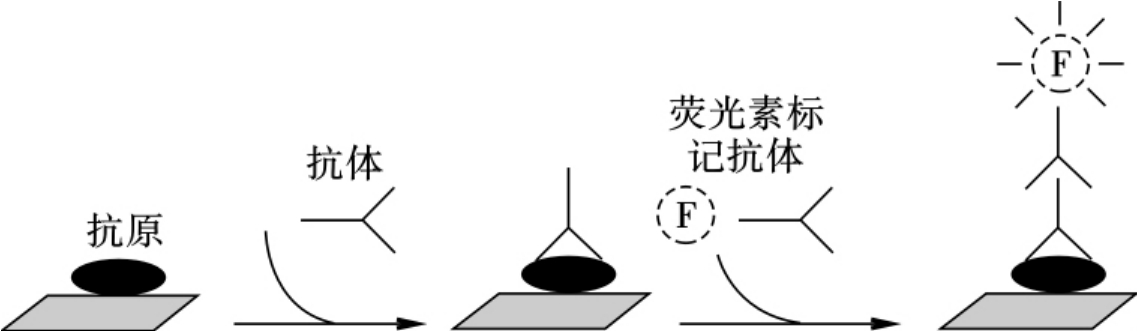
图6-15 荧光间接法原理示意
【试剂与器材】
(1)0.01 mol/L磷酸盐缓冲液(pH 7.4);抗原片;待测血清、阴、阳对照血清;羊抗-人IgG荧光二抗、缓冲甘油(甘油与磷酸盐缓冲液以9∶1混合)。
(2)荧光显微镜及其他用品。
【操作方法】
(1)将缓冲液滴加于抗原片,10 min后弃去。
(2)将用缓冲液稀释的对照血清和待测血清加入抗原标本相应位置,37℃,30 min。
(3)用缓冲液冲洗,吸干多余水分。
(4)加入稀释的羊抗人IgG荧光二抗,37℃,30 min。
(5)用缓冲液冲洗,冷风吹干。
(6)滴加缓冲甘油封片,用荧光显微镜检查。
【结果判断】
荧光强度用“+”号表示。
“+++”为强荧光;“++”为荧光明亮;“+”为荧光较弱,但清楚可见;“-”为无或仅见极微弱荧光。阴性对照应呈“-”或“±”。临床上以特异性荧光强度达“++”以上判定为阳性;根据“++”的血清最高稀释倍数判定特异性抗体效价。
血清稀释度<1∶80为弱阳性;1∶80~1∶320为中等阳性;>1∶320为强阳性。
【注意事项】
(1)染色后一般于1 h内完成观察,或于4℃保存4 h,否则荧光减弱。
(2)操作过程中标本片需保持湿润,避免干燥。
(3)滴加试剂应完全覆盖标本片。
【临床应用】
临床上荧光免疫显微技术常用于细菌、病毒和寄生虫等病原生物及自身免疫病的诊断,具有速度快、操作简单、敏感性高等特点。
3.双标记法 用两种不同的荧光素(如FITC及罗丹明RB200)分别标记不同的特异性抗体,对同一标本进行荧光染色。在有两种抗原存在时,显微镜下可同时观察到两种颜色的荧光(如橙红和黄绿)(图6-16)。该方法常用于同时对两种不同抗原的检测,如同一血片中T、B淋巴细胞的检测等。
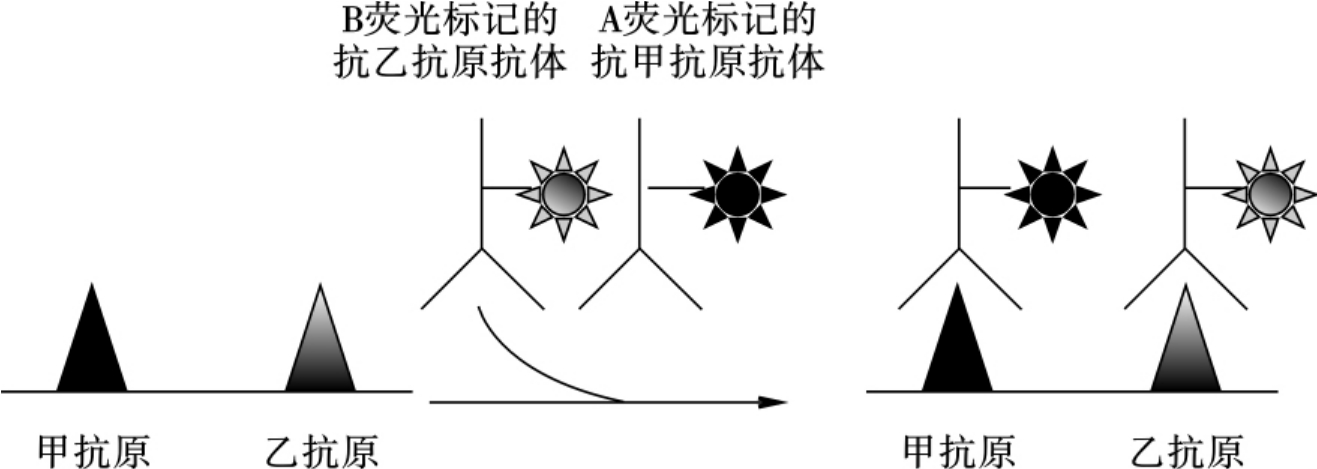
图6-16 荧光双标记法原理示意
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。


















