急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是严重战、创伤后发生率最高的内脏并发症,是发生多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)的始动环节。该征是1967年由Ashbaugh提出,当时称之为成人呼吸窘迫综合征(adult respiratory distress syndrome,ARDS)。到1971才出现急性呼吸窘迫综合征(acute respiratory distress syndrome)的说法。目前已用“急性”(acute)代替“成人”(adult)两字。
ARDS是急性肺损伤(acute lung injury,ALI)的终结(endpoint)。所有的ARDS患者开始都有急性肺损伤过程,但是,并非所有的ALI患者都会发展为ARDS。虽然它们都会出现一个共同的炎症反应和通透性增加过程,但病因各异,其预后会大不相同。
多种因素可导致ARDS的发生。常见的原因列于表41-1。战、创伤后常见的原因是全身性感染[包括脓毒症(sepsis)、多发伤、严重休克、严重烧伤(包括吸入伤)]等。
表41-1 发生ARDS的常见原因

【发生率和病死率】 美国每年的ARDS发生率为2~8/10万。脓毒症伴ARDS的发病率为25%~37%;严重多发伤为25%~44%;重症胰腺炎为40%左右,过量输液和胃内容物吸入等都是高危因素,有极高的ARDS发病率。
ALI和ARDS是一组兼有临床表现、胸部X线变化和生理异常的肺部急性炎症反应和肺毛细血管通透性增加的综合征,早期表现为ALI征兆,处理不当可发展为ARDS。表41-2列出了目前公认的ALI和ARDS的标准,但此标准是综合征的静态表现,并不是一成不变的。
表41-2 ALl和ARDS的标准
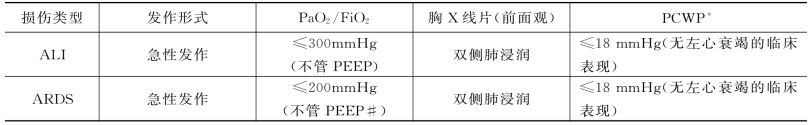
注:*PCWP为肺毛细血管楔压;#PEEP为呼气末正压
ARDS的病死率变化很大,与其发生原因有密切关系(表41-3)。
有资料显示,血浆THF-α、IL-1、IL-6和IL-8水平早期而持久地升高通常是患者预后不良的信号。
【发病机制】 不管何种病因诱发的ARDS,其共同的病理基础是:肺毛细血管内皮细胞损伤导致毛细血管通透性增加、肺泡和间质水肿、透明膜形成和血气屏障受累,从而影响肺换气功能;肺泡Ⅱ型上皮细胞受损,肺表面活性物质减少、活性降低,肺泡扩张受限和萎陷,造成通气障碍。最终导致通气、灌流比例失衡、肺分流量增加和进行性低氧血症。ARDS的发生与下列因素有关。
1.缺血再灌流损伤 严重战、创伤常合并大量出血和严重休克,表现为血容量减少、心排血量下降和氧输送量(DO2)减少。若DO2减少未能及时改善,机体会通过代偿功能,以维持最低的组织氧耗量(VO2)。DO2进行性下降,无法代偿时,细胞即处于长期缺血、缺氧状态。
组织灌流的恢复过程,也是氧自由基大量生成和释放的过程。自由基对内皮细胞(EC)的损害是发生ARDS的重要机制之一,其主要作用方式是通过中性白细胞(PMH)的聚集及其与EC的黏附。
2.感染与内毒素损伤 腹腔严重感染后,可见肺组织中内毒素含量增加,这是内毒素通过肠黏膜屏障向全身各脏器移位(translocation)的结果。内毒素可刺激单核/巨噬细胞、EC、PMH合成和释放一些炎症介质(THF-β、IL-1)及蛋白酶类物质,造成多种组织和细胞损伤;还可增强血小板凝集、启动凝血和纤溶系统,触发DIC。
3.炎症失控性损伤 是机体受严重战、创伤和感染后产生的过激炎症反应又无法自控,而导致的自身细胞被损现象。巨噬细胞被启动后,导致前炎性细胞因子(THF-α、IL-1、IL-6和IL-8)的失控性释放。这些因子和介质又导致继发的介质(花生四烯酸代谢产物、组胺、缓激肽和一氧化氮等)释放。它们启动肺血管EC,并活化PMH表面的跨膜蛋白和整合素(integrin);活化位于PMH和EC的选择素(selectin)效应蛋白和免疫球蛋白超家族成员,包括细胞间黏附分子-1(ICAM-1)和ICAM-2。上述蛋白与PMH和EC相互作用,发生黏附连锁反应是导致PMH在肺微血管内聚集和损伤内皮的重要机制之一。
炎症失控所致的ARDS也与机体对内源性抑制物(IL-4、IL-10、IL-13和TGF-β等生成不足有关。当致炎因子和抗炎因子的生成失衡时,即可出现以全身炎症反应为特征的机体反应。促炎反应占优势时表现为免疫亢进或全身炎症反应综合征(SIRS);抗炎反应占优势时表现为免疫麻痹或代偿性抗炎症反应综合征(CARS),使机体对外来打击反应低下,且更易感染。
4.肺表面活性物质(PS)减少 PS是肺泡Ⅱ型上皮细胞合成分泌的脂质-蛋白质复合物,其中80%为磷脂。磷脂具有降低肺泡表面张力、保持呼气末肺泡的扩张、防止肺水肿和调节肺内炎症反应等功能。研究表明,继发性PS减少是导致ALI和ARDS的重要发病机制之一。
【诊断标准】
1.平原ARDS的诊断标准 国内外诊断标准基本上是一致的。国内曾经过5次全国性大型专题研讨会,制定了如下诊断标准:
表41-3 相关疾病ARDS病死率

(1)有ARDS的原发病或诱因:如脓毒症、多发伤、胃内容物误吸、肺挫伤、重症肺炎等高危因素。
(2)急性起病、呼吸困难和(或)呼吸窘迫。
(3)低氧血症:氧合指数(PaO2/FiO2)在ALI时<300mm Hg;ARDS时<200mm Hg(不管呼气末正压水平的高低),但FiO2最好在呼吸机密闭循环路中测定。
(4)X线胸片有两肺浸润阴影。
(5)肺毛细血管楔压(PCWP)<18 mm Hg。
2.高原ARDS的诊断标准 高原地区因空气氧浓度低于平原,当地居民的正常血氧分压也较平原居民为低。1999年兰州专题研讨会上对高原地区ARDS诊断标准制定了试行草案。其诊断标准为:
(1)有上述高危致病因素,急性起病。
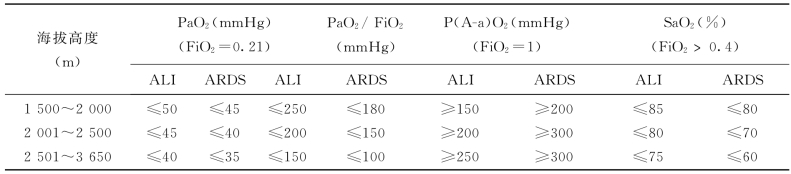
(2)严重低氧血症,PaO2/FiO2在ALI≤250 mm Hg、ARDS时≤150 mm Hg。海拔高度不同,PaO2/FiO2的标准也异,表41-4列出了4项血气参数,可作诊断时参考。
(3)胸片有两肺浸润阴影。
(4)PCWP<18 mm Hg,或临床可排除心源性肺水肿。
除符合以上诊断标准外,以下中有任何两项者可作为诊断的重要依据:①呼吸次数≥35/mim、呼吸窘迫、发绀;②有明显肺水肿征兆,可听到干、湿啰音,咳大量泡沫状黏痰;③吸氧条件下SaO2≤85%。
表41-4 不同海拔高度ALl或ARDS血气诊断标准
【治疗】 ARDS的治疗原则是:在治疗严重原发病和消除高危因素的同时,立刻实施消除缺氧的对症治疗。对有严重出血和休克的战、创伤伤员,在积极抗休克的同时,要妥善处理好各部位战、创伤,特别是多发伤。对有可能造成肺损伤的连枷胸、各类血、气胸和长骨干骨折等更应及时固定和处理。消除缺氧的对症治疗大致有以下几个方面:
1.限制液体
(1)限制液体、利尿,特定条件下的血滤是降低患者毛细血管静水压和保证患者肺“干”的基本治疗方法。
(2)一定要把液体限制在患者的血流动力能耐受的程度,其目的是在最低PCWP的情况下实现有效的心排血量;要避免低血容量和大剂量去甲肾上腺素的治疗方法。
(3)10%羟乙基淀粉(hydroxyethyl starch,HES):HES是一种可以推荐的容量替代溶液,分子量为200 000,比电解质和白蛋白大,可提高胶体渗透压。
2.动力学治疗
(1)推荐用俯卧位于ARDS患者的治疗,此体位有以下优点:消除了背侧肺的通气灌流异常;有利于通气良好区域的重分配,使水肿液能较好地重吸收;通过增加肺容量和新肺区的补充,放大了PEEP的作用;支气管分泌物可得到充分地引流。
(2)俯卧位可以一直用到患者的氧分压值比仰卧位高为止,其应答率为50%~80%。通常在使用后12h即可见到阳性效果。如果医院配备有自动翻身床更有利于体位疗法的推广。
3.呼吸治疗 呼吸治疗的目的是使肺泡复张,以恢复其正常的气体交换功能。ARDS时,常呈现低血氧和高二氧化碳血症,传统上均以达到正常的血气值为目标。为此,往往设定相当大的潮气量和增加呼吸流速及较高的呼气末正压。由此常导致患者的气道高压,极易加重肺部损伤。
过度的加压通气除常可发生一些气漏(如气胸、纵隔积气、皮下气肿和全身气栓)外,也会增加血管通透性,使肺部微血管内皮细胞、上皮细胞和基膜受损,随之引起体液、蛋白质和血液的渗漏,最后激发连锁的炎症反应。
保护性通气是目前机械通气的新策略,包括下述几个方面,其目的是使肺泡在一定程度上得以重新复张,以改善机体的氧合能力。
(1)低潮气量:可降低通气和非通气肺泡间的剪切力,对肺泡有保护作用。推荐用潮气量为6~8ml/kg体重。
(2)压力控制通气:通过限制压力和降低气流速度,以限制其容量,因为肺泡复张有赖于降低压力,由此,也避免了因通气增强而造成的容量损伤。
(3)呼气末正压(positive end expiratory pressure,PEEP):其应用原则是:以最小的压力和氧浓度,达到最大的改善肺顺应性、氧转运和肺分流为目的。吸入氧浓度(FiO2)一般控制在0.4~0.5之间。呼气末正压一般从5cm H2O开始,必要时可适当增加至10 cm H2O,过高的压力易致气压伤,加重心肺功能紊乱;过高的压力使回心血量减少并可增加颅内压;疑有肺冲击伤时更要注意防止气压伤。对胸片表现为肺弥漫性浸润的患者宜用较高的PEEP,而对仅有肺局部浸润者,可用俯卧位通气及中等压力的PEEP。压力宜渐升缓降,加强湿化和气道管理。
(4)反比通气法(inverse ratio ventilation):传统的呼吸辅助常使用高通气量,吸呼比<1。但高通气量会造成许多并发症。如何才能不造成高气道压又改善了氧合,提出了反比通气法。持续的气道压力比短暂性气道压力对肺部的支持效果好,持续的肺泡充气可减少死腔空间。因此,理论上将吸气时间延长后,使用较低的呼气末正压便可维持相当的潮气容积及平均气道压,进而改善氧合状况。反比通气法有两类:
①压力控制型:可准确控制压力,但因属压力设定的通气模式,故潮气容积不易控制,必须仔细监测每分钟通气量。
②容积控制型:一般呼吸机均可应用,是一种设定容积的通气模式,通过减慢吸气流速、设定吸气末暂停以达到延长吸气为目的。可使用固定式或渐进倾斜式流量模式。
(5)允许高二氧化碳血症(permissive hypercapnia):是为了避免肺部过度通气造成局部或全肺过度膨胀,因而给患者较以往为少的通气量,导致动脉血中CO2分压上升。有人提出允许值为50~100mm Hg,一般不要超过70mm Hg。
(6)其他呼吸治疗方式
①高频通气法(high frequency ventilation):是一种低潮气量、高呼吸率通气。与传统呼吸机相比,无明显优点。
②液体和部分液体通气法(liquid or partial liquid ventilation):用惰性全氟碳溶液部分灌注气道,以降低表面张力,并结合常规机械通气。因氟碳有较高的携氧能力,可改善气体交换及降低呼吸机相关肺损伤。对新生儿初次推荐剂量为15±4ml/kg体重,在其后的24~72h,给予(3.3±0.9)ml/kg体重。
③双相(吸、呼两相)气道正压通气(biphasic positive airway pressure,BiPAP):用BiPAP呼吸机(德国Drager型)治疗。用BiPAP后患者气道分泌物少,意识清楚,人机配合好,无需插管和切开。另外,这种无创正压通气能迅速纠正缺氧,改善呼吸机疲劳。
④体外膜式氧合术(extra-corporeal membrane oxygenation,ECMO):将血液引出体外,行气体交换。ECMO不仅可改善氧合,而且可减少肺损伤。两项德国的临床前瞻性研究显示,与常规治疗相比ECMO能降低病死率。至于用何种方式进入ECMO治疗,见表41-5。
表41-5 快速进入和缓慢进入ECMO的标准

至今尚未见ECMO和常规治疗的随机控制研究报道。因此,它只是作为一种常规治疗ARDS无效时的补充。
4.药物治疗 除对ARDS的上述治疗外,目前有通过抑制炎性反应、刺激表面活性物质生成和降低肺表面张力、扩张肺血管、降低肺动脉压等措施,以改善氧合和肺顺应性:
(1)H乙酰半胱胺酸(痰易净):是一种抗氧化剂和谷胱甘肽合成的前体。可抑制前炎性细胞因子的生成。推荐剂量为150mg/kg体重。
(2)氨溴索(ambroxsol):也是一种抗氧化剂,可刺激表面活性物质生成。对术后和误吸所致肺不张有一定作用。推荐剂量30mg/(kg·d),持续静脉滴注,5~6d后减量。
(3)类固醇(steroids):类固醇治疗不能降低脓毒症的死亡率。早期大剂量的甲泼尼龙对脓毒症相关ARDS的结局无任何改善。因此,该药不是ARDS早期渗出阶段应用的适应证。脂肪栓子导致的ARDS,在晚期增生阶段可考虑应用。
(4)前列腺素E1:该药能改善动脉氧分压、肺顺应性和缩短机械通气时间。
(5)酮康唑(ketoconazole):是一种血栓素合酶抑制剂,预防性研究表明,该药有减少ARDS病死率的趋向。
(6)阿米三嗪(almitrine):阿米三嗪复合一氧化氮(1~10ppm)吸入的治疗作用,优于单独应用阿米三嗪者。
5.表面活性物质灌注 表面活性物质对某些患者可能有效,如用以治疗难治性肺叶或肺段不张。推荐剂量(局部支气管镜灌注):第1天为300mg/kg体重;第2天重复使用,剂量为150~300 mg/kg体重。治疗期间避免做气管和支气管吸引或中断密闭的通气系统。
6.一氧化氮(HO)和依前列醇吸入 HO吸入可选择性扩张肺内血管,随之出现肺动脉压下降和氧合增加(由于肺内分流降低)。HO吸入的推荐剂量为低于10ppm。初期对HO吸入在改善氧合的高期望,随着临床和发表的研究结果来看,似乎失望了。它并没有对患者存活率和呼吸机停用率有任何影响。还疑有吸入后增加病死率和透析率。只有当严重ARDS用各种治疗无效时,才可能是HO吸入的适应证。
虽然雾化吸入依前列醇可潜在性扩张肺内血管,但尚未见系统的临床对照试验报告。
7.高原ARDS的处理 有高压氧舱的单位,立即将患者送至高压氧舱内或下送至海拔高度较低的地域。采用多巴胺加多巴酚丁胺和酚妥拉明加硝酸甘油分别联合静滴以改善心功能和微循环;或用丹参和右旋糖酐-40注射液、川芎嗪和红景天以改善微循环、增加血流量,并减少血小板聚集、全血比黏度和血栓形成。上述的平原治疗措施同样适用于高原ARDS的处理。
中国危重病急救医学2006年12月公布了“中华医学会重症医学分会”提出的“急性肺损伤/急性呼吸窘迫综合征诊断治疗指南”,其内容翔实,全面,以循证医学证据为基础,采用国际通用方法,经反复讨论,达成共识,其详细内容附于本章后。
(朱佩芳)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















