神经母细胞瘤是起源于交感神经节和肾上腺髓质的胚胎性恶性肿瘤。可发生于有交感神经系统的任何部位,如脑、颈部、纵隔、主动脉旁、盆腔和肾上腺髓质。是婴儿期中常见的恶性肿瘤,仅次于中枢性肿瘤。占儿童肿瘤的8%~10%,约40%的病例在1岁前诊断,60%在2岁时诊断。诊断的平均年龄是17个月。流行病学发病率估计为1/10 000~1/8 000活产儿。
一、病 因
目前尚不明确。环境因素包括污染等与儿童肿瘤的发生有一定的关系,染色体短臂缺失或再排列,家族性神经母细胞瘤亦有报道,2007年有报道在有家族史的病例中发现有anaplastic lymphoma kinase(ALK)基因突变。患者也偶尔并发神经嵴细胞发育异常的疾病如先天性巨结肠、中枢性肺换气不足综合征等。早有报道发现妊娠17~20周流产胎儿的肾上腺组织中几乎100%存在肾上腺神经母细胞结节。而其他死于与神经母细胞瘤无关疾病的新生儿肾上腺组织中亦可见到神经母细胞形成的原位神经母细胞瘤。另有报道这些小结节在生后3个月内99%可自行消退。这一现象表明原位神经母细胞瘤可以发生分化或退化而不进展为临床神经母细胞瘤病例。而某些发展成临床肿瘤的病例可能与缺乏退化的因素或异常存留有关。
二、病 理
大体检查:早期肿瘤形状尚规则,有极薄的包膜。随着肿瘤增大形成多个结节状,质硬,与周围组织无明显分界。切面呈鱼肉状,质脆、有出血和坏死区。易破裂(图17-3,图17-4)。镜下:肿瘤细胞为小圆兰细胞,染色质丰富,胞质少,核染色深,核仁不清。肿瘤细胞和原纤维突排列成菊花样,被认为是本病的典型病理特征(图17-5)。肿瘤继发性出血,坏死和钙沉积较多。有分化较好的组织类型如神经节母细胞瘤和神经节细胞瘤。通过有价值的免疫组化技术如波纹蛋白(VIM)白细胞共同抗原(LCA)神经特异性烯醇化酶(NSE)和S-100,及电镜技术区分其他以小圆细胞为特征的恶性肿瘤如:尤因瘤、非霍奇金淋巴瘤,横纹肌肉瘤,原始神经外胚叶瘤。

图17-3 出生后23d患者盆腔神经母细胞瘤大体标本
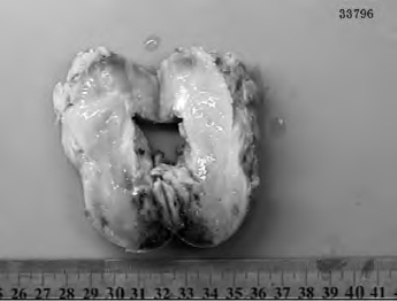
图17-4 23d患者盆腔神经母细胞瘤大体标本切面

图17-5 病理切片(高倍镜下)
三、分子生物学特点
1.染色体 等位染色体异位和缺失,1号染色体杂合性缺失,短臂缺失和异位。染色体Ip36缺失与MYCN原癌基因扩增明显相关。
2.DNA指数(倍性) 可由流式细胞仪测定,反映化疗效果及预后。DI>1(高倍体表型)预后良好。DI=1(二倍体)预后不良。
3.癌基因表达 MYCN原癌基因扩增可激活肿瘤血管形成,肿瘤播散和PGYI启动子,亦可能与凋亡有关。早期和IVs的神经母细胞瘤患者仅5%~10%有MYCN扩增,而进展期则高达40%,扩增与诊断时年龄分期无关,扩增与否在肿瘤的病程中一般不会改变。有MYCN扩增的患儿表示预后不良。
四、临床表现
在任何有交感神经组织的部位均可发生,由于肿瘤所在部位、转移及血管活性肠肽等活性物质释放等不同,临床表现亦多样化。
来自肾上腺最多占50%,脊柱旁24%,骨盆3%,纵隔20%,颈部3%。因此最常见的症状是腹部巨大肿块,在新生儿和小婴儿常有肝增大,皮下结节。来自后纵隔和椎旁的肿瘤可压迫气管引起呼吸困难、哮喘。肿瘤侵入椎间孔压迫神经可出现步态不稳、肌无力、瘫痪。盆腔肿物可压迫直肠膀胱和血管,致便祕尿潴留等。颈部常有局部肿块、淋巴结肿大、霍纳综合征。眼眶周水肿,眼睑下垂,突眼、“熊猫眼”,眼球震颤、斜视等。5%~10%有腹泻、低钾等血管肠肽综合征。还可出现由于儿茶酚胺分泌增多或肿瘤压迫肾血管所致的高血压。
胎儿期的先天性神经母细胞瘤可分泌多量的儿茶酚胺,可引起母体过敏、出汗、呕吐、潮红、头痛和虚弱。广泛弥漫性神经母细胞瘤可引起先兆子痫、胎儿窘迫、水肿、死胎等。
五、诊 断
(一)实验室检查
1.尿液中儿茶酚胺代谢产物:香草扁桃酸(VMA)和高香草酸(HVA)约90%的病例表现增高。作为肿瘤的标记物用于诊断和随访。
2.血清乳酸脱氢酶(LDH)增高,与肿瘤活动有关,如果有MYCN基因扩增,常常高于正常3倍,提示预后不良。
3.血清铁蛋白及神经稀醇化酶(NSE)升高。
4.骨髓穿刺活检可见呈菊花团状排列转移的肿瘤细胞,免疫细胞学检测更敏感,需在双侧髂嵴处做骨髓活检,便于肿瘤分期和预后。
(二)肿瘤病理活检
有细针穿刺法及开放活检。前者可在B超和CT引导下進行,但有时获取组织量偏少。开放活检可用微创技术或小切口,切取组织不少于1cm3,对获取的标本进行组织病理分期、分型。MYCN基因有无扩增;DNA染色体的数量,正常时差,大于或小于46时较好;染色体改变如1p36和11q23缺失。前者常在年龄>1岁,有MYNC扩增组织分化差的病例中出现。后者在无MYNC扩增病例中出现,分期晚组织分型差。二者均提示预后差。
(三)影像学检查
1.B超 常作为新生儿首选检查,表现为混合同声实性肿块,新生儿亦可呈囊性。B超下可以定位並准确测量肿瘤大小。胎儿神经母细胞瘤通常在妊娠后期(平均33周)近90%位于肾上腺,约2/3的肾上腺肿瘤又在右侧。超声下有3种基本形态:①实性等回声肿块,大小一般2~4cm;②完全囊性或囊实性混合结构;③混合性肿块体积较大,最大直径3~10cm。
囊性者必须和肾上腺出血相鉴别。肾上腺出血发生在分娩和新生儿早期,右侧比左侧多3~4倍,初期超声图像为囊性,以后回声逐渐增强,有时可见钙化。
2.MIBG(间碘苄胍)扫描 由于85%的神经母细胞瘤摄取MIBG,故用123I标记的MIBG扫描对原发或转移的神经母细胞瘤是非常特异性和敏感的检查方法。可显示骨和骨髓的转移。注意唾液腺亦可摄取MIBG,因此颈部神经母细胞瘤扫描时应注意鉴别。
3.CT和磁共振(MRI)检查 CT意义最大,可清楚显示原发肿瘤的大小、部位、转移、局部淋巴结有无肿大,血管受累情况肝有无转移等。MRI可清楚显示哑铃状肿瘤与椎管的关系(图17-6)。4.骨扫描 可了解骨皮质转移的情况和部位。当MIBG扫描阴性时要加做此检查。

图17-6 年龄为2周的左肾上腺神经母细胞瘤CT片
六、分 期
肿瘤的分期关系到治疗方案的制定和预后,因而一个完善又周全的分期系统非常重要。目前在世界广泛应用的是国际神经母细胞瘤分期系统(INSS)和Shimada的组织病理学分型。INSS分期如下。
Ⅰ期:肿瘤局限于原发区域;肉眼完整切除,有或无显微镜下残留病变,同侧和对侧淋巴结镜下阴性。
ⅡA期:单侧肿瘤肉眼未完整切除;显微镜下同侧和对侧淋巴结阳性。
ⅡB期:单侧肿瘤肉眼完整或未完整切除;同例区域性淋巴结阳性;对侧淋巴结阴性。
Ⅲ期:肿瘤浸润超越中线,区域性淋巴结被或未被累及;或单肿瘤对侧淋巴结被累及;或中线肿瘤双侧被侵犯,或双侧区域性淋巴结被累及。
Ⅳ期:肿瘤扩散到远处淋巴结、骨、骨髓、肝和(或)其他器官。
Ⅳs期:局限性原发肿瘤,如同1期或2期有限于肝、皮肤和(或)骨髓的扩散。
婴儿年龄<1岁。
Shimada提出根据肿瘤间质成分的多少,结合其他指标进行病理学组织分型。神经母细胞分为基质丰富和基质少两种。基质丰富的肿瘤细胞包含似施万细胞的梭形细胞。出现在节细胞神经母细胞瘤中,是一种满意型病理。基质少的肿瘤又被诊断时的年龄、神经母细胞的分化、有丝分裂-核分裂指数(Mitosis-Karryohexis index,MKI)3种变量分为满意型和不满意型(表17-5)。
表17-5 Shimada病理分型

多年来以上两种分期分型法仍是最常用的,亦是确定治疗方案和判断预后的依据。但经过大量临床病例的实践,发现仍有一些不足之处,如INSS是根据手术的结果来分期,Shimada亦是需要活检或术后获取的病理组织来分型。而手术的结果又与手术医生技术熟练程度有关。在影像学技术日益发展完善的情况下,国际神经母细胞瘤协作组(International Neuroblastoma Risk Group,INRG)釆取影像学显示的高危因素(Image-Defined Risk Factors in Neuroblastic Tumors,IDRFs,表17-6)来分期。在此基础上INRG于2008年又提出新的分期。INRGSS(INRG Staging System).共分为L1,L2,M,Ms 4期(表17-7)。按此分期一定要做CT MRI MIBG检查,骨扫描可不常规做,只有MIBG阴性时才加做。若骨扫描有一处阳性时,则需做活检或做正电子发射体层技术(PET)来证实。
表17-6 影像学评估神经母细胞瘤的危险因素

表17-7 国际神经母细胞瘤危险组分期系统

七、影响预后的因素
影响神经母细胞瘤预后的主要因素为患儿年龄和诊断时的分期。年龄越小肿瘤的生物学特性偏良性,预后越好,用18月龄作为年龄分界线,<18月龄预后好,局部肿瘤常常可以治愈,且有时不需化疗。虽然婴儿的效果好,但若属Ⅲ期、Ⅳ期加上MYCN扩增则预后差,同于大龄儿童。
儿童癌症协作组(COG3881)发现有MYCN扩增婴儿无瘤存活率<10%,无MYCN扩增者存活率>93%。INGS分析了8 800多病例,以5年无瘤生存率作为标准,根据13种因素(年龄、MYNC基因、染色体、病理组织分型等)。将其分为四大群16组:非常低(A,B,C组);低危(D,E,F组);中危(G,H,I,J组);高危(K,N,O,P,Q,R组)。其5年无瘤生存率分别为非常低组85%;低危组75%~85%;中危组50~75%;高危组<50%。此分类法较全面,可以将全世界的病例,进行统一分析,以便将来提出新的治疗方案(表17-8)。
表17-8 神经母细胞瘤分期

注:GN为节细胞瘤;GNB为节细胞神经母细胞瘤;NB为神经母细胞瘤
八、治 疗
治疗方案要根据病人的年龄、分期、部位、生物学特性来制定,目前习惯上仍依据NISS分期法。共分为低危组、中危组、高危组和4s组(表17-9)。治疗的方法有化疗、手术、放疗及免疫治疗等。
表17-9 神经母细胞瘤治疗方案

1.低危组 肿瘤局限,包膜完整,与周围组织无浸润,手术完整切除。治愈率可达98%以上。术后不必做化疗。
2.中危组 手术加中度化疗(四药联合化疗)。化疗和手术的先后则视影像上显示肿瘤的具体情况而定。一般化疗4个疗程后再评估手术切除的可能性,化疗后肿瘤体积缩小,估计肉眼下完全切除的可能,则安排手术。若条件不够再化疗4个疗程。手术要求大切口,充分暴露肿瘤与周围组织的关系,尤其是当大血管被肿瘤包绕时,要将肿瘤剖开,小心将肿瘤逐块切除。
3.高危组 先强度化疗5个疗程后再考虑手术。术后继续化疗2~4个疗程。无论手术是否达到肉眼完全切除,均要求在骨髓灭活后接受自体骨髓移植(甚至可2次骨髓移植)和造血干细胞移植。转移灶和瘤床加做放疗。同时要给予维A酸以期待诱导分化肿瘤细胞等。此期存活率只有40%~50%。
4.4s期 发生在新生儿期的神经母细胞瘤大多属于4s期。大部分4s期病例不需化疗,给予支持疗法和观察,期待自然退化。存活率可>90%.但其中有MYCN扩增者仍需高强度化疗,仅有组织学不良型,或二倍体DNA指数,则行中度的化疗。
总之,对小婴儿患者,大部分是低危组病例,单纯手术切除已足够。这类患者肿瘤的自然消退率也较高,因此,近10年来对低危和中危者的趋势是不治疗或减少治疗,对高危者加强化疗和近来的免疫治疗。
(李桂生 孙炜丽)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















