Ⅱ 三草酸合铁(Ⅲ)酸钾配离子组成的测定
实验步骤
1.试液的配制
准确称取K3[Fe(C2O4)3]·3H2O 1.0~1.2g(称准至四位有效数字)于烧杯中,加水溶解,定量转移到250mL容量瓶中,稀释至刻度,摇匀。
2.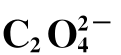 的测定
的测定
准确吸取试液25mL于250mL锥形瓶中,加入3mol·L-1 H2SO4溶液10mL,0.2%二苯胺磺酸钠指示剂2~3滴,混匀,用K2Cr2O7标准溶液(按计算量配制)滴定至溶液呈紫红色并保持30s内不褪色,即达终点。由消耗的K2Cr2O7的体积V1,计算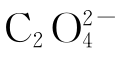 的质量分数。
的质量分数。
3.Fe3+的测定
准确吸取试液25mL于250mL锥形瓶中,加入6mol·L-1 HCl溶液10mL,加热至75~80℃,逐滴加入15%SnCl2溶液至溶液呈浅黄色,使大部分Fe3+还原为Fe2+,加入2.5%Na2WO4溶液1mL,滴加6%TiCl3溶液至溶液呈蓝色,并过量1滴,加入0.4%CuSO4溶液2滴,去离子水20mL,在冷水中冷却并振荡至蓝色褪尽。加入H2SO4-H3PO4混酸15mL,0.2%二苯胺磺酸钠指示剂5滴,然后用K2Cr2O7标准溶液(按计算量配制)滴定至溶液呈紫红色,并保持30s不褪色,即达终点。记下消耗的K2Cr2O7标准溶液的体积V2,用差减法计算Fe3+的质量分数。
注意事项
在Fe3+的测定中,为了加速Fe3+的还原,应趁热滴加还原剂SnCl2与TiCl3(75~80℃)。SnCl2加入必须适量,滴加至溶液呈浅黄色。由于Fe3+和Sn2+反应速率较慢,若滴至浅黄色,经摇动后有可能会变成无色。说明此时SnCl2已过量,会导致分析结果偏高。若SnCl2滴入过量,可滴加KMnO4至溶液呈浅黄色(KMnO4不计量),再按实验步骤进行。
思考题
(1)试分析实验误差产生的原因。
(2)Fe3+的测定中,还原样品中的Fe3+要用SnCl2、TiCl3两个还原剂。试讨论若只用其中一种还原剂还原Fe3+时,将对分析结果产生的影响。
(3)H2SO4-H3PO4混酸的目的是什么?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















