配合物是由配离子和带相反电荷的其他离子所结合成的化合物。在配离子中含有金属离子,在金属离子周围结合着若干个中性分子或阴离子。图2-4是配合物硫酸四氨合铜(Ⅱ)的组成,其中(a)是结构示意图,(b)是组成说明。
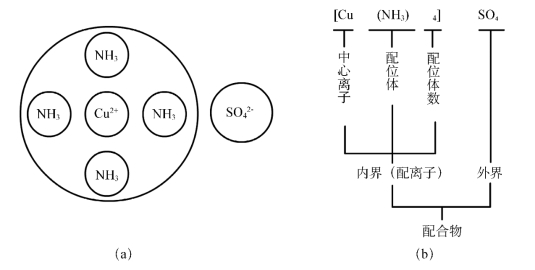
图2-4 配合物的构成
(一)中心离子
配离子中的金属阳离子位于配合物的中心,是配合物的形成体,称为中心离子。过渡元素的金属离子是常见的中心离子,如Ag+、Cu2+、Zn2+、Hg2+、Fe3+、Fe2+等。
(二)配位体
与中心离子直接相结合在其周围的中性分子或阴离子,称为配位体。配位体必须有孤电子对,其孤电子对与中心离子共用,形成配位键。即配离子中的中心离子与配位体是以配位键相结合的,由于中心离子与配位体相距较近,结合紧密,常称为配合物的内界,书写配离子的化学式用方括弧表示。常见的配位体有NH3、H2O、F-、Cl-、CN-、SCN-等。配位体中与中心离子直接结合提供孤电子对的原子称为配位原子,常见的配位原子有O、N、S、F、Cl、Br等。
(三)配位数
配位原子与中心离子形成的配位键的总数,称为中心离子的配位数。如:[Cu(NH3)4]SO4中,中心离子Cu2+的配位数为4;[Fe(CN)6]3-中,中心离子Fe3+的配位数是6。一些常见的中心离子配位数见表2-6。
表2-6 一些常见金属离子的配位数

(四)外界离子
配合物中距离中心离子较远的离子,与配离子以离子键相结合,它构成配合物的外界,称为外界离子。
常见配合物的分子组成见表2-7。
表2-7 几种常见配合物的分子组成

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















