甘肃省河西高钙土溶磷菌筛选及其溶磷能力初步研究
李娟1 王文丽1 卢秉林1 郭天文2
(1甘肃省农科院土壤肥料与节水农业研究所 甘肃兰州 730070;2甘肃省农科院旱地农业研究所 甘肃兰州 730070)
摘要:采用无机磷固体培养基从甘肃省河西高钙土中分离出具有解磷能力的菌株16株,测定了各初选菌株溶磷能力。16株溶磷菌株的D/d值(溶磷圈直径D与菌落直径d的比值)范围在1.24~5.4,有效溶磷量在7.6~356.2mg/L,均具有一定溶磷作用。其中,P3-16、P3-28菌株在液体培养条件下的有效溶磷量均显著高于其他菌株,解磷率达7.22%、6.67%,为进一步研制适合高钙土土壤环境的磷细菌肥料提供优质菌种。
关键词:解磷菌;高钙土;解磷能力
磷是植物生长发育不可缺少的大量营养元素之一,是植物的重要组成成分。世界上绝大部分农业土壤缺磷(总磷不缺,活性磷缺)[1],就我国而言,74%的耕地土壤缺磷,土壤中95%以上的磷为无效磷[2,3]。施入的磷肥当季利用率为5%~25%,大部分磷与土壤中的Ca2+、Fe2+、Fe3+、A l3+结合形成难溶性磷酸盐[2],不能被植物利用。
甘肃省的河西地区灌溉耕地面积达1953.66万亩[5],土壤类型属灌漠土,土壤中钙的含量较高,而速效磷含量极低,钙的含量极大的影响着磷的有效性,随着碳酸钙含量的增加,磷的有效性降低[4]。我省金昌市土壤中钙的含量高达14500~18 850μg/ml[6],是甘肃中部土壤钙含量的5~10倍。在该土壤上施用大量磷肥(如450kg P2O5/hm2)也无明显增产效果,而栽培作物却表现出明显的缺磷症状。这可能是土壤中钙对磷酸盐的吸附固定造成的。大量的研究结果证明,土壤中存在着大量的解磷微生物(Phosphate-solubilizing microorganisms,PSM)[1],能够依靠自身的代谢产物或其他生物协同溶解土壤中的难溶无机磷,将植物难以吸收利用的磷转化为可吸收利用的形态,这种微生物对土壤磷的转化和有效性影响很大。本研究从高钙土分离了16株溶磷细菌,并对16株细菌的溶磷能力做了一个初步的研究,为进一步研制磷细菌肥料的提供优良的菌种。
注:本文发表于《干旱地区农业研究》,2008,26(2):7-10.
1 材料与方法
1.1 材料
1.1.1 土壤样品
2005年6月分别采集张掖小麦、金昌小井子大麦、油葵、武威白云村小麦、玉米、民勤西瓜的根际土壤。
1.1.2 培养基
用于测定无机磷细菌溶磷能力的液体培养基(PKO)[7]:葡萄糖10g,NaCl 0.3g,KCl 0.3g,MgSO4·7H2O 0.3g,FeSO4·7H2O 0.03g,MnSO4·4H2O 0.03g,(NH4)2SO41g,磷酸钙5g,蒸馏水1000ml,pH值为7.0~7.5。
溶磷菌分离所用的固体培养基除了加入15g琼脂粉以外其余同上。
LB培养基:胰蛋白胨10g,酵母浸体物5g,NaCl10g,琼脂粉15g,蒸馏水1000ml。
1.2 方法
1.2.1 溶磷菌的分离与纯化
溶磷菌的分离采用常规的10倍稀释法稀释样品,分别吸取浓度为10-5、10-6、10-7的稀释液0.1ml均匀涂抹在无菌的PKO平板上,在28℃培养7d,选择具有透明圈的菌落进行分离纯化。
1.2.2 溶磷菌株初选
观察溶磷圈:将PKO无机磷培养基制作成平板,解磷菌制备成菌液,用接种针在无菌条件下每板点植三个点,于28℃下培养7~10d,观察有无溶磷圈生成,测定溶磷圈直径(D)、菌落直径(d),根据能否产生溶磷圈判断菌株有无溶磷能力,根据(D/d)值大小来初步确定菌株的溶磷能力[8]。
1.2.3 摇瓶复选
①取活化后的供试菌株斜面试管在无菌条件下,用接种环沾取2环转接到装有50ml无菌液体培养基(一级发酵培养基)的三角瓶中,29℃恒温振荡(190rpm/min)2~3天,镜检菌株的纯度及用LB平板测定发酵液的活菌浓度。②二级发酵将PKO液体培养基分装在100ml的三角瓶中,每瓶50ml,121℃灭菌30分钟后,每瓶接种培养好的一级发酵液2ml,另留不接种者作对照,试验重复三次,在28℃(190rpm/ min)恒温振荡培养7d后。离心(4800r/min)15min,取适量上清液,测其磷含量、pH值。上清液含磷量用钼锑抗比色法[9]测定,pH值用PHS-25酸度计测定。
解磷率计算方法:解磷率=(发酵液磷含量-对照溶液磷含量)×溶液体积(0.05L)/加入磷酸钙量(250μg)×100%
2 结果与分析
2.1 不同高钙土壤中溶磷菌的分离与筛选
根据PKO平板上有无溶磷圈,筛选出16株溶磷菌,其中武威玉米根际分离出4株,小麦根际分离出2株,金昌大麦根际分离出3株,油葵根际分离出3株,民勤西瓜根际分离出2株,张掖小麦根际分离出2株。
2.2 溶磷菌在固体培养基上的溶磷效果
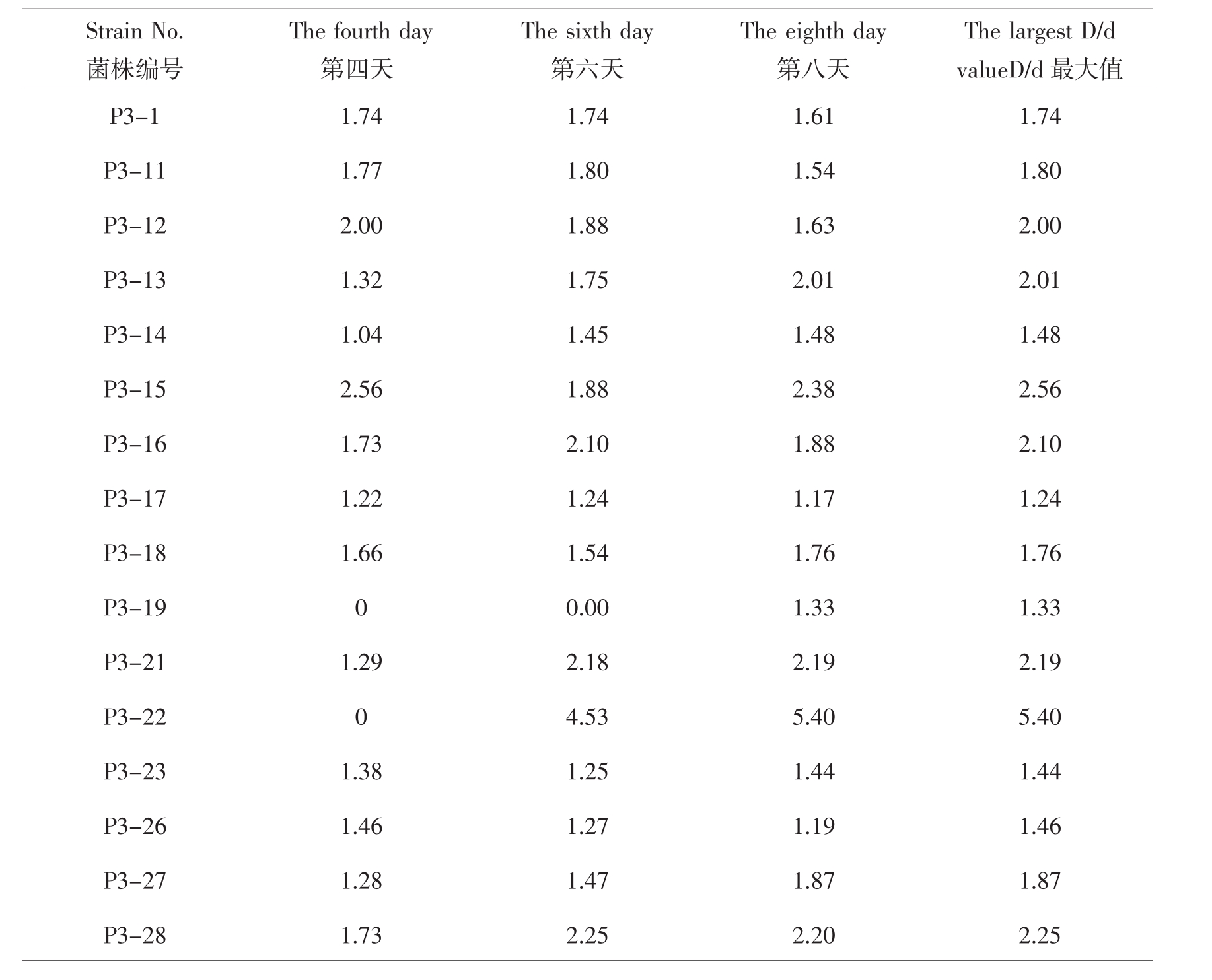
溶磷圈直径(D)与菌落生长直径(d)的比值(以几次测定结果的最大值为准)是表征溶磷菌的相对溶磷能力的一个指标[10]。对分离纯化得到的16个细菌菌株,用溶磷圈法对其溶磷能力进行测定(表1),16株细菌菌株中,溶磷效果极好的(D/d值≥4)有1株,溶磷效果好的(2≤D/<4)有4株,占细菌菌株总数的25.0%;溶磷效果较好的(1.5≤D/<2)有6株,占37.5%;溶磷效果较差的(D/<1.5)有5株,占31.25%。对D/ d≥2的5个菌株,将作为重点菌株,在以后的试验中,研究它们的溶磷能力、溶磷机理以及生理生化特性和促生特性;对1.5< D/d<2的6个菌株,作为发展潜力较大的菌株保存。
表1 几种细菌的D/d值
Table 1 D/d value of bacterium in different days
2.3 液体培养基中解磷细菌溶解无机磷效果
将16株解磷细菌分别单独接种到液体培养基中培养6d后,测定其上清液有效性磷含量。(表2)结果表明,16株解磷细菌,对磷酸钙都有一定的溶解作用。各解磷菌株之间溶解磷酸钙的能力不同,其有效磷含量在87.02~429.82mg/L,与不接菌对照相比,增量在7.6~356.24mg/L,增幅达18.27%~484.15%,其中增幅大于200%的菌株有11株,培养液中磷含量最高的为P3-16,其培养液中的浓度为429.82mg/L,比对照增加484.15%,它的解磷率达7.12%;其次菌株P3-28的培养液的磷含量为413.28mg/L,比对照增加461.67%,解磷率达6.79%。试验表明在进行供试的16株解磷菌中,菌株P3-16、菌株P3-28对磷酸钙的解磷效果最好。在磷含量增幅大于200%、小于400%的11个菌中,其中的10个菌株,溶磷效果较好,其磷含量在224.64~273.31mg/L,解磷率在3.02~3.99%。结果表明,P3-16、P3-28解磷效果好,可以考虑作为研制微生物肥料的重点菌种,其余13株还需进一步筛选才能用来制作生物肥料。
表2 不同菌株对磷酸钙的解磷率及pH值的影响
Table 2 Effects of different strain on P soluble rate of calcium phosphate and Ph
2.4 细菌培养液中磷含量与pH的关系
从表2可以看出,各菌株培养6天以后,相对于对照培养液的pH值培养液pH值均降低,其pH值在3.81~5.61,培养液中有效磷增加幅度大于200%的13株菌株的pH值则集中于3.81~5.53。说明这些细菌在培养过程中,能够分泌一些酸性物质,导致pH值下降。许多研究者也发现:培养介质酸度的提高,是微生物溶磷的重要表征之一。这说明溶磷微生物在其代谢过程产生了大量的致酸物质,如质子和有机酸,质子能够与磷矿粉中的离子发生交换反应,有机酸能够与钙、镁、铁等发生沉淀、络合甚至螯合反应,从而使磷矿粉溶解,磷酸根释放出来[11]。综合分析15株溶磷菌培养6d后其有效磷增量与培养液pH值之间的关系时发现,两者之间存在一定的相关性:Y溶磷量=-147.4XpH+983.73(r2=0.5469),但是相关性不显著。说明溶磷量与培养液的pH值之间无明显的相关性。
3 结论
本研究中采用了两种方法对分离的16株溶磷菌的溶磷能力进行了测定,16株溶磷菌对磷酸钙均有一定的溶解作用,在固体培养基上它们的溶磷圈直径与菌落直径比值在1.24~5.4,在液体培养解磷能力试验中,16株解磷细菌中各解磷菌株之间溶解磷酸钙的能力不同,其有效磷含量在87.02~429.82mg/L,与不接菌对照相比,增量在7.6~356.24mg/L,增幅达18.27%~484.15%,其中,菌株P3-16、菌株P3-28对磷酸钙的解磷效果好,其培养液中的浓度分别为429.82mg/L、413.28 mg/L,比对照分别增加484.15%、461.67%,它的解磷率达7.12%、6.79%,可以作为微生物肥料研制的重点菌种。本试验中采用两种方法测定溶磷菌株溶解无机磷的能力,两种方法测定的结果不完全相同。有些菌株在平板上溶磷圈很大,但在液体培养时溶解无机磷的能力却不强,反之亦然。许多研究表明,绝大多数的溶磷微生物在固体培养基上不显现溶磷圈。通过在固体培养基观察溶磷圈的这种方法来判断溶磷菌的解磷能力,有一定的局限性;液体培养可能是更为合理的方法。
在液体培养基中接种16种溶磷菌,经过6天后,液体培养液的pH值均下降,表明溶磷菌在生长过程中产生酸性物质。林启美等研究发现解磷菌能够分泌甲酸、乙酸、丙酸、乳酸、反丁烯二酸、琥珀酸、苹果酸、丙二酸等,这些酸一方面使培养液的pH值下降[12],但解磷数量与分泌的有机酸总量之间相关性很低。本试验中也证明溶磷量与pH值之间没有显著的相关性,这与林启美等的研究结果相一致。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















