10.2.3 微晶玻璃的组成及性质
微晶玻璃的组成与结构是影响其性能的主要因素。具有实用意义的微晶玻璃组成应符合以下条件:能满足使用性能要求;玻璃较易于熔制;成型过程中不析晶;晶化过程易于核化与晶化;晶化过程制品变形小。
微晶玻璃组成广泛、品种繁多。最初,微晶玻璃系统仅限于硅酸盐、铝硅酸盐等系统,组成也相对简单。经过多年研究,其系统已扩展到非硅酸盐和非氧化物系统。迄今为止,在已研究的成百上千种微晶玻璃中,实用微晶玻璃的品种并不太多。
1.Li2 O-Al2 O3-SiO2系统微晶玻璃
这种组成是非常重要的,因为光敏成核微晶玻璃就属于这种类型,其他有用的材料,包括具有非常低的热膨胀系数的微晶玻璃,就是由这个系统产生的。美国Corning玻璃公司最早研制出Li2 O-Al2 O3-SiO2系统光敏微晶玻璃,其组成范围(质量分数)为: SiO2 60%~85%,Al2 O3 2%~25%,Li2 O5.5%~10%,RO1%~5%,R2 O2.5%~4%。Li2O、Al2O3、SiO2的总和不能小于90%,其中Al2O3和Li2 O之比不应小于1.7∶1。晶核剂用量为: Au0.001%~0.03%(按Au计),Ag0.001%~0.3%(按AgCl计),Cu0.001%~1.0%(按Cu2O计)。
基础玻璃的组成不同,晶化后的晶相就不同。如Al2 O3含量增加,晶相为β-锂辉石及β-锂辉石和石英固熔体。玻璃中SiO2含量提高,晶相中Li2 O·2SiO2和石英晶体比例增大。当Li2O占的比例较大时,晶相主要为Li2 O·SiO2。引入K2 O时(<4%)可使晶相中Li2 O·SiO2增加。玻璃中碱金属氧化物含量不能大于4%,ZnO、SrO、CaO、BaO、PbO等二价金属氧化物的含量不应大于5%,以保证微晶玻璃具有较高的化学稳定性。
除了主要的组分外,玻璃组成中还含有晶核剂,这可以是一种金属、二氧化铁、一种金属磷酸盐或是前述其他材料之一。也常在玻璃中引入某些次要成分以改进它的熔化和加工性能或晶化特性。这些成分可以是碱土氧化物和碱金属氧化物。在某些情况下,某一成分的少量存在是极其重要的,因为它对晶化过程能给予显著不成比例的影响。氧化钾就是这种氧化物的一个例子。因为就像我们已经看到的它在光敏成核微晶玻璃中那样,在析出二硅酸盐之前先促进偏硅酸锂的形成。在另外一些情况下,它对发展二氧化硅的结晶形态能给予强烈的影响。
Li2 O-Al2O3-SiO2系统的微晶玻璃的主晶相多为β-石英固熔体或β-锂辉石固熔体,具有优良的耐热冲击性、较高的强度和较低的甚至接近于零的膨胀系数,因此引起许多玻璃工作者的关注。对于β-石英固熔体和β-锂辉石固熔体的结构及其形成过程已有十分详细的研究。自然界比较普遍的石英矿,在室温下的稳定型为α-石英,它的膨胀系数为150×10-7/℃,当加热到573~867℃时,便转变为膨胀系数为-5×10-7/℃的α-石英,而β-石英在室温下不稳定。
β-石英的晶体是由大量[SiO4]四面体连接而成的比较开放的六角螺旋结构。β-石英固熔体的化学分子式为:(Li2,R)O·Al2 O3·n SiO2,式中的R代表Mg2+或Zn2+离子,n介于2~10,对于具有重要商业价值的β-石英固熔体微晶玻璃,n值为6~8。当β-石英即β-SiO2中的Si4+离子有规则地用(Li++ Al3+)离子取代时,便生成具有不同成分和性质的β-石英固熔体。此时,Al3+离子位于Si4+离子的格点位置,而Li+填充于Al3+离子附近的构架空隙中而使电性达到中和。其中比较稳定的成分是半数的Si4+离子被取代,即生成可简写为LAS2的称为锂霞石的晶体(Li2 O·Al2 O3·2SiO2)。β-LAS2和β-石英之间可形成一系列连续的固熔体,这是因为它们具有同样的六角螺旋结构,β-锂辉石便是其中的一种,β-锂辉石对应分子式为Li2O·Al2 O3·n SiO2,n取值为4~10。如同β-石英中一样,β-锂辉石中Li+离子也可被Mg2+取代,但取代的程度远小于β-石英。β-石英向β-锂辉石的转变在900~1000℃之间,这是一种不可逆的过程。它们在螺旋所指的方向(c轴方向)膨胀系数都是负值,其他方向都是正值,但由微小结晶体堆集而成的材料的总膨胀值也是负的。
β-石英固熔体可以从含Li2O·Al2 O3·SiO2组成的玻璃中以微晶状态析出来,这样得到的微晶玻璃含有β-石英固熔体和残余玻璃等相,前者的负膨胀和后者的正膨胀相抵消,就成为膨胀系数为零或接近于零的微晶玻璃。
研究人员通过在Li2O-Al2O3-SiO2系统中引入不同数量的F-离子来测定微晶玻璃的晶化参数,并对其成核和晶化机理进行了讨论,采用的试样组成为: SiO2 65.7%~66.4%,Al2 O3 21.0%~21.5%,Li2 O3.9%,F-0~0.8%,TiO2 3%,ZrO2 1.5%,MgO1.5%,ZnO1.2%,BaO1.0%。研究表明,在Li2 O-Al2 O3-SiO2玻璃体系中,随F-离子添加量的增加,玻璃晶化后首先析出的均为Li x Al x Si1-x O2晶相,随着温度升高,这个晶相均向β-锂辉石固熔体转变,且没有发现氟化物析出。F-离子降低了Li2 O-Al2 O3-SiO2玻璃体系的稳定性,使得玻璃析晶和相转变的速度加快,这表明F-离子促进晶化效果较明显,它还促进了晶粒长大。
表10.2 β-石英固熔体微晶玻璃的组成(质量分数)(%)

表10.3 商用β-锂辉石固熔体微晶玻璃的组成(质量分数)(%)
下面介绍β-锂辉石的晶体化学。
锂辉石系LiAlSi2 O6共有三个变体,分别为α-锂辉石、β-锂辉石和γ-锂辉石。α-锂辉石在地质学上通常称锂辉石,是低温稳定变体。β-锂辉石是稳定的高温变体。γ-锂辉石是高温亚稳态变体,进一步受热将转变为β-锂辉石。β-锂辉石的结构中允许SiO2进入晶格,形成β-锂辉石固熔体,并且随结构中SiO2含量增多,其热膨胀系数趋于减小。其反应式可用下式表示:
Li2O·Al2O3·4SiO2+ n SiO2= Li2O·Al2O3·(n+4)SiO2(n≤4)
β-锂辉石游离硅 β-锂辉石固熔体
α-锂辉石属单斜晶系,在900℃以上是稳定的。当温度大于900℃时,α-锂辉石将发生结构上的变化,变成四方晶系的高温型锂辉石,通常叫β-锂辉石,也有叫LiAlSi2 O6П或凯石英固熔体。β-锂辉石的晶胞参数为a0=7.538,c0=9.516。β-锂辉石固熔体的晶胞参数与其化学成分(主要是SiO2含量)有着连续的变化,对于同一种成分,β-锂辉石固熔体的晶胞参数的变化是:随温度升高,a0轴收缩,c0轴膨胀,且膨胀的幅度小于a0的收缩幅度,晶胞体积变小。
β-锂辉石晶体结构图见图10.30。
β-锂辉石与凯石英的结构相似,被认为是凯石英的充填衍生体。其结构要点是:当有铝原子置换凯石英中的一些硅原子时,由此在结构中产生的空隙由Li离子充填,以保持电荷平衡。Li+可以自由地占据这些空隙,但K+和Na+则无法进入这些空隙,Li+

图10.30 β-锂辉石晶体结构图
主要占据二次螺旋轴的四面体空隙。
C.T.Li和D.R.Peacor对其进行了精确系统的晶体结构研究。β-锂辉石的空间群为P43212(或P41212),其晶胞参数为a0= 7.541±0.01 ,c0= 9.156±0.002
,c0= 9.156±0.002 ,Z= 4,D0=2.365,ρ=2.374g/cm3,(Si,Al)-O平均键长为(1.64±0.006)
,Z= 4,D0=2.365,ρ=2.374g/cm3,(Si,Al)-O平均键长为(1.64±0.006) ,Li-O平均键长为(2.081±0.041)
,Li-O平均键长为(2.081±0.041) 。
。
在结构中,Li原子与四个氧原子配位,Si和Al在四面体的分布是随机的。结构受五个(Si,Al)四面体联结组成的环支配。所有五元环均平行于(010)或(100)面,因而产生了类似沸石的孔道,直径约为3 ,这些孔道说明β-锂辉石具有离子交换性质。其晶体结构如图10.30所示。图中表示了在晶胞c轴方向上由五元环组成的铝硅酸盐螺旋链,正因为这螺旋链赋予了β-锂辉石特殊的热膨胀性。
,这些孔道说明β-锂辉石具有离子交换性质。其晶体结构如图10.30所示。图中表示了在晶胞c轴方向上由五元环组成的铝硅酸盐螺旋链,正因为这螺旋链赋予了β-锂辉石特殊的热膨胀性。
β-锂辉石结构在(001)和(100)面上的投影图分别由图10.31和图10.32表示。在图10.31中,可见结构中有两个结晶后位置不同的(Si,Al)四面体,分别用Si(1)和Si(2)四面体表示之。Si(1)原子位于八重的一般位置,而Si(2)则在二次对称轴上,并占据四重的等效位置。Si(1)-O键平均间距为1.647 ,Si(2)-O键平均间距为1.640
,Si(2)-O键平均间距为1.640 ,Si-O键总平均间距为1.643
,Si-O键总平均间距为1.643 。(Si,AI)四面体可形成相连的五元、七元和八元环,但结构主要取决于五元环。图10.32清楚地显示了(Si,A I)四面体组成的五元环结构。每个五元环包含两个Si(2)四面体和三个Si(1)四面体。每个Si(2)四面体供形成三个五元环,而每个Si(1)四面体供形成两个五元环,相邻的五元环共用一个、二个或三个四面体。每个五元环内的五个硅原子是不共面的,但五个桥氧则几乎是共面的。
。(Si,AI)四面体可形成相连的五元、七元和八元环,但结构主要取决于五元环。图10.32清楚地显示了(Si,A I)四面体组成的五元环结构。每个五元环包含两个Si(2)四面体和三个Si(1)四面体。每个Si(2)四面体供形成三个五元环,而每个Si(1)四面体供形成两个五元环,相邻的五元环共用一个、二个或三个四面体。每个五元环内的五个硅原子是不共面的,但五个桥氧则几乎是共面的。
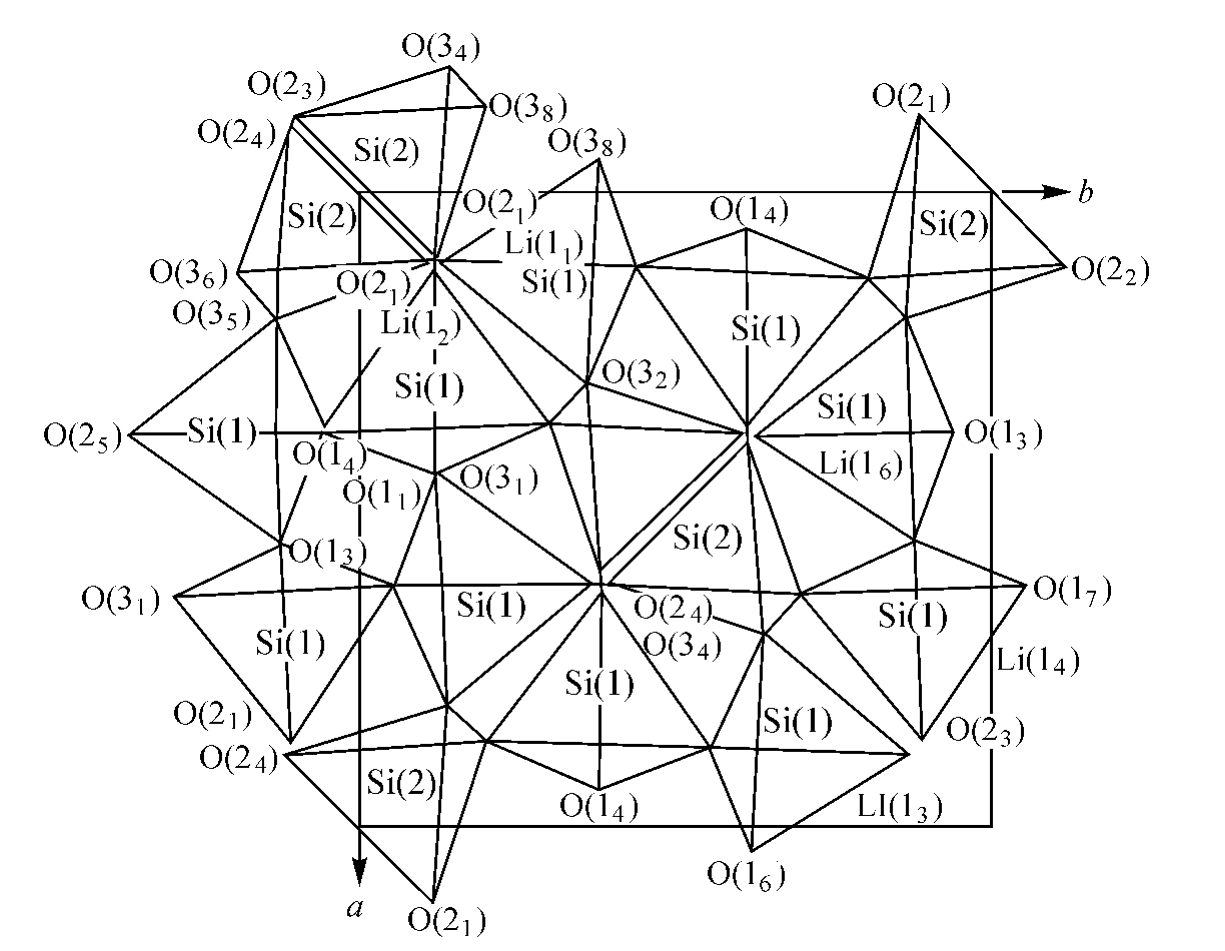
图10.31 β-锂辉石垂直于c轴投影

图10.32 β-锂辉石垂直于a轴投影
结构中锂原子充填于空隙,占据四次配位的一般位置。每个晶胞中只有四个锂原子,它们分布于四套成对的八个等效点位置,如图10.31、图10.32所示。每个锂原子占据成对位置中的一个。这两个位置之间的距离只有1.33±0.10 。显然这个距离太小,不足以供两个锂原子(锂原子半径0.74
。显然这个距离太小,不足以供两个锂原子(锂原子半径0.74 )同时占据这两个位置。每个成对位置的中心位置是六次配位,Li进入这个位置将使配位八面体发生畸变。Li-O间距为:沿c轴1.84
)同时占据这两个位置。每个成对位置的中心位置是六次配位,Li进入这个位置将使配位八面体发生畸变。Li-O间距为:沿c轴1.84 ,沿a,b轴分别为2.54
,沿a,b轴分别为2.54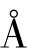 和2.65
和2.65 。温度升高,Li就有可能进入八面体位置,这样c轴将膨胀,a,b轴将收缩,这样是为了调节Li-O间距,以适合Li的六次配位。此外,使Li从四次配位的位置移到仅有0.66
。温度升高,Li就有可能进入八面体位置,这样c轴将膨胀,a,b轴将收缩,这样是为了调节Li-O间距,以适合Li的六次配位。此外,使Li从四次配位的位置移到仅有0.66 距离的六次配位位置上也无须消耗太多的热能。
距离的六次配位位置上也无须消耗太多的热能。
一般来说,晶体的低热膨胀性与其热膨胀各向异性有密切关系。各向异性越大,热膨胀率越小。例如,升温时,β-锂辉石固熔体成分中随SiO2含量的增多,其a,b轴收缩较大,而c轴膨胀则不太明显。其结果是,随固熔体中SiO2含量增多,热膨胀各向性增大,热膨胀系数减小,如图10.33所示。因此,β-锂辉石的热膨胀各向异性可以说明其固熔体系列中很低甚至是负的热膨胀率。
β-锂辉石热膨胀结构示意图见图10.34。
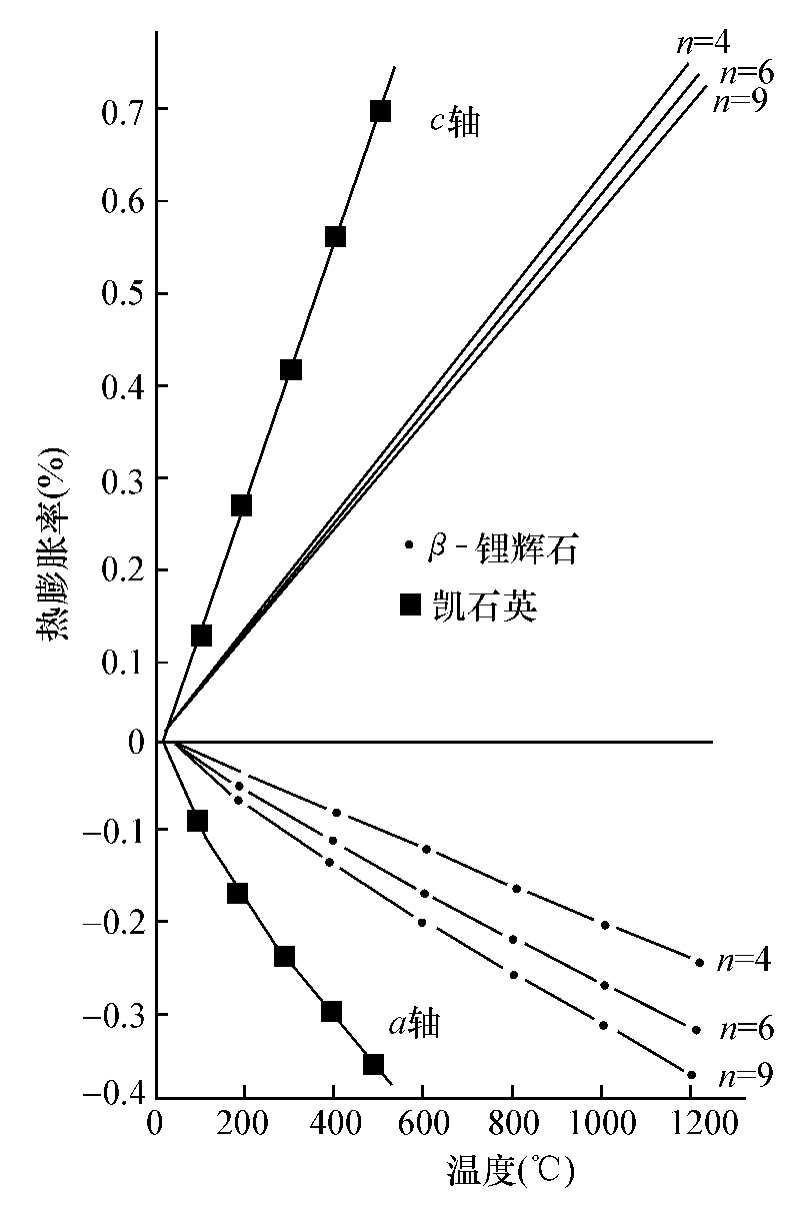
图10.33 Li2 O·Al2 O3·SiO2在a、c轴向的线膨胀系数
产生热膨胀各向异性的机理比较复杂,至今仍未得到圆满的解答。从结构上看,几乎所有显示大的热膨胀各向异性的晶体结构均具有螺旋轴,螺旋轴决定了晶体受热时膨胀与收缩的方向,这种螺旋链可与螺旋形弹簧相比较,它们在膨胀或收缩时具有强烈的恢复原形状的扭应力。

图10.34 β-锂辉石热膨胀结构示意图
β-锂辉石结构是由(Si,Al)-O四面体组成的五元环决定的,沿着c轴方向,(Si,Al)-O四面体组成螺旋链,如图10.30所示。每个Li原子(每对空隙Li原子之一)位于两个五元(Si,Al)四面体环之间,一个向上,约平行于(010),一个向下,约平行于(100),每个五元环中的五个桥氧几乎是共面的,形成一个比较有规则的五角形,如图10.32中的O(37)-O(27)-O(16)-O(16)-O(38)组成的桥氧五边形。最靠近Li的两个氧(一个向上,一个向下)平行于c轴,由于Li具有较强的电负性,能拉拢靠近自己的氧,因而在桥氧五角形中形成最小的O-O-O键角(91°),如图10.34所示,∠[O(32)-O(25)-O(35)]=90°。这91°键角明显地偏离理想五角形角108°,这意味着在这五元环中存在着向五元环中心的应力。受热时,热能将首先用于释放应力,增大O-O-O最小键角91°,同时使得沿着c轴的最靠近Li原子的两个氧原子如O(25)和O(26)分别向上和向下,如O(25)→O(25)'这样的c轴膨胀。当四个相当的(Si,Al)四面体,即与桥氧O(26)相连的四面体(图10.34所示的四个四面体)改变了取向,Li原子周围的两个氧原子(平行于a轴和b轴)则沿a或b轴向Li原子靠拢,如O(31)→O(31)',O(15)→O(15)',因而a,b轴收缩,其结果是总体积几乎保持不变。每个(Si,Al)四面体中的键长和键角在受热时变化很小,只有相邻四面体间的键角才发生较大的变化。此外,沿c轴方向上O的位移可在五元环内得到缓解,而沿a和b轴方向上的O的位移则不然,因此,受热时c轴的膨胀变化不大,而在a和b轴方向上的收缩则明显得多。这就是随温度升高,β-锂辉石各向异性增大的原因,从而也解释了β-锂辉石热膨胀率低的结构问题。
2.CaO-Al2O3-SiO2系统微晶玻璃
CaO-Al2 O3-SiO2系统微晶玻璃大多是基础玻璃在表面析晶机理控制下晶化而得到的微晶玻璃,但在特殊情况下也可以加入晶核剂,如利用矿渣、炉渣生产微晶玻璃,由于矿渣、炉渣中含碱性氧化物含量较高,必须在其中添加石英砂及其他组分包括晶核剂。由这种基础玻璃制得的微晶玻璃,其主晶相为硅灰石。这种微晶玻璃具有较高的机械强度、良好的耐化学腐蚀性、独特的光化学性能以及其他优良性质,因此可用做建筑装饰材料和耐磨、耐腐蚀材料。这种微晶玻璃已在国内大规模生产并得到广泛应用。
Wada和Ninomiya等发现,如下组成的基础玻璃可以制成硅灰石微晶玻璃: 59% SiO2,7% Al2O3,17% CaO,6.5% ZnO,4% BaO,1% B2 O3,3% Na2 O,2% K2 O,0.5% Sb2 O3。
这种微晶玻璃的光化学性质是由玻璃基体中的针状β-硅灰石晶体的结构所决定的。由于玻璃基体与β-硅灰石晶体对光的衍射不同,使材料看起来像大理石或花岗岩。如果热处理时玻璃加热至1200℃,就会形成β-硅灰石的粗晶结构,而使微晶玻璃变得不透明。
Meada等1992年研究了一种β-硅灰石微晶玻璃的整体核化和析晶机理。这种微晶玻璃组成为: 55.5% SiO2,11% Al2 O3,3.8% B2 O3,2.2% MgO,15.3% CaO,8.8% Na2O,3.0% K2 O,0.4% Sb2 O3。此外,向基础玻璃中添加一些金属盐类作为晶核剂,如Ru、Rh、Pd、Ir、Pt、Au的氯化物或AgNO3,以Sb2 O3和SnO作还原剂。由于非均匀成核,在玻璃中形成金属胶体,反应如下所示:
Pt4++ 2Sb3+→Pt+ 2Sb5+
Pt4++ 2Sn2+→Pt+ 2Sn4+
目前,国内建筑装饰用CaO-Al2 O3-SiO2系统微晶玻璃主要是不含晶核剂、以玻璃颗粒表面向内部析出针状或枝状晶体的微晶玻璃。其基础玻璃组成范围为: 55%~70% SiO2,15%~22% CaO,2%~9% Al2O3,1%~8% Na2 O,0~6% ZnO,其他添加物0~6%。
由于烧结法工艺的特殊要求,玻璃的成分既要易于析晶,又要使其在晶化处理中具有一定的蠕变性,以利于颗粒之间的黏性烧结。因此,玻璃的晶化有别于靠晶核剂诱发而在整个体积内均匀析晶的情形,而必须借助于大量颗粒的表面能成核晶化,玻璃成分的选择应使其满足这一工艺要求。成分中SiO2、CaO和Al2O3基础成分选择主晶相为CS的相区,为调整熔体的工艺性质,满足晶化要求,外加了调整氧化物Na2 O、K2 O、ZnO、BaO等。
3.MgO-Al2O3-SiO2系统微晶玻璃
MgO-Al2O3-SiO2系统微晶玻璃是一类重要的无机非金属材料,从MgO-Al2O3-SiO2的相图来看,该系统微晶玻璃能析出性能优越的多种晶相,具有机械强度高、热冲击性好等优良性能。更重要的是,这类微晶玻璃可以完全不含碱金属离子,从而可获得优异的电性能,包括低介电损耗和高电阻率。不过有时也会引入少量的碱金属氧化物以及其他组分,以改善其性能。
主晶相为堇青石的MgO-Al2 O3-SiO2系统微晶玻璃具有重要的商业价值。这种微晶玻璃最早由美国Corning玻璃公司开发。堇青石型微晶玻璃具有较高的机械强度、优良的介电性能、良好的热稳定性和抗热冲击性能。
堇青石的化学式为2MgO·2Al2O3·5SiO2,如果按照堇青石的化学计量成分,堇青石微晶玻璃的理想组成为: 13.8% MgO,34.9% Al2O3,51.3% SiO2。通常,以堇青石为主晶相的MgO-Al2 O3-SiO2系统微晶玻璃的基本组成点选择在MgO-Al2 O3-SiO2三元系统相图的堇青石区域内。
常用的MgO-Al2O3-SiO2系统微晶玻璃基础组成并不是照堇青石的化学计量组成,而是偏向于富含MgO或者Al2O3的组成,主要是为了优化基础玻璃黏度和制备工艺,提高微晶玻璃性能。通常为了促进其他晶相的析出,组成点常选择靠近堇青石组成区域的边界。同时,添加其他氧化物和晶核剂来调整微晶玻璃结构和析晶。
该类微晶玻璃基础组成为: 40%~70% SiO2,9%~35% Al2 O3,8%~32% MgO。此外,微晶玻璃还含有晶核剂,如7%~15% TiO2、3%~14% ZrO2或0.5%~6% P2 O5。其中几种重要的组成如表10.4所示。
表10.4 M gO-Al2O3-SiO2微晶玻璃组成(质量百分数)(%)

注: No.1为Corning9606堇青石微晶玻璃,No.2为CorningE1顽辉石微晶玻璃,No.3为CorningE2顽辉石微晶玻璃。
研究组成偏离堇青石的MgO-Al2 O3-SiO2系统微晶玻璃的转变动力学和微观结构,发现它们主要是由最原始的玻璃成分决定的。组成富MgO和SiO2而不是按堇青石的化学计量组成,这样就抑制了μ-堇青石的形成,从而促进了α-堇青石的晶化没有影响。这样,在一定的玻璃组成范围内,大多数晶体成为α-堇青石,只有少量的α-堇青石晶相转变成为μ-堇青石晶相,这就可以得到μ-堇青石相含量很低的微晶玻璃。这是因为α-堇青石的力学性能优于μ-堇青石,故μ-堇青石相含量很低的微晶玻璃具有很好的力学性能。
而对于富Al2 O3的组成,在玻璃中,Al3+以四配位状态与[SiO4]形成统一的网络,使网络的连接程度增强,且Al2 O3含量越高则玻璃的网络稳定性越强,在主晶相形成时,则需要更多的能量。例如:
MgO+ Al2O3→MgAl2O4
同时,随着Al2O3含量的升高,使玻璃的黏度增大,析晶活化能升高。这样使得微晶玻璃的热处理制度较易控制,通过微晶相控温,降低升温速率,降低核化或晶化温度,增加保温时间,使制备的微晶玻璃具有较小的晶粒和合理的晶相,从而提高了微晶玻璃力学性能。对于微晶玻璃而言,其力学性能(如抗折强度等),不仅取决于微晶玻璃的晶相,也取决于玻璃相。随着Al2 O3含量的升高,使得微晶玻璃中玻璃相强度也增强,因此使得微晶玻璃的力学性能增强。
堇青石型MgO-Al2 O3-SiO2系统微晶玻璃通常使用的氧化物晶核剂是TiO2,当TiO2质量分数在2%~20%时,其对微晶玻璃的晶化有促进作用。TiO2可溶于一个较宽范围的熔融玻璃中,但是在冷却或重新加热时,在玻璃中析出大量的亚微观粒子,这些粒子显然有助于从玻璃中析出晶相。
在表10.4的No.1多元组成玻璃系统中,约9%的TiO2作为非均匀成核的晶核剂引入,基础玻璃进行热处理时,二钛酸镁(Mg-Ti2 O5)作为初析晶析出,而在析晶过程中,堇青石主晶相以六方状析出。对材料性能起决定作用的就是堇青石主晶相。1992年Beall发现,这种堇青石表现为一种特殊的固熔体,生长成镁绿柱石。也就是说,堇青石和堇青石固熔体向绿柱石进行化学调整,结果是Mg2+和Si4+取代2个Al3+。主晶相除了堇青石和堇青石固熔体外,还有其他晶体如方石英和金红石,少量的残余玻璃相存在于晶相之间。这些晶相的形成取决于基础玻璃的热处理温度。表10.5是Corning玻璃公司9606微晶玻璃析晶过程中的相组合。
表10.5 Corning9606微晶玻璃析晶过程中的相组合

Corning玻璃公司提出了堇青石微晶玻璃的改进组成,其范围为: 48%~53% SiO2,21%~25% Al2 O3,15%~18% MgO,9.5%~11.5% TiO2,0~1% As2 O3,其特点是采用增强方法后断裂模量(MOR)超过210MPa,而膨胀系数比9606微晶玻璃要低。较好的组成为: 49.9% SiO2,23.2% Al2 O3,15.8% MgO,10.7% TiO2,0.4% As2 O3。将基础玻璃于1600℃保温6h熔化,浇铸后750℃退火。玻璃在800℃保温2h核化,1240℃保温8h晶化。增强处理的目的是去除表面微裂纹,方法是先用5% NaOH溶液浸泡25min,溶出石英,然后再用5% H2 SO4溶液浸泡10min,溶出残余玻璃相,反复6次,表面形成厚度为0.25~0.375mm的多孔层,起到增强作用。
此外,为了控制MgO-Al2O3-SiO2系统微晶玻璃的析晶或者为了获得其他优良的性能,通常在微晶玻璃中引入稀土元素。在对应于堇青石(2MgO.2Al2 O3. 5SiO2)化学计量组成的MgO-Al2 O3-SiO2系统微晶玻璃中掺杂CeO2,研究其晶化过程,发现加入CeO2后的玻璃转变温度Tg变低了,并且可促进α-堇青石晶相的析出,使之成为主晶相。以堇青石为主晶相的微晶玻璃具有较高的机械强度和硬度以及较低的膨胀系数。
MgO-Al2O3-SiO2系统微晶玻璃的一个重要应用就是用做计算机硬盘基板,对于这类用途的MgO-Al2O3-SiO2微晶玻璃而言,必然要求其具有较好的力学性能、合理的微观结构。一种以尖晶石为主晶相的MgO-Al2 O3-SiO2微晶玻璃,其弹性模量为96~160GPa,断裂韧性超过1.0MPa·m1/2。作为主晶相的尖晶石细晶粒分散在硅质基质中。这使材料的强度、韧性、硬度都能满足磁盘基板的要求,但抛光比较困难。为了改善材料的抛光性能,人们研制了以尖晶石和顽辉石固熔体为主晶相的MgO-Al2 O3-SiO2微晶玻璃,其断裂模量不小于103MPa,努普硬度至少为775,断裂韧性超过1.0MPa·m1/2,由于微晶玻璃中出现了比尖晶石稍软的顽辉石固熔体晶相,使得其抛光性能大大改善。
人们对SiO2-Al2 O3-MgO-ZnO-TiO2系统纳米微晶玻璃的成核及结晶进行了研究,发现采用TiO2晶核剂可以极大地促进微晶玻璃的成核及晶化,通过一定的热处理工艺可得到以堇青石、β-石英固熔体、α-石英、尖晶石、顽辉石为主晶相的微晶玻璃。
通过对SiO2-Al2 O3-MgO-ZnO-TiO2纳米微晶玻璃的微观结构和其表面进行研究,发现该微晶玻璃具有很好的抛光性能(抛光后表面粗糙度小于0.5nm),同时还具有较高的弹性模量和较高的强度。这些优越的性能使SiO2-Al2 O3-MgO-ZnO-TiO2系统微晶玻璃能很好地应用于硬盘基板。
对于用作硬盘基板的MgO-Al2O3-SiO2微晶玻璃,主要是采用TiO2作为晶核剂,而在另外一些MgO-Al2 O3-SiO2微晶玻璃中,还采用复合晶核剂。一种透明的MgO-Al2 O3-SiO2微晶玻璃,基本组成为: 8% MgO,24% Al2 O3,68% SiO2。在母体玻璃中引入TiO2和ZrO2作为晶核剂,当引入ZrO2后,最佳的成核温度为800℃,最佳的晶化温度为870℃。最后获得的主晶相为β-石英固熔体和莫来石,其可见光透过率约为80%。如果单纯采用TiO2作为晶核剂的话,很难确定最佳的成核温度和析晶温度,还易使微晶玻璃在加热过程中产生半透明现象,导致最终制得微晶玻璃透明性变差。
堇青石的晶体化学内容如下。
堇青石有两种同素异构体:①低温稳定的四方结构(Orthorhombic),称β-堇青石。②高温稳定的六方结构(Hexagonal),称α-堇青石,又名印度石(Indialite)。此外,还有一种六方结构的中间过渡型μ-堇青石(MgO·Al2 O3·4SiO2)。从原子排布看,β和α的区别在于Al,Si原子的有序程度。在四方结构中,Al,Si原子完全有序排列,而六方结构中Al,Si原子的有序度下降,[AlO4]四面体占据六元环的一个随机位置。通常的人工合成方法大多得到α-堇青石。六方晶系的α-堇青石其空间群为P6/mcc,晶格常数a= 0.9770nm,c= 0.935mn(JCPDS卡片13-293),六元环内径为0.58nm。在结构中,由五个[SiO4]四面体和一个[AlO4]四面体组成一个六元环。六元环沿c轴同轴排列,相邻两层互错30°角。六元环之间靠[AlO4]四面体和[MgO6]八面体连接。[AlO4]四面体和[MgO6]八面体共棱连接,从而构成稳定的堇青石结构。
一般认为,晶体的热膨胀是由于晶体化学键的键长、键角的变化引起的。而在堇青石的结构中,Si-O、Al-O键长的变化受温度的影响很小。Ikawa,Predecki和Hass认为,堇青石晶体的热膨胀驱动力是[MgO6]八面体的热变形,由于Mg-O之间的弱键力,造成沿a轴的膨胀和沿c轴的收缩,出现各向异性的热效应,使[MgO6]八面体扁化(d1增加,c2减小),如图10.35所示。图中T1是指六元环间Al-O四面体,T2是指六元环的顶点上的Al/Si四面体,M是Mg-O八面体。O1是指T1或T1/T2共用的氧原子,O2是指T2配位的氧原子。他们还根据在不同温度下精确测得的XRD数据,计算了纯堇青石晶体中各离子的三维坐标值、键长和键角,发现M-O1键的长度和O1(1)-T2-O1(2)的键角的变化最大。这一举动造成相邻六元环的转动,缓减了由于Mg-O距离(d l)增加造成的a增加,它是a向热膨胀系数较小的直接原因。另外,T1O4的附加变形也会促进六元环的转动。c轴收缩的原因有两个:①[MO6]八面体的扁化;②虽然T2-O1距离增大,但是由于T2外移使O1(1)-T2—O1(2)键角降低,最终与T2连接的O1(1)-O1(2)距离c1几乎不变。

图10.35 堇青石热膨胀示意图
对单晶堇青石的高温XRD分析表明,在热膨胀过程中沿a轴、c轴的热膨胀系数分别为αa= 2.5×10-6/℃,αc=-0.9×10-6/℃,平均值为α=(0.5-1.0)×10-6/℃。图10.36是几位研究者分别作的单晶热膨胀曲线。不过该值的报道在各文献中有所不同,其原因可能是与材料的制备方法有关。
在氧化物系统中,堇青石的热膨胀系数最低,但其强度、刚度和硬度均较低,这是堇青石实际应用中的一个显著弱点。这些都与堇青石晶体的疏松结构有直接关系。特别是六元环中的大通道(0.56nm),可以使半径较大的离子、分子进入,如K+、Na+、Ca2+和H2O等,造成六元环的畸变。另外,其他与Mg2+、Al3+和Si4+尺寸相当的离子可以将其置换。这些行为可能会改变堇青石的热性能、电性能和机械性能。
为了进一步降低堇青石的热膨胀系数,改善热膨胀各向异性,提高热震性,迄今为止,已经尝试了在堇青石中添加碱、碱土金属、过渡金属和半导体元素等,取得不同程度的效果。所添加元素的性质(主要是与被替换元素在配位数相同情况下的离子半径、场强等)不同,它们进入堇青石晶格后所占据的位置也不同。大尺寸的碱金属、碱土金属元素主要占据六元环的通道,而过渡族元素有如下几种情况:一价离子进入六元环的通道之中;二价离子由于其离子半径与镁离子半径相近,可以替换镁离子;三价离子可能替换Al。半导体元素Ge只能替换Si,Ga只能替换T1中的Al。添加的元素不管占据何种位置都能造成晶格的畸变,但对晶体结构、点阵常数和热膨胀带来的效应不同。位于六元环通道中的离子通常使c增加、a降低;对Mg2+的置换使a增加、c降低;对T2中Si4+的置换使a、c都增加;对T1中Al3+的置换造成a下降、c增加。所有这些在晶格尺寸上的变化最终都能不同程度地改善堇青石的热膨胀系数,特别是各向异性效应。
图10.36 堇青石晶体的晶格热膨胀随温度的变化
实际上,改善堇青石热膨胀性能的工作远没有成熟,追求“近零膨胀”还存在许多问题。依靠调整沿a轴的膨胀和沿c轴的收缩量接近而得到近零膨胀,却带来相当大的热膨胀各向异性。这种材料在小的温度波动或恒温下的确能保证不膨胀,但在较大的温度波动时由于各向异性造成的内部微裂纹将大大缩短其使用寿命。
通过添加有效的元素和加入量来调整晶体内部各部分的变形量,使其在温度变化时能够相互抵消,对外表现出晶格常数a、c不变,这一工作需要大量不懈的努力。
4.SrO-Al2 O3-SiO2系统微晶玻璃
SrO-Al2O3-SiO2系统微晶玻璃具有很高的热稳定性、低的热膨胀系数以及低的介电损耗等优良性能。这些优良性能来自于微晶玻璃内生成的主晶相单斜锶长石(Monocelsian),单斜锶长石具有高温稳定性,它在熔点(~1650℃)以下保持稳定,同时具有低的热膨胀系数及良好的介电性能。该系统微晶玻璃在晶化过程中还会生成另一种晶相,六方硅铝锶石((Hexacelsian),是一种高温亚稳定相和高膨胀相,在微晶玻璃中应避免该相的存在。同时SrO-Al2 O3-SiO2与BaO-Al2 O3-SiO2属于同一个系统,SrAl2 Si2 O8与BaAl2 Si2 O8具有相同的晶格点阵,但SrAl2 Si2 O8中的六方相转变为单斜相比BaAl 2Si2O8中容易得多。因此,可以采用传统的熔融法制备只含有单斜锶长石晶相的SrAl2 Si2 O8微晶玻璃。
Corning玻璃公司对MgO-Al2O3-SiO2系统9606微晶玻璃进行改进,提出了新的组成SrO-Al2 O3-SiO2系统微晶玻璃,组成中不含晶核剂,采用玻璃粉烧结工艺,利用粉体表面成核。最佳玻璃组成为: 16.2% SrO,6.3% MgO,35.2% Al2 O3,42.3% SiO2。玻璃配合料熔化温度为1650~1700℃,时间2~4h,水淬后磨成3~5μm的粉末,干压成形后于1400℃保温1h晶化。主晶相为锶长石(SrO·Al2O3·2SiO2),次晶相为2MgO·2Al2 O3·5SiO2。这种微晶玻璃的特点是结晶量高,耐热性优异(长时间可耐1200℃,短时间可耐1600℃),机械强度高,化学稳定性好,并且介电性质和介电损耗适合于制造雷达罩。
下面介绍锶长石(SrAl2 Si2O8)的晶体结构。
SrAl2 Si2 O8(SAS)系统微晶玻璃中,晶体相存在三种形式:单斜锶长石相(Monocelsian)、六方硅铝锶石相(Hexacelsian)及正交相(Orthorhombic)。单斜锶长石相是一种高温稳定相,在1590℃以上保持热力学稳定。六方硅铝锶石相是亚稳定相,在从室温至1590℃温度范围内亚稳定存在。Hexacelsian表现出高的热膨胀系数~8×10-6 K-1,并且在~300℃时发生快速的可逆相变,转变为Orthorhombic,伴随有约3%的体积变化。对Hexacelsian与Orthorhombic进行的XRD分析,发现它们的衍射峰除峰形大小存在差异外没有明显区别,这表明Hexacelsian与Orthorhombic具有相似的晶体结构。SAS的Hexacelsian和Monocelsian线性热膨胀系数见图10.37。

图10.37 六方相和单斜相的线性膨胀
Hexacelsian的晶体结构是一种无限扩展的二维六方薄层,这种二维六方层由两层铝硅氧四面体[(Al,Si)O4]排列而成。其中,每个四面体共用三个顶点,剩余一个顶点,并且所有剩余顶点的氧排列方向相同。两个沿二维方向无限扩展的[(Al,Si)O4]四面体层通过共用剩余顶点的氧而形成双层的六方层状结构。Sr原子处于双层之间、与相邻十二个氧原子等距的位置,以补偿[(Al,Si)O4]四面体层中由Al原子取代Si原子而产生的电荷差。SrAl2 Si2 O8的六方相(Hexacelsian)晶体结构如图10.38所示。

图10.38 六方硅铝锶结构示意图
Monocelsian的晶体结构与长石相似,硅氧四面体[(Si)O4]的四个顶点共用形成三维网络,与Hexacelsian中相同,Al原子取代Si原子形成铝硅氧四面体[(Al,Si)O4],电荷差由处于结构空隙中的Sr原子来平衡。Gay和Newnham及Megaw认为,由Al、Si原子的重新排列,Monocelsian构成一个超晶格。在Monocelsian晶体结构中,Al、Si原子按统计规律分布于四面体格点中,铝四面体被占多数的硅四面体所包围,反之亦然。Sr原子规则排列,与相邻十个氧原子形成长度不同的Sr-O键。因此Hexacelsian转变为Monocelsian要通过Sr原子的重新排列,从二维层状结构转变为三维网络结构,这必须打破和重新生成Si-O键和Al-O键。SrAl2 Si2 O8的单斜相(Monocelsian)晶体结构如图10.39所示。

图10.39 SAS的晶体结构
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















