周昌平1 刘淑云1 寇广会1 徐庆阳1 陈宁1,2
(1.天津科技大学生物工程学院; 2.天津市工业微生物重点实验室 天津 300222)
摘要:以假单胞菌(Pseudomonas sp.) TS1138为供试菌株,研究了酶法转化DL-ATC合成L-半胱氨酸的酶促反应条件。通过考察酶源保存方式、酶促反应时间、底物浓度、酶浓度、金属离子等因素对酶活力的影响,确定了TS1138菌株酶法转化DL-ATC合成L-半胱氨酸的最适酶促反应条件,为酶促反应动力学的研究奠定了基础。
关键词:假单胞菌;酶促反应; L-半胱氨
L-半胱氨酸(L-cysteine)是组成蛋白质的20种氨基酸之一,也是一种重要的含硫氨基酸,广泛用于医药、化妆品、食品、饲料添加剂等行业。L-半胱氨酸所带的巯基具有许多重要的生理作用,如可以缓解药物(酚、萘、苯、氰离子)中毒,促进毛发生长等作用[1]。目前,L-半胱氨酸的生产主要依靠人或动物的毛发经酸水解或碱水解后制取,但该方法收率低,水解过程产生大量刺激性气体,废酸处理困难[2]。另外,由于卫生问题,从毛发提取的产品不符合医药的使用标准。近年来,随着L-半胱氨酸生产技术的发展,微生物酶法生产L-半胱氨酸逐渐取代了毛发水解制备L-半胱氨酸[3,4]。日本已报道了用DL-2-氨基-Δ2-噻唑啉-4-羧酸(DL-2-amino-Δ2-thiazoline-4-carboxylic acid,DL-ATC)为原料,采用微生物酶法合成L-半胱氨酸较为成熟的生产工艺。我国已有生产DL-ATC的厂家,但有关微生物转化DL-ATC生产L-半胱氨酸的报道罕见。因此,开展微生物酶法转化DL-ATC合成L-半胱氨酸的研究具有重要意义。
1 材料与方法
1.1 菌种
假单胞菌(Pseudomonas sp.) TS1138,由南开大学生命科学学院微生物研究室提供。
1.2 培养基
完全培养基(g/L) :牛肉膏10,蛋白胨10,酵母膏5,葡萄糖5,NaCl 5,pH 7.2。
种子培养基(g/L) :葡萄糖30,DL-ATC · 3H2O 3,酵母粉10,蛋白胨10,尿素3,MnSO4· 5H2O1,FeSO4· 7H2O0.01,MgSO4· 7H2O0.5,NaCl 1.5,K2HPO43,pH 7.5。
产酶培养基(g/L) :葡萄糖30,DL-ATC · 3H2O 3,玉米浆3,尿素3,MnSO4· 5H2O 1,FeSO4· 7H2O0.01,MgSO4· 7H2O0.5,NaCl 3,K2HPO43,pH 7.5。
1.3 培养方法
活化培养:接一环生长良好的斜面菌苔至装有30ml完全培养基的500ml摇瓶中,190r/min,29℃振荡培养12h。
种子培养:以10%接种量将上述活化培养液接入装有30ml种子培养基的500ml摇瓶中,190r/min,29℃振荡培养14h。
产酶培养:以10%接种量将种子培养物接入装有30ml产酶培养基的500ml摇瓶中,190r/min,29℃振荡培养22h。
1.4 分析方法
1.4.1 酶活力测定
(1)细胞悬液的制备:取一定体积培养液离心10min (4000r/min,4℃) ,弃去上清液,沉淀用pH 7.4的PBS缓冲液洗涤并重悬。继续离心10min,洗涤,重悬。第三次离心后,洗涤,重悬菌液。该菌悬液即为酶促反应所用细胞悬液,立即使用,或置于-20℃冰箱中冻存。
(2)酶促反应:取3ml底物溶液(DL-ATC1.5%,K2HPO41.5%)于10ml离心管内,接着加入1.5ml细胞悬液,置于42℃水浴中,反应2h后取出离心管,测定L-半胱氨酸含量。
(3)酶活力定义:在上述条件下,1h内转化底物生成1μg产物L-半胱氨酸所需的酶量作为一个酶活力单位(U) 。酶活力以每毫升酶液所含的酶活力单位数表示(U/ml)[5]。
1.4.2 L-半胱氨酸含量的测定
酸式茚三酮法测定,方法见参考文献[6]。
2 结果与分析
2.1 酶源保存方式对酶活力的影响
不同的酶源保存方式对细胞酶活力损失的影响较大,实验考察了酶源分别在-20℃和4℃下,保存不同时间的酶活力损失情况,结果如图1所示。
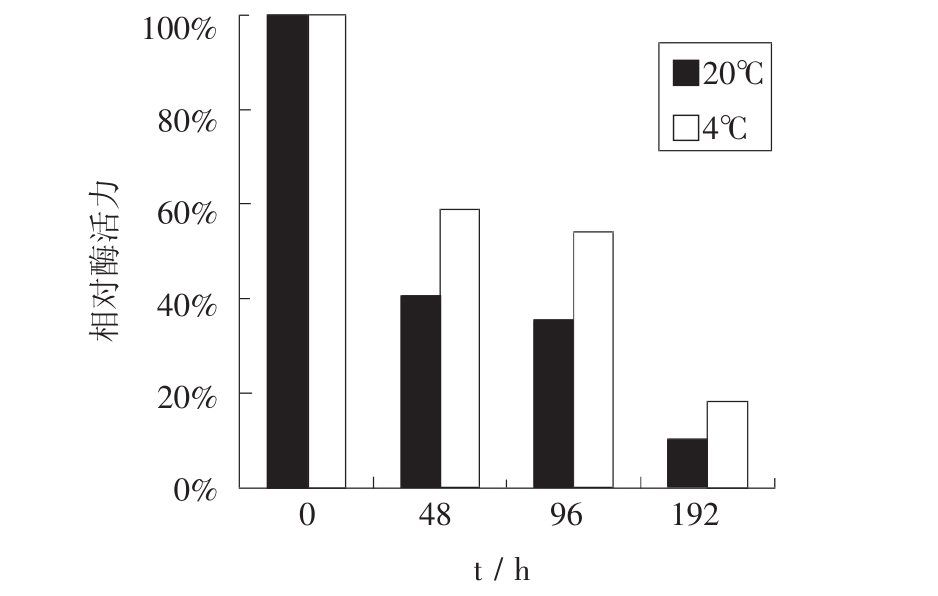
图1 酶源保存方式对酶活力的影响
由图1可知,酶源在4℃下保存比在-20℃下保存酶活力损失小,但在4℃下保存时间为48h时,酶活力损失已达40%,酶活力损失较严重。
2.2 酶促反应时间对产物浓度和酶活力的影响
由于TS1138菌株含有L-半胱氨酸脱巯基酶,该酶的存在使得酶法合成的一部分L-半胱氨酸产物被分解,降低了转化率和收率。实验考察了酶促反应时间对产物浓度和酶活力的影响,结果如图2所示。
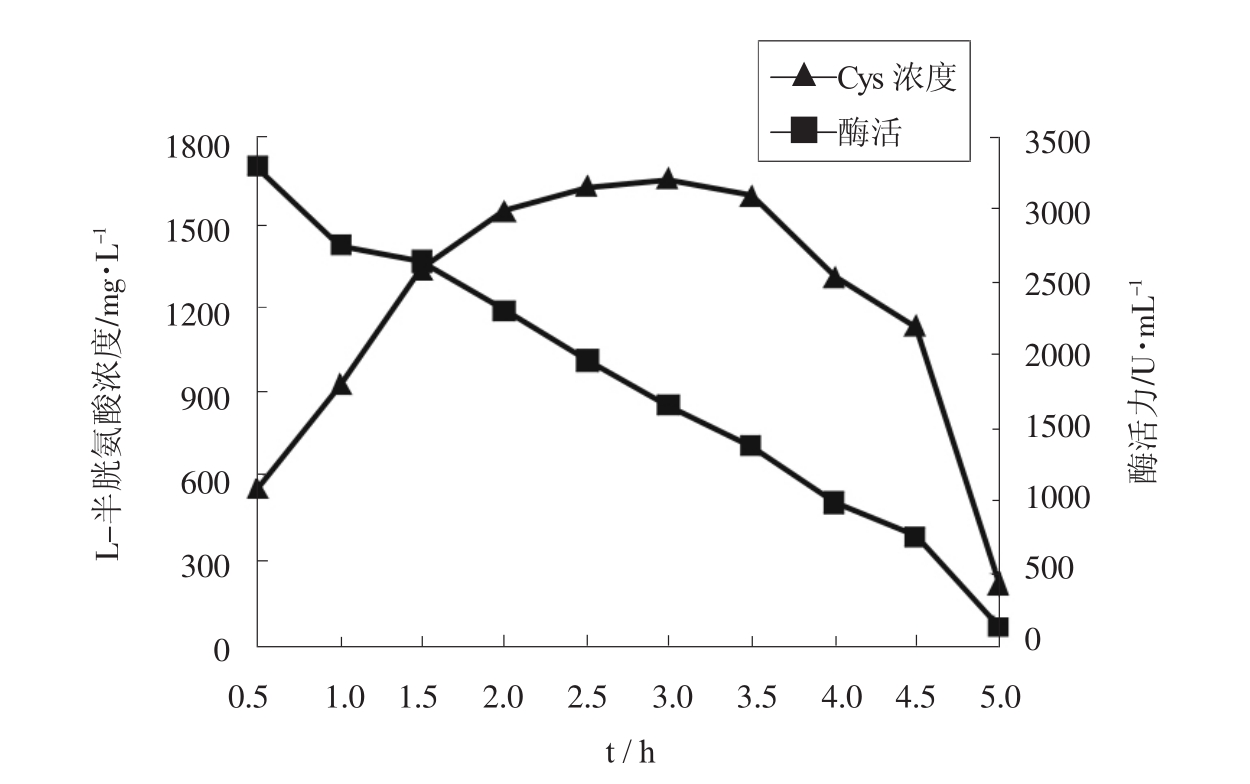
图2 酶促反应时间对产物浓度和酶活力的影响
由图2可知,随着酶促反应的进行,酶活力逐渐降低,L-半胱氨酸浓度逐渐升高,当反应时间为2.5h时,L-半胱氨酸浓度基本达到最大值,在3.5h后L-半胱氨酸浓度开始逐渐下降,反应进行5h时,L-半胱氨酸浓度仅为3h时的13%,说明TS1138菌株中L-半胱氨酸脱巯基酶具有较高的活性。
2.3 底物浓度对酶活力的影响
在酶促反应过程中,底物浓度与酶促反应速度有关。在一般的酶促反应中,随着底物浓度的增加,酶促反应逐渐达到最大反应速度。实验考察了不同底物浓度对酶活力的影响,结果如图3所示。
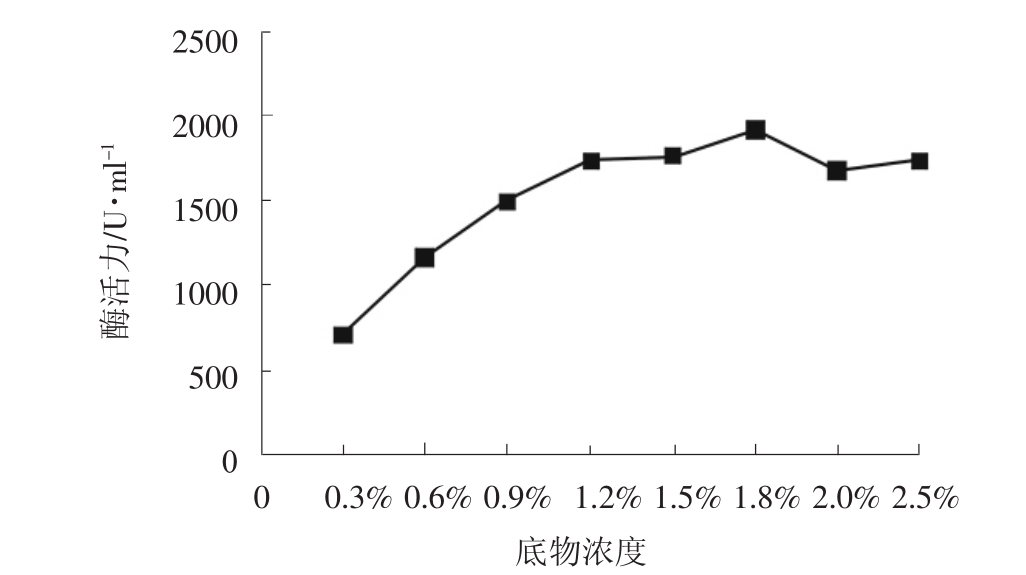
图3 底物浓度对酶活力的影响
由图3可知,随着底物浓度的增加,酶活力逐渐升高,当底物浓度为1.8%时,酶活力达到最大值,此后随着底物浓度的增加,酶活力有下降趋势。
2.4 酶浓度对酶活力的影响
在酶促反应体系中,酶浓度与酶活力有一定的关系。实验考察了不同酶液浓缩倍数对酶活力的影响,结果如图4所示。
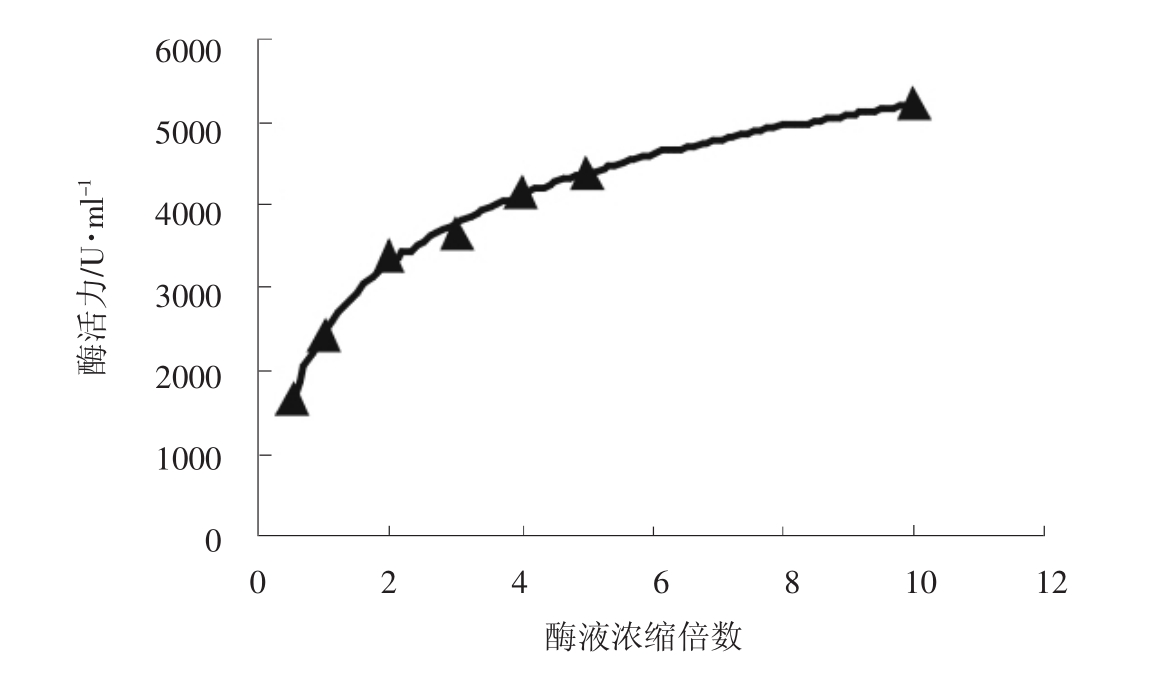
图4 酶浓度对酶活力的影响
由图4可以看出,随着酶浓度的增加,酶活力逐渐增大,当酶液浓缩5倍以上时,酶活力增长缓慢。
2.5 金属离子对酶活力的影响
由于某些金属离子往往是许多酶的激活剂或抑制剂,因此本实验考察了Mg2+、Mn2+、Fe2+、Zn2+和Cu2+五种金属离子对酶活力的影响,各离子的终浓度均为5mmol/L,结果如图5所示。
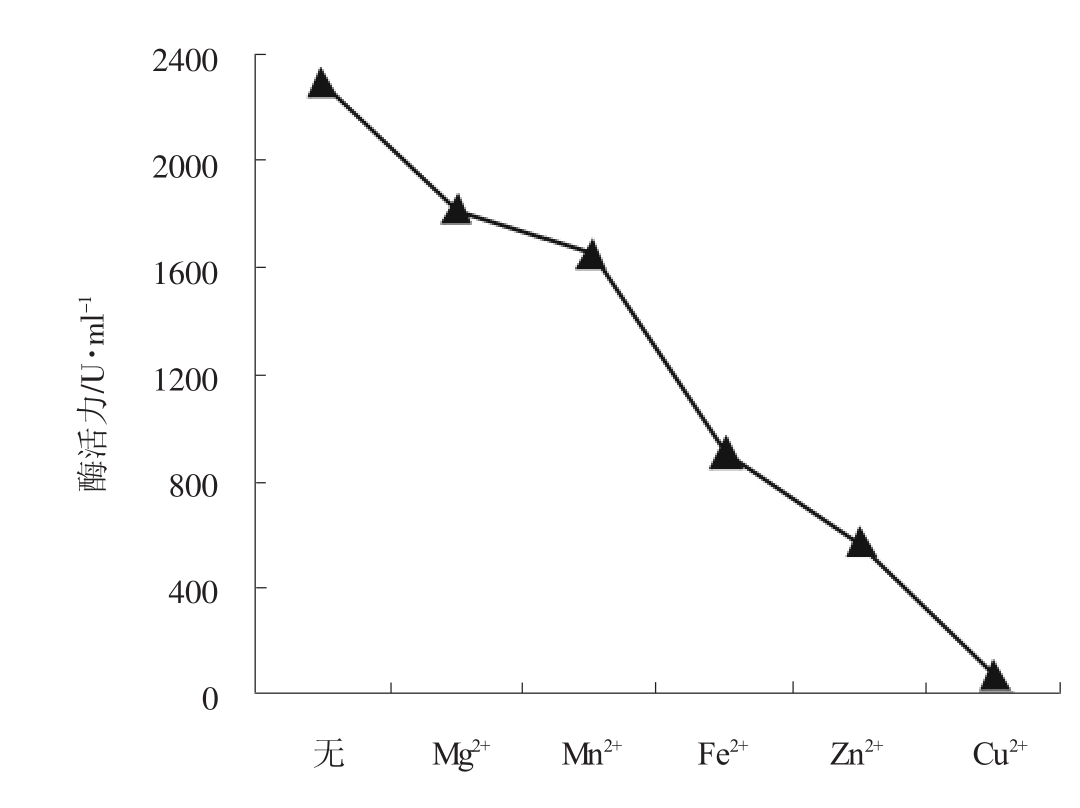
图5 金属离子对酶活力的影响
由图5可以看出,所考察的五种金属离子对TS1138菌株中DL-ATC水解酶酶系均有不同程度的抑制,其中Cu2+对该酶系有很大的抑制作用。
3 结论
本研究考察了酶源保存方式、酶促反应时间、底物浓度、酶浓度、金属离子等因素对酶活力的影响。研究结果表明,TS1138菌株中L-半胱氨酸脱巯基酶具有较高的活性,而且Mg2+、Mn2+、Fe2+、Zn2+和Cu2+五种金属离子对DL-ATC水解酶酶系均有不同程度的抑制,其中Cu2+对该酶系的抑制作用很大。本实验只是对微生物酶法合成L-半胱氨酸的酶促反应条件进行了初步研究,酶促反应动力学等有待进一步深入研究。
参考文献:
[1]杨金奎,何璧梅.微生物方法生产L-半胱氨酸的研究进展[J].国外医药抗生素分册,2001,22 (4) :179~182
[2] Ryu,O. H.,J. Y. Ju,and C. S. Shin. Continuous L-cysteine production using immobilized cell reactors and product extractors[J].Proc.Biochem,1997,32:201~209
[3] Sano,K.,and K.Mitsugi.Enzymatic production of L-cysteine from D,L-2-amino-Δ2-thiazoline-4-carboxylic acid by Pseudomonas thiazolinophilum: optimal conditions for the enzyme formation and enzymatic reaction[J]. Agric. Biol. Chem,1978,42:2315~2321
[4]Sano,K.,K.Yokozeki,F.Tamura,N.Yasuda,I.Noda,and K.Mitsugi.Microbial conversion ofDL-2-amino-Δ2-thiazoline-4-carboxylicacid toL-cysteineand L-cystine:screeningofmicroorganismsand identification ofproducts[J].Appl.Environ.Microbiol,1977,34:806~810
[5]刘忠,杨文博,孙丹.酶法生产L-半胱氨酸培养基的响应面分析优化[J].南开大学学报(自然科学版) ,2004,37 (1):83~87
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















