一、比较试管和比较胶头滴管设计与应用
(一)设计背景
《新课程标准考试大纲(化学)》强调:“化学科考试要求学生要认识实验、比较等方法的作用;要懂得实验方案设计、实验现象记录等方法在化学学习和科学研究中的应用。”据不完全统计,仅《普通高中课程标准实验教科书(化学)》必修1和必修2(人民教育出版社,2007年3月第3版)的比较实验就有31个,比较科学探究与实践活动有18个,其中必须用试管完成的比较实验有21个。可见,教材中比较实验资源多、内容广、涉及面大,化学比较实验是培养学生科学态度、科学方法和科学实验与实践能力的有效途径,是考查学生学习潜能和创新精神的重要内容。在教学中,由于教材中设计的比较实验步骤烦琐,实验现象存在时间差异,从而降低了比较实验的可信度和准确度。
(二)设计图
自制比较试管和双向胶头滴管如图4.11所示。

图4.11 比较试管和双向胶头滴管
比较试管(在普通试管中增加竖直隔板,相当于两支并列的普通试管)和双向胶头滴管(相当于两支并列的胶头滴管)用于两个平行的对比实验,以简化实验操作步骤,避免因时间差异引起现象差异和结论差异,增强比较实验的效果和优势。
(三)教学应用
1.催化比较
催化剂在化学反应中所起的作用叫作催化作用。催化剂在中学化学比较实验中有重要作用,它在化学反应中能改变其他物质的化学反应速率,而其本身的质量和化学性质在反应前后都没有发生变化,催化剂又叫触媒。
例:催化剂(如MnO2或FeCl3)对H2O2分解速率的影响。如图4.12所示。
图4.12 催化剂对H2O2分解速率的影响
通过应用比较试管对有无催化剂的反应现象进行比较,强化理解MnO2等催化剂对H2O2分解速率的影响。比较试管还可用于探究钠、镁、铝的金属性强弱等实验。
2.现象比较
根据“物质决定性质,性质具有相似性和存在差异性”的客观规律,教材中设计了许多关于物质的相似性和差异性的比较实验,以此激发学生的学习兴趣,教给学生科学的学习方法,使学生成功获得比较理解、掌握、识记、应用知识的感性认识,进而转化为学生学习的科学素养。
例:[实验2-1]硫酸钠溶液与氯化钾溶液和氯化钡溶液的反应(《普通高中课程标准实验教科书(化学)必修1》)。可增设“硫酸钠溶液与硝酸钾溶液和硝酸钡溶液的反应”的比较实验。用硝酸钾溶液和硝酸钡溶液分别代替氯化钾溶液和氯化钡溶液按如图4.13所示装置做反比较实验,现象相同。

图4.13 硫酸钠溶液与氯化钾溶液和氯化钡溶液的反应
比较实验结论:氯化钾、氯化钡、硝酸钾、硝酸钡等不同物质的性质不同,氯化钡、硝酸钡等钡盐与硫酸钠反应的现象相同。这说明物质存在本质的区别与差异,但也具有一定的内在联系和相似性。
3.热稳定性比较
物质的热稳定性与元素周期律有关。在周期表中,同周期元素的氢化物的热稳定性从左到右增强,同主族元素的氢化物的热稳定性从下到上减弱,即非金属性越强的元素,其氢化物的热稳定越强;氢氧化物随金属性越强,碱性越强,热稳定性就越强。含氧酸盐的热稳定性:若酸不稳定,其对应的盐也不稳定;若酸较稳定,其对应的盐也较稳定。那么,碳酸钠和碳酸氢钠谁更稳定?对“碳酸钠和碳酸氢钠的性质”实验作如下改进。

图4.14 碳酸钠和碳酸氢钠的性质实验改进装置
按图4.14连接好装置,检查装置气密性。点燃酒精灯,加热,观察干燥管里的白色硫酸铜的变色情况。注意观察、比较硫酸铜是否变蓝、澄清石灰水是否变浑浊及反应时差,进一步比较同一种酸的正盐和酸式盐的热稳定性。
(四)设计优点
在中学化学实验教学过程中,自制比较试管和双向胶头滴管的应用广泛,还能用于中学化学教材中的物质性质比较实验,能简化操作步骤,改进观察方法,节约药品,可操作性强。使用此装置后,比较现象明显,比较优势突出,结论科学,更具准确性、趣味性和说服力,有利于培养学生的感性思维、科学素养和创新能力。
二、比较燃烧器设计与应用
(一)设计背景
《义务教育课程标准实验教科书化学(九年级上册)》(人民教育出版社,2006年4月第2版)第七单元课题1第124页[实验7-1]“燃烧的条件和白磷在水中燃烧”,介绍了燃烧条件的实验探究内容。在白磷和红磷燃烧的对比操作中,从导管向烧杯底的白磷“吹气”时,由于气流缓急难以把握,熔化的白磷常常易被吹散成小液滴浮上水面燃烧,产生的白烟弥漫教室,让师生们都很难受,燃烧产物P2O5会污染环境,且尾气也很难吸收。根据“绿色化学”理念和可燃物质燃烧条件,针对上述问题,按照“查阅收集资料→整理归类资料→提出方案→实验实践→成果推广”路径,组织有关教师和部分学生开展了对“燃烧的条件和白磷在水中燃烧”的实验研究与实践,以此激发学生的学习兴趣,提高学生的环保意识和科学态度,开发学生的智力潜力,培养学生动手动脑能力和创新精神。
(二)燃烧器的设计与应用
1.仪器及试剂
500mL烧杯一个,大试管2~3支,自制“T”形单头燃烧器、“Y”形双头燃烧器、“W”形三头燃烧器各一支;红磷,白磷,热水,NaOH溶液。
2.燃烧器设计图及组装说明
分别用一支、两支、三支燃烧匙或铁丝制成“T”形单头燃烧器、“Y”形双头燃烧器、“W”形三头燃烧器各一支,下端弯曲成“U”形后,置于500mL烧杯中,按图4.15组装仪器和添加药品。图4.15(a)用于探究白磷燃烧条件,图4.15(b)和图4.15(c)用于对比探究白磷和红磷燃烧的条件。
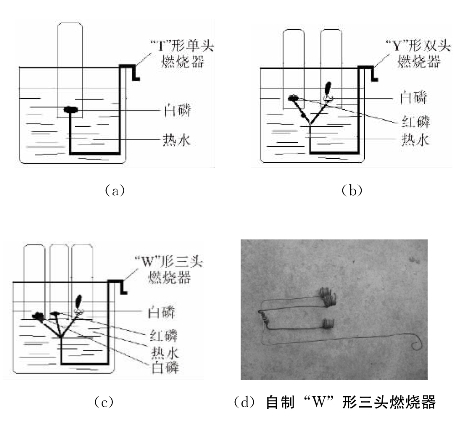
图4.15 燃烧器设计及组装
3.实验操作
(1)实验1:探究白磷燃烧条件。
按图4.15(a)所示装置,在“T”形单头燃烧器的金属盘中加入少量白磷(可以分步做红磷的对比实验),并倒入400mL的热水,使其没及“T”形单头燃烧器金属盘1~2cm。这时白磷不燃烧,这是因为可燃物质没有与氧气(或空气)接触。若用一支大试管(试管内用NaOH溶液润洗,以吸收燃烧产生的P2O5,防止环境污染)直接伸入热水中,倒扣在盛有白磷的“T”形单头燃烧器金属盘上(或将“T”形单头燃烧器提出水面),白磷燃烧。
(2)实验2:双向对比探究白磷和红磷燃烧的条件。
按图4.15(b)所示装置,分别在“Y”形双头燃烧器的两金属盘中加入少量红磷和白磷,并倒入400mL的热水,使其没及“Y”形双头燃烧器金属盘1~2cm。这时红磷和白磷均未燃烧,这是因为可燃物质没有与氧气(或空气)接触。取两支大试管(试管内用NaOH溶液润洗,以吸收燃烧产生的P2O5,防止环境污染)直接伸入热水中,分别倒扣在盛有红磷和白磷的“Y”形双头燃烧器的两金属盘上,红磷没有燃烧,白磷燃烧。
(3)实验3:三维对比探究白磷和红磷燃烧的条件。
操作与实验2基本相同(略)。
4.实践效果
(1)利用率高。铜仁市实验中学、铜仁学院附属中学大多数教师对该部分内容进行课堂教学时,均采用上述实验改进方案,实验现象明显,有效地落实了教学重点,突破了教学难点。
(2)认可度高。在2012年7月的“全国第十一届化学实验教学创新展示”中,“可燃物质燃烧条件的实验改进”课堂展示(优质实验课)获国家级奖励。2012年8月6日,“关于探究可燃物质燃烧条件的实验改进”在“全国新课程中学化学思维课堂研究及实践成果交流暨培训会议”论文评比上,获国家级一等奖。
(三)设计优点
(1)简化装置,设计新颖,操作方便。实验操作时,可固定在试管夹上,也可拿在手中,从而方便学生观察,更能体现条件的重要性。
(2)根据“绿色化学”理念,改进设计实验,进行闭合式操作,有效防止了P2O5污染环境,有利于培养学生的环保意识。
(3)现象明显,生动趣味,克服了实验操作时不同位置药品、仪器的温差,体现了等效性和均衡性,有利于开发学生的智力,培养学生动手动脑的能力。
三、多功能电化学演示器设计与应用
(一)设计背景
《普通高中课程标准实验教科书化学(必修2)》第二章“化学反应与能量”第二节“化学能与电能”设计了如图4.16所示的“铜-锌原电池”,“思考与交流”设计了如图4.17所示的“水果电池”。《普通高中课程标准实验教科书化学(化学反应原理,选修4)》第四章“电化学基础”第一节“原电池”,在“铜-锌原电池”的基础上做了改进,增加了一个“盐桥”,如图4.18所示。

图4.16 铜-锌原电池

图4.17 水果电池

图4.18 带有盐桥的铜-锌原电池
《义务教育课程标准实验教科书化学(九年级上册)》第四单元“自然界的水”中“课题3 水的组成”的“水的电解实验”设计如图4.19所示。《普通高中课程标准实验教科书化学(化学反应原理,选修4)》第四章“电化学基础”第三节“电解池”中的“CuCl2溶液的电解”如图4.20所示,而“电解饱和食盐水”没有设计演示实验或学生分组实验。《医学高等专科学校教材:医用基础化学》(中央广播电视大学医科类大专教材)第六章“氧化还原与电极电势”第二节“原电池”中的“铜-锌原电池示意图”与图4.18差不多,只是对硫酸锌溶液和硫酸铜溶液的浓度作了限定,均为1mol/L。

图4.19 水的电解
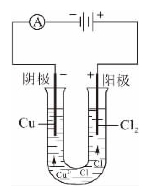
图4.20 CuCl2溶液的电解
除此之外,关于原电池和电解池的有关知识及实验设计,在高校“无机化学”“分析化学”“物理化学”等课程中都有介绍。可见,原电池和电解池的知识特别重要,堪称“主干知识”,是中考、高考的考点及大学课程考试的主要内容。这主要有两个原因:一是新课程理念对学生实验能力和实践能力的要求;二是顺应开发新能源和低碳生活的发展趋势。但在实际教学中,这部分内容往往因实验器材、外界条件限制等因素,几乎无法进行实验,有的老师惧怕操作步骤烦琐、实验准备麻烦而不做实验,另外,农村学校实验器材不足(如没有学生电源等)也不做实验。笔者通过比较思考上述几个原电池、电解池的实验设计,总结提炼原电池、电解池的实验共性,设计一种“多功能电化学演示器”,供老师们教学参考。
(二)设计图
多功能电化学演示器如图4.21所示。
图4.21 多功能电化学演示器
说明:(1)带小孔陶瓷板,主要用在进行某些能产生气体的电解实验中,便于透气或收集气体。
(2)针对原电池、电解池的实验内容需要,选择不同的电极及其他实验器材进行组装,以综合实验操作,增强实验效果和实验功能的比较优势。
(三)教学应用
1.在原电池实验中的应用
“铜-锌原电池”一直是教师讲授原电池构成要件、原理,选择电极、电解质溶液,书写电子转移和反应方程式等知识的代表性实验。在教学中,引导学生按图4.22组装仪器,观察实验现象。

图4.22 铜-锌原电池
实验现象:锌片逐渐溶解,铜片上有气泡产生。因锌比铜活泼,锌失去电子,被氧化为锌离子进入溶液,电子从锌片经导线流向铜片,溶液中的氢离子在铜片处获得电子被还原为氢原子,再结合成氢分子,最后聚集成氢气从铜片逸出。
铜-锌原电池的电极反应:
负极(锌片):Zn-2e- Zn2+(氧化反应)
Zn2+(氧化反应)
正极(铜片):2H++2e- H2↑(还原反应)
H2↑(还原反应)
2.在电解池实验中的应用
在初中化学、高中化学甚至大学《基础化学》等教科书中,都对电解使用较大篇幅加以阐述,介绍了电解水、氯化铜溶液、饱和氯化钠溶液等实验,这也就是电解作为中考、高考考点及大学课程考试重点的原因之一。笔者依托“多功能电化学演示器”设计了如图4.23所示的“水的电解实验”和如图4.24所示的“CuCl2溶液的电解实验”。分别按图组装仪器,接通电源即可。

图4.23 水的电解实验

图4.24 CuCl2溶液的电解实验
实验现象与实验结论:
(1)水的电解实验。通电后,两个电极上均产生气泡,一段时间后,右边量筒与左边量筒所收集到的气体体积比约为1∶2。经检验分别为氧气和氢气。一段时间后学生对“是正极产生氧气还是负极产生氧气”便开始模糊了,记不准确了。若能把实验现象用谐音记为“父亲正痒”(即负极产生氢气,正极产生氧气),学生将终生难忘。
水的电解的电极反应:
阳极:4OH--4e- 2H2O+O2↑(氧化反应)
2H2O+O2↑(氧化反应)
阴极:4H++4e-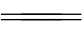 2H2↑(还原反应)
2H2↑(还原反应)
总反应方程式:2H2O 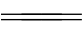 2H2↑+O2↑(反应条件:电解或通电)
2H2↑+O2↑(反应条件:电解或通电)
(2)CuCl2溶液的电解实验。通电后不久,可以看见阴极石墨电极上逐渐覆盖了一层红色的铜,在阳极石墨电极上有气泡产生,气体能使盖在烧杯上方带小孔陶瓷板下方的润湿KI-淀粉溶液滤纸变成蓝色。带小孔陶瓷板上方的润湿氢氧化钠溶液滤纸用于吸收Cl2,防止其污染空气。根据气体的刺激性气味和滤纸的变色现象,可以判断产生的气体是Cl2。
CuCl2溶液的电解的电极反应:
阳极:2Cl--2e- Cl2↑(氧化反应)
Cl2↑(氧化反应)
阴极:Cu++2e- Cu↓(还原反应)
Cu↓(还原反应)
总反应方程式:CuCl2 Cu+Cl2↑(反应条件:电解或通电)
Cu+Cl2↑(反应条件:电解或通电)
若能把该实验记为“正痒痒”(即正极连接阳极,阳极发生氧化反应),学生就能够记准确,并且不容易忘记。
3.在原电池和电解池综合实验中的应用
(1)设计原理及设计图:利用原电池和电解池的相互转换,例如,电解水和氢-氧燃料电池的综合设计,如图4.25所示。
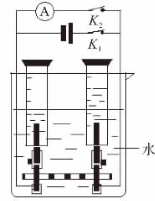
图4.25 电解水和氢-氧燃料电池的综合设计
(2)操作步骤和实验现象及结论:闭合 K㊣1,断开
K㊣1,断开 K2㊣,即为“水的电解实验”,现象与结论如前述“水的电解实验”。
K2㊣,即为“水的电解实验”,现象与结论如前述“水的电解实验”。
闭合 K2㊣,断开
K2㊣,断开 K1㊣,即为“氢-氧燃料电池”,实验过程中可以看见电流计指针发生偏转,说明闭合回路中有电流通过,氢-氧燃料电池处于工作状态。若现象不明显,可以加几滴硫酸钠溶液或硫酸钾溶液等,以增强水的导电性,从而使现象更加明显些。
K1㊣,即为“氢-氧燃料电池”,实验过程中可以看见电流计指针发生偏转,说明闭合回路中有电流通过,氢-氧燃料电池处于工作状态。若现象不明显,可以加几滴硫酸钠溶液或硫酸钾溶液等,以增强水的导电性,从而使现象更加明显些。
(四)设计优点
(1)综合性强。多功能电化学演示器具有适用范围广、知识覆盖面大、综合性强、比较优势明显的优点。能够用于电解水、氯化铜溶液、饱和氯化钠溶液等多种物质的电解实验,也可作为原电池的重要构成器件,可以设计多种形式的原电池、原电池与电解池的综合实验。
(2)比较性强。无论是原电池还是电解池,都是按照两组并列电极、化学反应、得失电子及转移方向等特征展开的。多功能电化学演示器能将原电池和电解池从构成、原理等方面加以比较,具有很强的比较优势,有利于开展比较学习与比较教学,有利于培养学生的创新能力。
(3)操作简单。用多功能电化学演示器代替多种器材的组装、连接和线路设计,简化实验步骤,使操作更加方便快捷,有利于开展演示实验和学生分组探究实验,使设计富有艺术特色和创新力。
(4)科学环保。在氯化铜溶液的电解实验中,用润湿KI-淀粉溶液滤纸代替原实验的试纸,现象更加明显;用润湿氢氧化钠溶液滤纸吸收生成的Cl2,以防止Cl2逸出污染空气。在水的电解实验中,用量筒代替试管,更加直观,更加科学。
(5)融入辩证观。通过对初中、高中及大学化学教材中的原电池、电解池实验的共性探讨和电化学实验规律的总结,从动与静、量与质、宏观与微观的角度设计实验,融入了辩证观念,有利于培养学生逆向思维能力。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














