一、氯气及其有关性质比较实验设计
(一)设计目的
中学化学教材《普通高中课程标准实验教科书化学(必修1)》(人民教育出版社,2007年3月第3版)第83~84页的“思考与交流”“实验4-3”“实验4-4”“实验4-5”中,氯气的制取、氯水或干燥氯气的漂白作用及其他有关性质的实验操作步骤较多,尾气也很难完全吸收,这给实验教学的开展带来了难度,使得许多教师不愿做,甚至怕做,许多学生也是闻而生畏。笔者通过教学实践,总结设计了两套氯气制取及其有关性质的全封闭式简易实验。
(二)实验设计
1.实验用品
学生电源1个,带支管的废旧试管2支,玻璃管1~2支,烧杯1个,石墨电极2个,胶头滴管1支,集气瓶1个,注射器3~4支,铁质小船1只,止水夹2个,红纸条2~3张,玻璃棒(或毛笔)1支,带橡胶塞导气管1套;饱和食盐水,蒸馏水,金属钠。
2.设计装置图及操作
(1)设计方案1。

图4.1 设计方案1
操作方法:预先制取并用注射器(也可用气球代替注射器以简化装置)收集一筒干燥纯净的氯气。按图4.1连好装置,并确定气密性,用玻璃棒(或毛笔)蘸取蒸馏水在红纸条上书写“实验成功”(或其他有趣文字),或用胶头滴管吸取蒸馏水将红纸条一端润湿,另一端保持干燥,然后把已经处理过的红纸条装入玻璃管中(红色的一面向外);用手推压充满干燥纯净氯气的注射器,让氯气迅速与经处理过的红纸条作用,不一会儿,红纸条上显现出“实验成功”(或红纸条润湿的一端褪色)。
由此得出实验结论:干燥的氯气没有漂白性,而是氯气与水反应生成的次氯酸具有漂白作用。
(2)设计方案2。

图4.2 设计方案2
操作方法:按如图4.2所示实验设计装置图组装仪器,接通电源,电解饱和食盐水,一段时间后,打开止水夹 B㊣将生成的氯气通入集气瓶,使红色纸条上出现“实验成功”四字(原红色纸条上曾用蒸馏水书写过“实验成功”四字)。由此得出,干燥的氯气没有漂白性,而是氯气与水反应生成的次氯酸具有漂白作用。挤压胶头滴管,使蒸馏水滴到金属钠表面上,迅速反应产生氢气,同时钠燃烧,可以看见钠在氯气燃烧产生的白烟现象。
B㊣将生成的氯气通入集气瓶,使红色纸条上出现“实验成功”四字(原红色纸条上曾用蒸馏水书写过“实验成功”四字)。由此得出,干燥的氯气没有漂白性,而是氯气与水反应生成的次氯酸具有漂白作用。挤压胶头滴管,使蒸馏水滴到金属钠表面上,迅速反应产生氢气,同时钠燃烧,可以看见钠在氯气燃烧产生的白烟现象。
(三)设计意义
设计方案1将氯气分别与干燥的有色布条和湿润的有色布条作用的两个实验合并、封闭进行设计,以简化装置,方便操作,使现象明显,且生动、富有趣味,可激发学生的学习兴趣,有利于培养学生的环保意识和动手动脑的能力。
设计方案2将教材上的有关氯气的制取及其有关性质的8个实验合并为一个装置,其美观、设计新颖、全封闭,具有用品用量少,步骤简化,操作方便,防止污染,对比性、可操作性强,比较优势、集成优势明显,现象生动、有趣味的优点。同时,可进一步设计氢氯燃料电池、铁在氯气中燃烧、氢气和氯气爆炸等实验,有利于开发学生的智力,提高学生的综合能力,培养学生的环保意识和团队精神。
二、酸雨的形成及危害模拟比较实验设计
(一)设计目的
酸雨有很大的危害,能直接破坏农作物、森林、草原,使土壤、湖泊酸化,还会加速建筑物、桥梁、工业设备、运输工具及电缆的腐蚀。在大学、中学的化学教材中,都介绍了绿色化学理念的有关知识和酸雨的形成及危害。为提高学生对酸雨形成、危害与防治的认识,进行“人工模拟酸雨的形成及危害”设计具有很强的现实意义。
(二)实验设计
1.实验用品
吸滤瓶1个,烧杯1个,带橡胶塞导气管1套,旋转小喷头1个,pH试纸(或pH计);大理石,镁条(或铝条),氢氧化钠溶液,二氧化硫气体(或二氧化氮,或氯化氢),水。
2.设计装置图

图4.3 设计装置
(三)实验操作
按如图4.3所示模拟实验设计装置图组装仪器,关闭止水夹 C㊣,打开止水夹
C㊣,打开止水夹 A㊣通入二氧化硫气体后,再打开止水夹
A㊣通入二氧化硫气体后,再打开止水夹 B㊣通入水,模拟人造酸雨的形成及危害,观察实验现象。
B㊣通入水,模拟人造酸雨的形成及危害,观察实验现象。
(四)设计意义
通过“人工模拟酸雨的形成及危害”设计,了解二氧化硫和二氧化氮等污染物的防治方法,以加强学生对酸雨的防治知识的了解,以及绿色化学理念和循环经济意识,激发学生学习化学的兴趣,培养学生的科学素质、环保意识和实验创新能力。
三、硫在空气或氧气中燃烧比较实验设计
(一)设计目的
《医用基础化学》第90页“阅读材料:酸雨”介绍了二氧化硫的有关知识。在《普通高中课程标准实验教科书化学(必修1)》(人民教育出版社,2007年3月第3版)第四章第三节(硫和氮的氧化物)第93页、《义务教育课程标准实验教科书化学(九年级上册)》(人民教育出版社,2012年6月第1版)第二单元课题2(氧气)第34页“硫在空气或氧气中燃烧”中,都讲到硫在空中或氧气中燃烧对环境会造成不同程度的污染,不利于培养学生的环保意识,且硫在空气和氧气中燃烧的时间差异过大,学生观察比较现象会存在疑惑。为此,笔者做了如下封闭式改进。
(二)实验设计
1.实验用品
吸滤瓶1个,电源及电炉丝1套,气球1个,胶头滴管1支,铁质小船2只,止水夹1个,带橡胶塞导气管1套;硫粉,二氧化锰,过氧化氢溶液,氢氧化钠溶液。
2.设计装置图

图4.4 设计装置
(三)实验操作
按如图4.4所示实验设计装置图组装仪器,接通电源点燃硫粉,观察硫在空气中燃烧的现象;挤压胶头,使过氧化氢溶液滴到二氧化锰中迅速产生氧气,观察硫在氧气中燃烧的现象,并与硫在空气中燃烧的现象作比较。
主要实验现象:硫在空气中燃烧,产生微弱的淡蓝色火焰,并产生白色酸雾;硫在氧气中燃烧得更旺,产生蓝紫色火焰,若打开止水夹 A㊣可闻到带刺激性气味的气体产生。
A㊣可闻到带刺激性气味的气体产生。
(四)设计意义
(1)封闭环保。整个实验在一个全封闭式实验装置中进行,防止生成的二氧化硫逸出,以免污染空气,且装置中盛有适量的氢氧化钠溶液可吸收生成的二氧化硫气体。融入绿色化学理念,增强学生的环保意识。
(2)对比性强。在一个全封闭式实验装置中,在较短的时间差范围内,比较硫在空气和氧气中燃烧的现象,对比科学,现象明显,比较优势和集成优势突出。
(3)趣味性强。装置图中氢氧化钠溶液上方的两只小船,宛如行驶在洞庭湖上的两艘渔舟,给实验增添了生机和趣味,能有效激发学生的学习兴趣和求知欲望,培养学生实验创新能力和自主合作精神。
四、焰色反应比较实验设计
(一)设计目的
“焰色反应”在中学化学教材,大学《无机化学》《基础化学》中都有相关介绍,《普通高中课程标准实验教科书化学(必修1)》(人民教育出版社,2007年3月第3版)第三章第二节(几种重要的金属化合物)第57页[实验3-6]“金属的焰色反应”,分两次操作7项对比实验,探究金属及其化合物的焰色反应,不少教师在教学实践过程中都做过不同程度的改进,改进的实验方案曾被许多老师验证和借鉴过,具有一定教学价值。
(二)喷雾式实验比较设计
1.实验用品
酒精灯1个,小喷雾试剂瓶(一般用废旧喷雾式化妆瓶代替)3~5个,火柴1盒;碳酸钠、碳酸钾、硫酸铜、氯化钡等溶液。
2.设计装置图
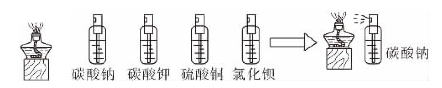
图4.5 设计装置
3.实验操作
按如图4.5所示装置,用右手握住盛碳酸钠、碳酸钾、硫酸铜、氯化钡等溶液的小喷雾试剂瓶,分别向燃着的酒精灯喷雾,就能观察到明显的、不同的焰色现象。
4.设计意义
(1)简化操作。该喷雾式焰色反应实验的改进步骤少,操作简单,演示者可在学生中来回走动,便于学生观察焰色反应的现象。
(2)特色优势。将溶液雾化使焰色反应现象更加直观、明显、有趣味、环保,彰显了比较优势,富有艺术特色,培养了学生的创新能力。
(3)融入辩证观。实验的改进融入动与静、质与量、宏观与微观等辩证观,培养了学生逆向思考、比较思考的能力。
(三)动静式实验比较设计
1.实验用品
酒精灯1个,铁架台(带铁夹)1套,坩埚钳1个,胶头滴管1~4支,长约30cm的铁丝1根,火柴1盒,棉花若干;碳酸钠、碳酸钾、硫酸铜、氯化钡等溶液,无水酒精。
2.设计装置图

图4.6 设计装置
3.实验操作
(1)铁丝移动法[图4.6(a)]:用1根长约30cm的铁丝串上4个棉球,先在4个棉球上分别滴加碳酸钠、碳酸钾、硫酸铜、氯化钡4种溶液,再用坩埚钳夹住铁丝一端,在酒精灯上分别灼烧,就能观察到明显的、不同的焰色现象。
(2)酒精灯移动法[图4.6(b)]:先分别在铁丝上串的4个棉球上除了滴加碳酸钠、碳酸钾、硫酸铜、氯化钡4种溶液(浓度稍大一点)外,再滴加无水酒精,把铁丝一端固定在铁架台上,用酒精灯同时点燃4个棉球,观察不同的焰色现象。
4.设计意义
(1)优势突出。简化焰色反应操作步骤,突出不同金属及其化合物的焰色反应现象的直观性,彰显实验改进的比较优势,培养学生的创新能力。
(2)融入辩证观。通过“铁丝移动法”和“酒精灯移动法”两种方式,改进焰色反应实验,融入运动和静止的相对性,加强了学生的辩证观,培养了学生自主合作和比较的学习方法和习惯,提高学生的哲学思维能力和团队精神。
五、交替式丁达尔效应比较实验设计
(一)设计目的
针对《普通高中课程标准实验教科书化学(必修1)》(人民教育出版社,2007年3月第3版)第二章第一节(物质的分类)第26~27页[科学探究]“胶体的丁达尔效应”,许多老师都进行了不同程度的改进,且采用溶液胶(如氢氧化铁胶体)来展示,笔者认为该实验对比性不强,学生对现象的观察和知识的理解存在一定的困难。为此,笔者通过教学实践,根据胶体及丁达尔效应的原理,设计微型柱状集成交替式丁达尔效应比较实验。
(二)实验设计
1.实验用品
大试管(或大玻璃管)1支,激光笔1支,青霉素瓶6个,试管夹1个;氢氧化铁胶体,牛奶,彩色果冻,氯化铁溶液,硫酸铜溶液,食盐水。
2.设计装置图

图4.7 设计装置
(三)实验操作
如图4.7所示,分别向6个青霉素瓶中加入氢氧化铁胶体、牛奶、彩色果冻、氯化铁溶液、硫酸铜溶液、食盐水,用试管夹把6个青霉素瓶夹持到大试管中,按实验设计装置图组装仪器后,再用激光笔从上向下照射玻璃柱,观察各青霉素瓶中物质的丁达尔效应。
(四)设计意义
(1)比较优势。整合的实验装置简单,取材容易,对比现象明显,集中比较不同胶体的丁达尔效应,突出现象的直观性和对比性。
(2)方法能力。融入绿色教育理念和环境保护意识,有利于提高学生利用废旧资源的水平和解决实际问题的能力,激发学生学习兴趣,掌握比较学习方法,培养学生整体思维和创新能力。
六、碳酸钠和碳酸氢钠比较实验设计
(一)设计目的
针对《普通高中课程标准实验教科书化学(必修1)》(人民教育出版社,2007年3月第3版)第三章第二节第56页[科学探究]“碳酸钠和碳酸氢钠的热稳定性”实验,分两次操作验证碳酸钠和碳酸氢钠的热稳定性比较烦琐,操作步骤多,现象不明显,且热稳定性现象的对比不在同一时间、同一空间、同一环境条件下进行,学生对实验设计和碳酸钠、碳酸氢钠的性质缺乏科学的认知。为此,笔者以“碳酸钠和碳酸氢钠的性质实验”为切入点,对碳酸钠和碳酸氢钠的热稳定性实验进行重新设计,以达到对比科学、现象直观、掌握方法、提高素养、调动学生内在学习与发展动机的目的,培养学生可持续学习的能力。
(二)设计方案一
1.实验用品
500mL烧杯1个,小试管2支,带橡胶塞的玻璃管2支;碳酸钠,碳酸氢钠,热水,无水酒精。
2.设计装置图

图4.8 设计装置
3.实验操作
按图4.8(b)连接好装置,可以观察到右边装碳酸氢钠的试管中有气体生成,若将一个用澄清石灰水润湿的小烧杯罩在玻璃管上方,可以看到澄清石灰水变浑浊。与左边装碳酸钠的试管进行比较,观察现象及时差,并做好有关记录。
4.设计意义
(1)比较优势突出。简化装置和操作步骤,缩短反应时间,比较现象明显,具有较强的对比性、直观性和可操作性,能有效培养学生的科学素养和创新能力。
(2)融入绿色理念。竖直玻璃管起冷凝回流作用,防止酒精挥发;药品用量少,碳酸钠、碳酸氢钠可回收再利用,无水酒精可循环利用;加之半闭合式操作,有利于培养学生保护环境、节约能源的意识。
(3)融入量变理念。改进后的实验可以从产生的气泡量的多少,直观感知反应程度和反应速度,从而推断碳酸钠和碳酸氢钠的热稳定性,掌握自主学习、合作学习和比较学习的方法,调动学生内在学习与发展动机,激发学生创新意识,培养学生可持续学习的能力。
(三)设计方案二
1.设计装置图


图4.9 设计装置
2.实验操作
改进实验1。按图4.9(b)连接好装置,检查装置气密性。点燃酒精灯,加热,观察干燥管里的白色硫酸铜的变色情况。注意观察比较硫酸铜是否变蓝与澄清石灰水是否变浑浊及其时差,并做好有关记录。
改进实验2。按图4.9(c)连接好装置,检查气密性。打开三个活塞,观察两个分液漏斗中液面高度的变化,并做好有关记录。
3.设计意义
(1)设计科学。改进实验1和改进实验2比教材上的实验步骤少、操作简单、节约药品、鉴别速度快、完成时间短、比较现象明显,具有较强的准确性、趣味性、科学性、可操作性,能有效培养学生的科学素质和创新能力。
(2)优势明显。改进实验1颜色变化明显,结论科学;改进实验2反应程度和反应速度比较明显,融入量变理念,把微观物质转化为宏观现象,能定量反映出生成二氧化碳的体积关系。
七、电解比较实验设计
(一)设计目的
电解实验具有“实验数目多、所用器材多、操作步骤多、外界条件限制影响因素多”的特点,电解水、氯化铜溶液、饱和氯化钠溶液等实验,是大学《物理化学》《基础化学》的主要内容,更是初中化学、高中化学新课程教学的重点。受实验条件(如电源等)的限制,有时几乎无法进行实验。通过对大学《物理化学》《基础化学》及中学化学教材中的“电解实验”的共性的探讨,现提供一种“电解实验”方法供参考。以电解CuCl2溶液为例。
(二)实验设计
1.实验用品
烧杯1个,电流表1台,干电池1节;CuCl2溶液,润湿KI-淀粉溶液滤纸,润湿NaOH溶液滤纸。
2.设计装置图

图4.10 设计装置
(三)实验操作
按如图4.10所示实验装置图组装仪器。取一节干电池(最好是新的,且去掉铜帽露出碳极的)直接放入盛有CuCl2溶液的烧杯中,进行“电解实验”。不一会儿,在电解池的阴极区(即干电池的负极区)有红色的固体铜析出;同时,在电解池的阳极区(即干电池的正极区)有黄绿色气体生成,且生成的气体能使烧杯上方的下层润湿KI-淀粉溶液滤纸变成蓝色(证明生成的气体是Cl2)。
电解池的电极反应:
阳极:2Cl--2e- Cl2↑(氧化反应)
Cl2↑(氧化反应)
阴极:Cu2++2e- Cu↓(还原反应)
Cu↓(还原反应)
电解CuCl2溶液总的反应方程式:CuCl2 Cu+Cl2↑
Cu+Cl2↑
(四)设计意义
(1)可操作性强。采用干电池直接进行“电解实验”,取代了教材中的电源、导线、电极等实验用品。具有操作便捷、现象明显(如果先将溶液预热,效果会更好)、适用范围广、实验形式多、知识覆盖面大的优点,有利于培养学生动手动脑的能力,体现了化学就在身边、就在家里的特点。此外,还可进行电解水、饱和氯化钠溶液等实验。
(2)封闭环保。整个实验在一个半封闭式的实验装置中进行,烧杯上方的上层润湿NaOH溶液滤纸,能防止生成的Cl2逸出污染空气。同时干电池使用后清洗晾干,可以重复使用多次。能够有效激发学生的学习兴趣和求知欲,提高学生的环保意识,培养学生比较创新能力。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















