(一)实验目的与主要实验原理
双向电泳是利用蛋白质的等电点特性和分子量特性,对蛋白质分离的技术。通常先进行等电聚焦电泳(按照等电点分离),然后再进行SDS-PAGE(按照分子量大小分离),最后经染色得到蛋白质两维图谱。荧光差异显示-双向电泳技术是在双向电泳基础上发展起来的新技术,其通过对蛋白质进行荧光标记(Cy2,Cy3和Cy5),提高了检测的灵敏度。同时,它还使用了内参照的方法,提高了实验的准确度。
(二)实验材料
蛋白质裂解液,IPG buffer,24cm pH3-11NL胶条,聚丙烯酰胺凝胶等。
(三)实验步骤
1.蛋白质的提取及荧光标记 从-80℃冰箱中取出组织标本,用DIGE裂解液[30mmol/LTris,7mol/L尿素,2mol/L硫脲,4%(w/v)CHAPS,pH8.5]进行裂解。取出50μg的蛋白质,用裂解液补充体积至30μl,加入1μl工作液[工作液配方:1倍体积1mmol/L(Cy3或Cy5)+1.5倍体积的二甲基甲酰胺,浓度为400pmol/μl],避光冰浴30min,加入1μl10mmol/L赖氨酸终止反应,4℃10min,-80℃避光保存,内参标记:从每个样本中各取出25μg的蛋白质混合,用上述方法标记Cy2,每块胶上样50μg标记内参。上样方法:将1份内参,1个Cy3标记的标本,1个Cy5标记的标本混合后,进行双向电泳。
2.双向电泳 取出上述标记好的蛋白质,加入等体积的2×上样缓冲液[7mol/L尿素,2mol/L硫脲,2%(w/v)CHAPS,130mmol/LTT,1%IPG],冰浴15min,加入270μl水化液[7mol/L尿素,2mol/L硫脲,2%(w/v)CHAPS,65mmol/LDTT,0.5%IPG],总体积为450μl。
取24cmpH3~11非线性胶条,放入24cmIPG持胶槽中,加入上述配制好的混合液,上面覆盖液状石蜡防止蒸发。设置等电聚焦条件:30V12h,梯度升压到200V6h,梯度升压到500V3h,梯度升压到10000V1h,保持10000V6.4h(可以根据实际需要调整)。
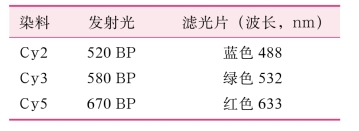
取出等电聚焦好的胶条,用平衡液A(50mmol/L Tris-HCl,pH8.8,6mol/L尿素,30%甘油,2%SDS,10mg/ml DTT)振荡平衡15min,再用平衡液B(25mg/ml碘乙酰胺代替DTT,其余成分不变)振荡平衡15min,然后将IPG胶条置于12.5%聚丙烯酰胺凝胶上,进行第二向SDS-PAGE电泳,采用26cm×20cm的12.5%的聚丙烯酰胺凝胶(表2-19),电泳参数为2W/gel1h;5W/gel过夜至溴酚蓝到底。取出电泳好的胶板,放入Typhoon扫描仪中,扫描参数如下:激发光Cy2488nm,Cy3532nm,Cy5633nm,PMT设定范围510~520nm(表2-20)。
表2-19 12.5%聚丙烯酰胺凝胶配制方法
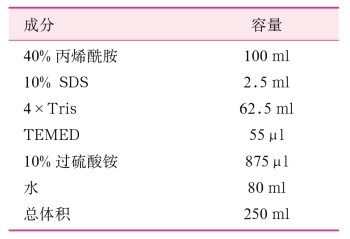
表2-20 DIGE结果扫描参数
3.分析差异表达蛋白质 利用分析软件(不同公司所配软件不同),找到差异蛋白质点。
(四)注意事项
1.用蛋白质裂解液裂解组织后,用pH试纸检测pH,为了保证后续的荧光标记,pH应在8.0~8.5,如果pH太低或太高,则需要用盐酸或氢氧化钠调整。
2.一定要使用高纯度二甲基甲酰胺(>99%),以保证荧光标记效果。
(五)主要问题及解决方法
1.为什么没有标记上荧光?
答:这可能与蛋白质溶液的pH以及二甲基甲酰胺的纯度有关,一定要保证蛋白质溶液的pH在8.5左右,并保证使用高纯度的二甲基甲酰胺。
2.为什么双向电泳时出现横向的条纹?
答:这与一相等电聚焦过程有关,可能与样品中盐浓度过高,等电聚焦条件不适合有关。解决方法:可以将蛋白质样品利用纯化试剂盒进行纯化,去除过多的盐分,后进行标记;同时调整等电聚焦的条件(可以增加时间),以达到最好的分离效果(注意:荧光染料非常昂贵,因此,必须先用不标记荧光染料的蛋白质进行双向电泳预实验,等条件成熟后,再实施荧光标记,开始正式实验)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。













