一、研究方法
(一)多倍化形态解剖学鉴定
1.形态观察及鉴定
与对照株相比,对形态上产生明显变异的百里香种子苗植株或组培苗,取基部起第3~5片叶,测量叶长、叶宽、叶形指数(叶形指数=叶长/叶宽),每个变异体测量4片叶,求平均值。用游标卡尺测量对照株、变异种子苗及变异组培苗从基部起第3~5节节间长度和茎粗,每个变异体测量3次,求平均值。
2.气孔观察及鉴定
选取外部形态变化明显的百里香种子苗和试管苗植株,取其基部成熟伸展叶片,用蒸馏水清洗干净叶片表面,然后在叶片的下表面均匀地涂上一层透明指甲油,晾干。取载玻片滴加蒸馏水,用镊子将晾干的指甲油膜从叶片上轻轻取下,展在载玻片上,加上盖玻片后于显微镜下观察。每个叶片随机选取20个视野,统计单位视野中的气孔大小以及气孔数目等。
3.解剖超微结构观察及鉴定
选取经形态学和气孔鉴别后的变异种子苗和组培苗,取其基部成熟伸展叶片,通过石蜡切片法制片并观察每个变异体10个切片的横切面结构,番红固绿染色。用Olympus BH.2光学显微镜在40倍镜下测量叶片厚度、栅栏组织及海绵组织厚度、细胞大小,求其平均值。
(二)细胞染色体鉴定
对气孔显著增大的百里香变异种子苗和组培苗,待其根尖长到0.3~0.8 cm时,于早上8:30左右取根尖置于装有浓度为0.10%的秋水仙素的1.5mL EP管中,在4 ℃条件下处理12 h,取出后用蒸馏水洗净,转入新鲜配制的卡诺氏固定液(V95%乙醇∶V冰醋酸=3∶1)中固定18~24 h,再用蒸馏水冲洗后转入70%的酒精中,4 ℃可长期保存。
(三)流式细胞仪检测
摘取未经过秋水仙素处理的二倍体百里香种子苗和组培苗及经过秋水仙素处理的多倍体百里香种子苗和组培苗的叶片,用水清洗干净后用流式细胞仪测定变异植株和正常二倍体植株细胞DNA的相对含量。
(四)统计分析
以上数据采用Excel 2003和SPSS 17.0分析软件进行统计和方差分析。
二、结果与分析
(一)百里香多倍化植株形态解剖学鉴定
1.秋水仙素种子诱导变异株形态学观测比较
由图1可以看出,与二倍体(CK)种子萌发苗相比,诱导变异株下胚轴生长缓慢,呈短粗状,子叶畸形、肥大、增厚,生长时常向下卷曲,叶片增厚,叶色较深,叶长、宽均增加,叶表面不光滑,茎粗,生长较好。从秋水仙素种子诱导变异植株中挑选出变异比较明显的10株(ZB1~ZB10)观测,由表1可知,随着倍性的增加,多倍化植株的叶长、叶宽、叶厚、茎节长以及茎粗均呈现增加的趋势,而叶形指数减小。由方差分析可知,在叶长、叶宽、叶厚、叶形指数、茎粗等方面,二倍体(CK)种子苗与多倍体种子苗之间均存在显著差异,而在茎节长度方面,除了ZB1与对照差异不显著外,其他各多倍化植株与对照均存在显著差异。采取生长良好的二倍体(CK)和变异体种子苗10 cm左右的茎段在基质(珍珠岩∶沙子=1∶1)中进行扦插,两周后二倍体植株生长、生根良好,较早萌发新叶,而部分变异体种子苗则生长一般、生根现象不明显,有较少新叶萌发现象,说明变异体与二倍体相比生长受到影响(图1A~E)。

图1 二倍体种子苗、组培苗和变异体种子苗、组培苗的形态特征比较
注:A为种子芽形态比较;B为种子苗叶片比较;C为正常种子苗;D为变异体种子苗;E为扦插生根比较;F为正常组培苗;G为变异体组培苗
表1 二倍体种子苗和变异体种子苗的形态特征比较
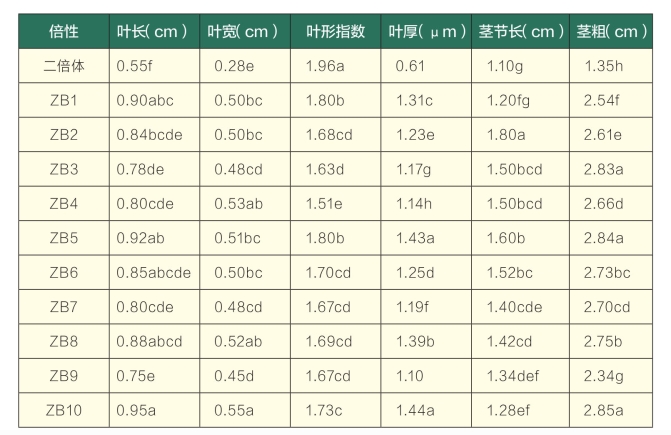
注:同列后不同小写字母表示在0.05水平存在差异
2.秋水仙素离体诱导变异株形态学观测比较
由表2可以看出,变异体百里香组培苗叶片与二倍体相比叶片长度、宽度、厚度、茎粗度均分别增加了0.06~0.20 cm、0.07~0.22 cm、0.584~1.356 cm、0.056~0.142 cm,变异体叶形指数减少了0.129~0.687,且差异性显著。变异体百里香组培苗比对照叶色浓绿,生长旺盛、健壮,茎秆粗壮;在正常分化培养基中培养20 d后,对照已生根且根多,但多倍化苗生根现象不明显(图1C、D)。
表2 二倍体组培苗和变异体组培苗的形态特征比较

(续表)

注:同列后不同小写字母表示在0.05水平存在差异
(二)诱变植株的显微形态观察
1.气孔鉴定
取正常生长苗以及变异体种子苗和组培苗的成熟叶片,用指甲油法进行叶片气孔鉴定,用光学显微镜于40倍镜下观察气孔的大小和数目。由图2可知,种子变异体ZB2、ZB3、ZB4、ZB5、ZB7气孔大小与二倍体对照相比没有明显差异,而ZB1、ZB6、ZB8、ZB9种子变异体气孔明显比二倍体对照大,且单位面积气孔数减少,保卫细胞的长度和宽度也明显比二倍体对照大。从表3可知,与二倍体对照相比,ZB1、ZB6、ZB8、ZB9种子变异体气孔长、宽分别增加了15.06%、15.06%、22.29%、33.13%和26.92%、8.65%、20.19%、26.92%,气孔数目分别减少了9~29个不等且差异显著。除了种子苗变异体ZB2、ZB3、ZB4、ZB5、ZB7气孔长度与二倍体对照差异不显著外,其他种子苗变异体气孔长度与二倍体对照均存在显著差异。而从气孔宽度来看,除了ZB4与二倍体之间差异不显著外,其他变异体与二倍体对照相比均存在显著差异。
由图3可知,与二倍体对照相比,组培苗变异体B1~B9的气孔长和宽明显变大,且单位面积气孔数减少,保卫细胞的长度和宽度也明显比二倍体大。同时从表4可知,与二倍体对照相比,组培苗变异株气孔长度显著增加,且比二倍体增大了21.68%~51.05%,保卫细胞长度也随之增加,气孔数目显著减少;气孔宽度除了B3、B6、B7差异不显著外,其他各变异体差异均显著。说明变异体宽度和长度的增加不呈正比。
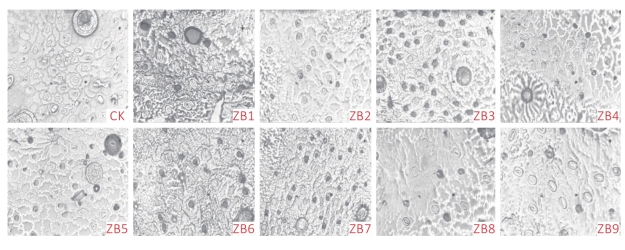
图2 二倍体和变异体种子苗气孔大小比较
注:CK为二倍体气孔;ZB1~ZB9为种子苗变异体气孔
表3 二倍体与变异体种子苗气孔特征比较

注:同列后不同小写字母表示在0.05水平存在差异
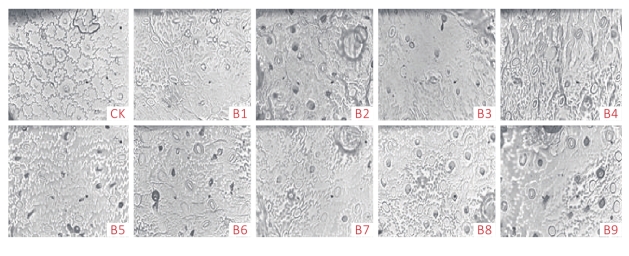
图3 二倍体和变异体组培苗气孔大小比较
注:CK为二倍体组培苗气孔;B1~B9为变异体组培苗气孔
表4 二倍体与变异体组培苗气孔特征比较

注:同列后不同小写字母表示在0.05水平存在差异
2.叶片显微形态鉴定
通过形态学鉴定和气孔鉴定后,筛选出变异较明显的种子苗和组培苗变异体,取其叶片,通过石蜡切片法进行叶片纵切面结构观察,观察并统计其叶片细胞结构与大小。由图4可知,与二倍体对照相比,组培苗和种子苗变异体叶片均增厚,栅栏组织和海绵组织均变大。由表5可知,组培苗变异体B8的叶片栅栏组织和海绵组织厚度增加得最多,分别为74.77%和78.09%;种子苗变异体ZB9叶片的栅栏组织和海绵组织分别比二倍体对照增加了60.36%和64.51%,但组培苗变异体B3和B7叶片栅栏组织的厚度与二倍体对照之间无显著差异,其他各变异体均存在显著差异;种子苗变异体ZB1、ZB6、ZB8、ZB9叶片的栅栏组织厚度与二倍体相比差异显著。与二倍体对照叶片相比,组培苗和种子苗变异体叶片的栅栏组织厚/海绵组织厚比值减少,且各变异体与二倍体对照之间均存在显著差异。变异体无论在叶片形态的大小、厚度方面,还是在栅栏组织厚度、海绵组织厚度上,均显著大于二倍体对照,明显表现出多倍体植株的巨大型特征。

图4 二倍体和变异体叶片结构比较
注:CK为二倍体叶片结构;B1~B9为组培苗变异体叶片结构;ZB1、ZB6、ZB8、ZB9为种子苗变异体叶片结构
表5 二倍体与变异体叶片结构特征比较
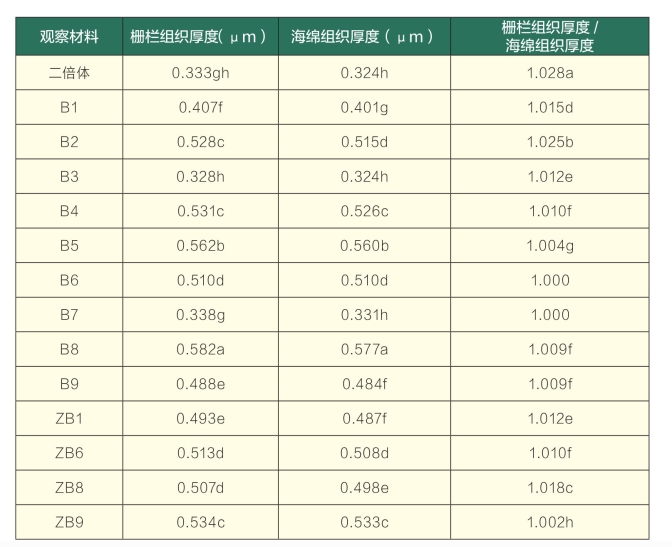
注:同列后不同小写字母表示在0.05水平存在差异
3.染色体计数鉴定
对通过前期形态学观察、气孔和石蜡切片法鉴定的多倍变异体B1、B2、B4、B5、B6、B8、B9、ZB1、ZB6、ZB8、ZB9,采用根尖染色体压片法进行染色体数目鉴定。结果表明(图5),ZB9为四倍体,ZB1、ZB6、ZB8均为非整倍体;组培苗变异体B2、B4、B5、B6为四倍体,B8为六倍体,且这些多倍化植株大多是采用秋水仙素培养基加入法对百里香丛芽诱导所得,主要是用浓度为0.05%的秋水仙素处理7 d和用浓度为0.01%的秋水仙素处理14 d获得的。百里香二倍体植株的染色体数为2n=2x=24,四倍体染色体数为2n=4x=48,六倍体染色体数为2n=6x=72,还有非整倍现象出现,染色体条数大多为34~48条。此外本研究还发现,存在同一根尖不同细胞染色体数有差异的现象。

图5 百里香二倍体、多倍体和非整倍体的染色体数
注:CK为二倍体染色体数;B1、B2、B4、B5、B6、B8、B9为组培苗变异体染色体数;ZB1、ZB6、ZB8、ZB9为种子苗变异体染色体数
(三)流式细胞仪鉴定
以百里香二倍体幼嫩的叶片材料为对照,对经过上述形态学鉴定、解剖学鉴定、染色体计数鉴定后的B1、B2、B4、B5、B6、B8、B9以及ZB1、ZB6、ZB8、ZB9多倍化苗的叶片,采用流式细胞测定技术进行细胞DNA含量的测定。DNA的含量分布曲线是由流式细胞仪中倍性分析仪自动测定和记录的。实验结果表明,对照二倍体百里香植株主峰荧光强度位于244,而变异株B2、B4、B5、B6、ZB9主峰荧光强度位于490,其值约为二倍体的2倍,即变异植株细胞DNA含量为对照植株的2倍,即为四倍体植株;其后还存在一个尾峰,荧光强度位于935,该值约为对照植株的4倍,但DNA含量较少,这是由于四倍体植株有些细胞正处于有丝分裂后期。经流式细胞仪测定可知,也有一些介于二倍体和四倍体之间的DNA含量的非整倍体植株,如B1、B9、ZB1、ZB6、ZB8。
三、讨论
早期的多倍化诱导植株研究一般采用形态学及气孔形态观测的方法来初步鉴别。如果要进一步鉴定,应用较多的是染色体压片计数法,此方法较为直接、准确,可为多倍体的鉴定提供最直接的证据。染色体计数通常采用根尖、茎尖和愈伤组织进行压片计数,此方法不仅可以鉴定出倍性,还可以鉴定出整倍性和非整倍性的变异,但此方法需要良好的实验室条件和经验丰富的技术人员,而且操作过程比较复杂,工作量较大。近年来,采用流式细胞仪计数法测定单细胞DNA含量作为鉴定多倍体的新手段得到了广泛的应用。此法测定供试材料比较广泛,只要是活组织即可,而且材料细胞核DNA的含量不受外部因素(如光密度、植株组织含水量)的影响。
本研究中对于初步鉴别出的变异植株进行流式细胞仪测定,鉴别二倍体百里香的DNA含量在244,四倍体植株的DNA含量在490,非整倍体植株的DNA含量在370左右,还出现了二倍体与四倍体的嵌合体。当然,流式细胞仪对变异体的检测也存在一些局限性,它不仅需要昂贵的仪器设备,而且还不能够对染色体的条数进行确定,其测出来的DNA含量只是相对于二倍体的变化。除此之外,有DNA含量的加倍现象我们仍不能简单地认为一定是染色体的数目增加了,即使有四倍体细胞的产生,也不能仅仅通过DNA含量的分布图来下结论,还需要对其进行细胞周期分析。
综上可知,在百里香多倍化诱导过程中,形态及气孔特征变异可作为多倍化植株筛选的初步鉴定指标,在初筛的基础上用流式细胞仪进行DNA含量的测定以及染色体计数的鉴定,可以较为准确地鉴别出染色体数目加倍的植株,并探明加倍植株的染色体数目。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















