一、研究方法
(一)试验材料及离体培养
试验材料采用田间百里香当年新发的半木质化茎段为外植体,经外植体诱导并继代获得整齐一致的组培苗。组培苗培养条件如下:将百里香新梢茎段接种在MS+6-BA(1mg/L)+ IBA(0.05mg/L)的基本培养基上进行初代培养,再采用如下配方:1/2MS+6-BA(2mg/L)+ IBA(0.2mg/L),附加6%的琼脂和25%的蔗糖,进行丛生芽诱导,进行3次增殖继代培养获得。pH在灭菌前调整到5.8,培养室温度为(25±2)℃,光照时间为12~14 h·d-1,光照强度为1400 lx。
(二)离体诱导方法
1.浸泡法
将配制的1.00%的秋水仙素溶液于超净工作台上过滤灭菌,然后用无菌水稀释成0.01%、0.02%、0.05%、0.10%和0.20%的秋水仙素溶液各100mL备用。
(1)在无菌条件下,将生长一致性较好的百里香丛生芽切割成含3~5个芽的丛芽(芽高1~1.5 cm),分别浸泡于浓度为0.00%、0.01%、0.02%、0.05%、0.10%和0.20%的秋水仙素溶液中,每一浓度再分为浸泡6 h、12 h、24 h;之后用无菌水冲洗4~6次,用滤纸(灭菌)吸干接种于1/2MS+6-BA(0.5mg/L)+ IBA(0.2mg/L)+ASA(1mg/L)培养基上,附加6%的琼脂和25%的蔗糖,每个处理3瓶,每瓶7个丛芽,处理完毕后,接入不含秋水仙素的相同培养基中进行培养。
(2)将生长一致性较好的百里香单苗剪成单个茎段,分别浸泡于浓度为0.00%、0.01%、0.02%、0.05%、0.10%和0.20%的秋水仙素溶液中,每一浓度再分别浸泡3 h、6 h、12 h、24 h;之后无菌水冲洗4~6次,用滤纸(灭菌)吸干接种于1/2MS+6-BA(0.1mg/L)+ IBA(0.2mg/L)+ASA(1mg/L)培养基上,附加6%的琼脂和25%的蔗糖,每个处理3瓶,每瓶7个茎段,处理完毕后,接入不含秋水仙素的相同培养基中进行培养。
对以上浸泡法处理的外植体培养30 d后,统计死亡率[死亡率=(死亡苗数/接种苗数)×100%]、变异率[变异率=(变异苗数/接种苗数)×100%]以及生长状况。
2.培养基添加法
(1)选择含3~5个高为1~1.5 cm、生长一致性较好的丛芽接种到秋水仙素浓度分别为0.00%、0.01%、0.02%、0.05%、0.10%和0.20%的固体培养基1/2MS+6-BA(0.5mg/L)+ IBA(0.2mg/L)+ASA(1mg/L)中,附加6%的琼脂和25%的蔗糖,分别处理7 d和14 d,每个处理3瓶,每瓶7个丛芽,处理完毕后,转接到不含秋水仙素的培养基中进行培养。培养30 d后统计死亡率[死亡率=(死亡苗数/接种苗数)×100%],变异率[变异率=(变异苗数/接种苗数)×100%]、增殖率[增殖率=(增殖芽数/接种苗数)×100%]以及生长状况。
(2)将生长一致性较好的百里香单苗剪成单个茎段,接种到秋水仙素浓度分别为0.00%、0.01%、0.02%、0.05%、0.10%和0.20%的固体培养基1/2MS+6-BA(0.1mg/L)+ IBA(0.2mg/L)+ASA(1mg/L)中,附加6%的琼脂和25%的蔗糖,分别处理7 d和14 d,每个处理3瓶,每瓶7个茎段,处理完毕后转接到不含秋水仙素的培养基中进行培养。培养30 d后统计死亡率[死亡率=(死亡苗数/接种苗数)×100%],变异率[变异率=(变异苗数/接种苗数)×100%]、增殖率[增殖率=(增殖芽数/接种苗数)×100%]以及生长状况。
3.统计分析
对以上数据采用Excel 2003和SPSS 17.0分析软件进行统计和方差分析。
二、结果与分析
(一)秋水仙素培养基加入法对离体百里香多倍化诱导效果的比较
1.秋水仙素培养基加入法对离体百里香丛芽生长效果的影响
各处理的百里香丛芽在正常分化培养基中培养15 d后与对照相比发现,处理过的大部分丛芽变粗、叶片变宽、畸形(图1)。随着处理浓度的增加,丛芽受秋水仙素毒害的程度越来越严重,死亡率呈上升趋势。秋水仙素处理7 d的各浓度中,在浓度为0.10%和0.20%的处理中出现丛芽死亡现象。而在处理14 d的各浓度中,浓度在0.01%~0.20%的处理中均有丛芽不同程度的死亡。在附加0.20%的秋水仙素处理14 d的培养基中出现丛芽全部死亡的现象。在试验过程中还发现,秋水仙素对百里香丛芽的生长均产生不同程度的抑制,主要表现为丛芽增殖率降低、生长缓慢,相同时间内对照的丛芽增殖明显,最高为88.57%。处理过的丛芽分化较少,而且随着秋水仙素浓度和处理时间的增加,分化的芽最终趋于褐化死亡。由方差分析可知,与对照相比,各处理的增殖率和死亡率均存在显著差异(表1、表2)。

图1 秋水仙素处理后丛芽转入正常分化培养基的生长情况
注:CK1、1~5、CK3、a~e为秋水仙素处理后接入正常分化培养基0 d的情况;CK2、6~10、CK4、A~E为秋水仙素处理后接入正常分化培养基15 d的生长的情况
表1 秋水仙素培养基加入法对离体百里香丛芽生长效果的影响
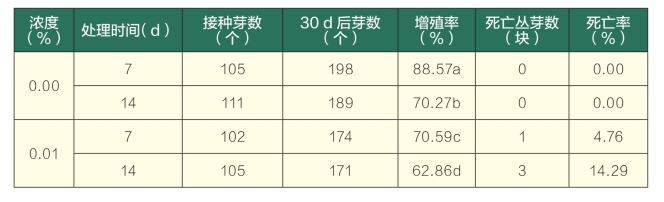
(续表)

注:同列后不同小写字母表示在0.05水平存在差异
表2 秋水仙素培养基加入法对百里香丛芽的诱导效果
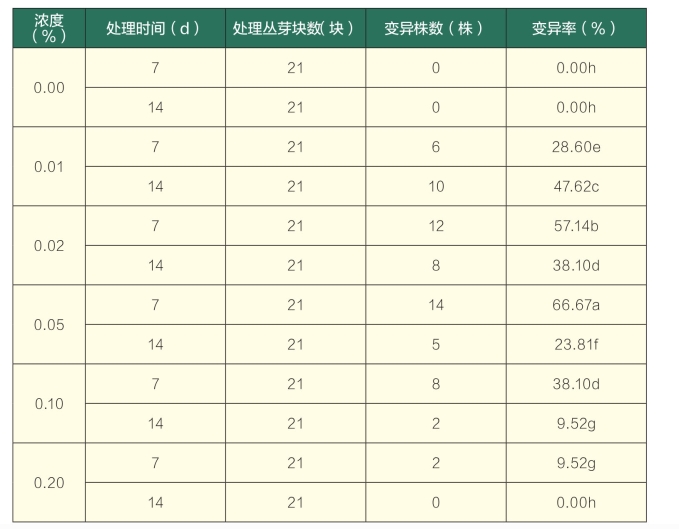
注:同列后不同小写字母表示在0.05水平存在差异
2.秋水仙素培养基加入法对离体百里香茎段生长及诱导效果的影响
试验表明,经过秋水仙素分别处理1周的茎段转入正常分化培养基培养15 d后,对照生长较快。在秋水仙素浓度为0.01%时,茎段生长较慢,无明显变化;在浓度为0.02%时,有8个茎段出现多倍化现象,叶色变深,2个茎段褐化;在浓度为0.05%和0.10%时,有15个茎段出现多倍化现象,叶色变深,分别有8个和18个不同程度的褐化现象;而在浓度为0.20%时,几乎全部褐化。同时处理2周的茎段转入正常分化培养基后,在秋水仙素浓度为0.01%时,有10个茎段产生多倍化现象;在浓度为0.02%和0.05%时,分别有16个和6个茎段出现多倍化现象,6个和13个褐化现象;在浓度为0.10%和0.20%时,茎段出现大量褐化死亡的现象(图2),说明茎段受到了严重的毒害。由表3可知,随着秋水仙素浓度和处理时间的不断增加,增殖率逐渐降低,最低为0.00%,死亡率逐渐升高,最高为100.00%,且不同处理的增殖率和死亡率与对照均存在显著差异。
转入正常分化培养基30 d后统计茎段外植体的诱导效果,结果见表4。相同处理时间时,随着秋水仙素浓度的增加,外植体变异率先增加后降低;相同处理浓度时,随着处理时间的延长,外植体死亡率也逐渐增加。在浓度为0.01%和0.02%的处理中,均得到了较高的形态变异率。经方差分析可知,在秋水仙素处理浓度为0.01%和0.10%,处理时间为7 d时,增殖率和死亡率与对照均具有显著差异,其中浓度为0.01%、处理时间为7 d时,死亡率较低(23.81%),形态变异率为38.09%;浓度为0.01%、处理时间为14 d时,死亡率略高于处理时间为7 d的28.57%,但形态变异率较高(47.62%),综合考虑,秋水仙素浓度0.01%,处理时间14 d为茎段最佳诱导组合。
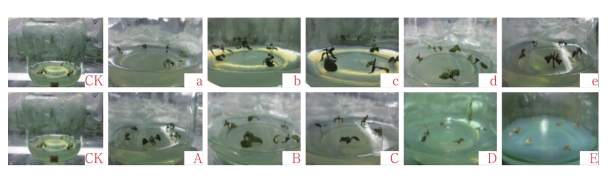
图2 处理后茎段转入正常分化培养基2周的生长情况
注:a~e处理时间为7 d;A~E处理时间为14 d
表3 秋水仙素培养基加入法对离体百里香茎段生长效果的影响
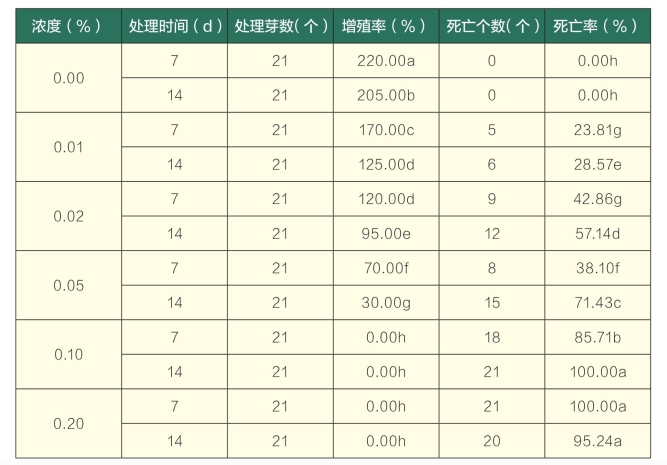
注:同列后不同小写字母表示在0.05水平存在差异
表4 秋水仙素培养基加入法对百里香茎段的诱导效果
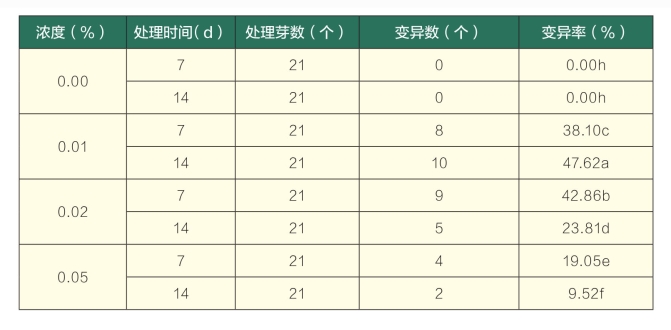
(续表)
注:同列后不同小写字母表示在0.05水平存在差异
(二)秋水仙素浸泡法对百里香组培苗的诱导
1.浸泡法不同处理对百里香丛芽生长及诱导的影响
将秋水仙素浸泡处理的丛芽转接入正常分化培养基上10 d和20 d后,丛芽出现不同程度的玻璃化现象,随着处理时间的延长,玻璃化程度增强,丛芽受毒害程度也越严重。在秋水仙素浸泡处理6 h,处理浓度为0.10%和0.20%时,出现了丛芽褐化死亡的现象。在秋水仙素浸泡处理时间为12 h和24 h时,各浓度处理下均出现外植体死亡现象,且玻璃化苗数量明显增加。(图3、图4)。
转接后30 d,秋水仙素不同浓度、不同浸泡时间对百里香丛芽的诱导情况见表5。百里香丛芽的死亡率在相同浓度的秋水仙素处理下,随处理时间的增长呈升高趋势,在相同处理时间下,随处理浓度的升高,其死亡率也呈升高的趋势,表明秋水仙素浓度越高、处理时间越长对百里香丛芽毒害越大,在浓度为0.20%的秋水仙素处理24 h时,死亡率达到最高,为57.10%。
从形态变异率可知,随着秋水仙素处理浓度和时间的延长,百里香丛芽的变异率均先升高后降低,即随着秋水仙素浓度和时间的不断增加,其诱变效果不一定提高。0.05%的秋水仙素溶液对百里香不定芽块浸泡处理12 h的变异率最高(38.10%),为最佳处理。外植体死亡率方差分析结果表明,24 h的对照与6 h、12 h存在显著差异,说明长时间的浸泡对于材料死亡率的影响也具有显著性。

图3 不同浓度、不同浸泡时间处理后外植体培养10 d的生长情况
注:CK1,1~5为不同浓度秋水仙素浸泡处理6 h;CK2,6~10为不同浓度秋水仙素浸泡处理12 h;CK3,11~15为不同浓度秋水仙素浸泡处理24 h

图4 不同浓度、不同浸泡时间处理后外植体培养20 d的生长情况
注:CK1,1~5为不同浓度秋水仙素浸泡处理6 h;CK2,6~10为不同浓度秋水仙素浸泡处理12 h;CK3,11~15为不同浓度秋水仙素浸泡处理24 h
表5 秋水仙素溶液浸泡法对百里香丛芽的诱导效果

注:同列后不同小写字母表示在0.05水平存在差异
2.浸泡法不同处理对百里香茎段生长及诱导的影响
由表6、图5可知,各对照生长速度较快、生长状态良好、平均株高较高。但随着浸泡时间的延长,对照生长也会受到一定的影响,长时间的浸泡会导致植物代谢失调,容易出现玻璃化现象。随着秋水仙素浓度和处理时间的增加,茎段生长受到的抑制作用越来越严重,高浓度、长时间处理后的茎段几乎没有生长;外植体经过较高浓度、较长时间秋水仙素浸泡处理后,出现大量的玻璃化及褐化现象,且死亡率最高达71.00%。在研究中还发现,把处理过的材料转接入正常分化培养基中7 d后,随着秋水仙素处理浓度和时间的增加,茎段产生的小苗叶片出现变大、变宽、增厚的现象,同时茎变粗,且浓度越大、处理时间越长,变异越明显。
由表7可以看出,随着秋水仙素浓度的增加和处理时间的延长,处理材料的死亡率越来越高,在浓度为0.20%、处理时间为24 h时,达到了最大值71.00%。在处理浓度为0.01%和0.02%时,随着浸泡时间的延长,变异率逐渐升高;在浓度为0.05%和0.10%时,随着处理时间的增加,变异率先升高后降低;在处理浓度为0.20%时,随着处理时间的增加,变异率呈现降低趋势。说明秋水仙素对于茎段的毒害作用较大,当浓度达到0.20%时,就会导致材料大量死亡,从而降低了材料的变异率。从形态变异率方差分析中可知,处理浓度为0.01%,处理时间为3 h、6 h、12 h时与对照无显著差异,其他各处理均存在显著差异。茎段的最佳处理为:秋水仙素浓度为0.10%,处理时间为6 h,该条件下可得到最高形态变异率(52.38%)。

图5 不同浓度、不同浸泡时间处理对百里香茎段生长的影响
注:CK1,1~5为不同浓度秋水仙素浸泡处理3 h;CK2,6~10为不同浓度秋水仙素浸泡处理6 h;CK3,11~15为不同浓度秋水仙素浸泡处理12 h;CK4,16~20为不同浓度秋水仙素浸泡处理24 h
表6 浸泡法不同处理对百里香茎段生长的影响
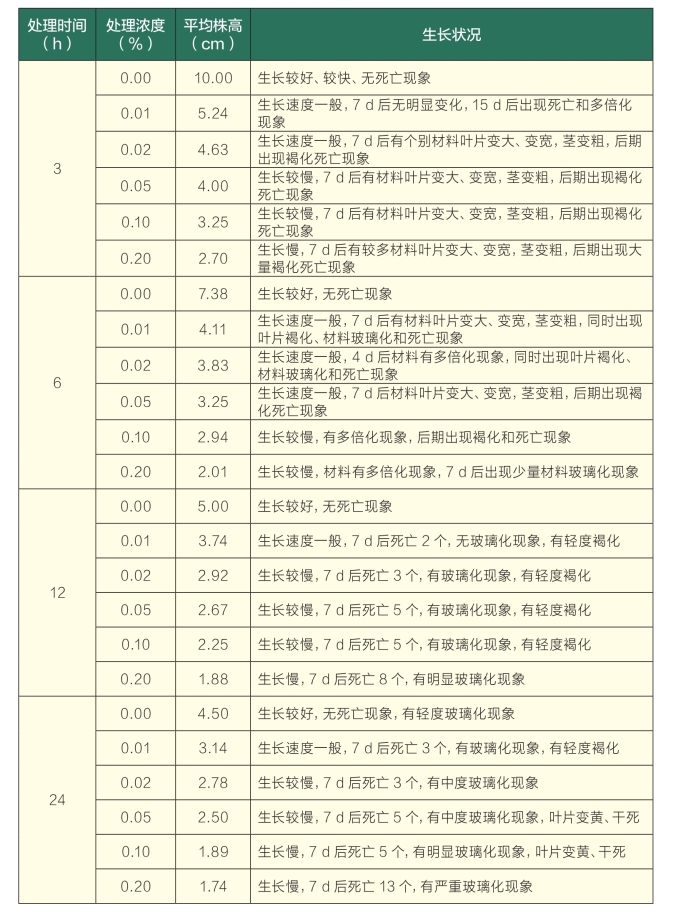
表7 秋水仙素溶液浸泡法对百里香茎段的诱导效果

注:同列后不同小写字母表示在0.05水平存在差异
三、结果与讨论
(一)秋水仙素诱导百里香多倍体方法的探讨
秋水仙素是目前多倍体育种中应用最广泛的化学试剂之一,其之所以能够诱导植物多倍体产生,是因为在有丝分裂过程中,它可以与微管蛋白二聚体结合,从而阻止微管和纺锤丝的形成。秋水仙素诱导多倍体常用的方法有浸泡法、滴液法、脱脂棉法、注射法、喷雾法和组织培养基诱导法等。不同植物材料及同种植物不同部位对其敏感度均不同,故秋水仙素浓度及处理时间成为诱导多倍体成败的关键因素之一。
离体条件下,在秋水仙素培养基加入法中,丛芽的诱导效果优于茎段,相同浓度下秋水仙素对于茎段的毒害作用大于丛芽,导致茎段诱导过程中出现了大量的死亡。而在秋水仙素浸泡法中,茎段的诱导优于丛芽。茎段的形态变异率高于丛芽,可能是由于秋水仙素对茎段伤口的直接作用所导致;另一方面,丛芽诱导出的多倍化植株与茎段相比在分化培养的过程中多倍化形态较不稳定,培养一段时间后,还会出现多倍化消失的现象。本研究表明,离体条件下百里香多倍体的诱导效果较好,并且从诱导的变异体得到了四倍体(2n=4x=48),以及少数六倍体和非整倍体。
组织培养在多倍体育种中表现出了特殊的作用,一方面不仅可以提高多倍体的诱变率、成活率以及繁殖系数,效果稳定、快速,且能够从多倍体的诱导到变异植株的分离以及最后多倍体的鉴定过程形成一个完整的体系;另一方面,组织培养能够使各类细胞得以生存、不被淘汰,为下一步研究提供材料,而且对于嵌合体可在此基础上进行二次诱导加以分离,以提高多倍体的诱导效率等。
(二)秋水仙素不同浓度、不同处理时间对百里香多倍化诱导的影响
秋水仙素剧毒,对处理材料具有一定的毒害作用,不同材料以及同一材料的不同部位对于秋水仙素的毒害作用反应不同。因此需要进行试验来确认所处理材料对于秋水仙素的敏感程度,以确定秋水仙素的有效浓度范围。一般认为秋水仙素的使用浓度为0.01%~0.40%,浓度高时处理时间应短,浓度低时处理时间应长。
通过秋水仙素诱导结合组织培养技术,对百里香丛芽及茎段进行了不同方法的诱导,在秋水仙素浸泡处理丛芽的过程中发现,百里香丛芽在转接前已出现了不同程度的被毒害现象,转接入增殖培养基10 d后毒害较轻的丛芽逐渐正常生长,毒害较严重的丛芽死亡。加入培养基法中,百里香丛芽转接入增殖培养基10 d后出现了死亡现象,随着培养时间的延长死亡率也逐渐增加,总体来说加入培养基法后期对丛芽的毒害性较大。可能是由于丛芽在浸泡的过程中虽受到秋水仙素的直接毒害但对秋水仙素的吸收较少,故在后期培养中毒害较轻的丛芽可以排除毒性正常生长,而丛芽在加入培养基法的处理过程中虽没有出现毒害现象,但在后期培养的过程中随着培养时间的延长,毒害现象越来越明显。在秋水仙素相同浓度和处理时间下,茎段受到毒害的程度较丛芽严重,死亡率较高,即茎段对于秋水仙素的毒害作用比丛芽敏感,但低浓度下茎段的诱导效果比丛芽好,故用茎段进行离体多倍体诱导时,秋水仙素浓度以及处理时间应该相应地降低。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















