物理学家和化学家们把已知的非共价相互作用分为四种:氢键(hydrogen bonds)、范德华相互作用(Van der Waals intereaction)、离子键(ionic bonds,又被称为盐桥,salt bridges)以及疏水相互作用(hydrophobic intereaction)。
1.氢键 当一个与电负原子共价相连的氢原子(如蛋白质分子中的-NH-,-NH+-,-NH+3-,-OH-,-NH2-等),碰巧与另一个电负原子(如-C=O,-COO-等)处于短距离接触的时候,这两个非共价连接的电负原子将都与该氢原子发生静电类型的相互作用(该氢原子带有部分正电性)。这里与氢原子共价连接的电负原子为氢原子的提供者,而另一个电负原子为氢的接受者。氢原子之所以具有这种“脚踏两只船”的主要“资本”是:它体积很小,而且带有相当量的(正)电荷。因为由两个电负原子核一个氢原子形成的氢键既存在共价键,又存在静电相互作用。所以,一般认为当3个原子处于同一直线上时,这种氢键是最强的。在观察到的折叠好蛋白质分子内部存在的氢键中,“直线型”氢键所占比例远高于其他类型的氢键。氢键对三级结构或折叠状态的总体稳定性有重要贡献,氢键可以在侧链之间形成,也可以在主链和侧链之间形成。
2.范德华相互作用 这是荷兰物理学家范德华(他因对气体和液体性质研究方面的突出贡献而被授予1910年的诺贝尔物理奖)在研究气体非理想行为时发现的一种存在于任何处于短距离接触的两个原子之间的一种非特异弱相互作用。如前所述,两个原子中心距离必须比它们的范德华半径之和稍微大一点点的时候才能够产生吸引力。如果距离比这近的话,会因为两个原子的电子云之间的重叠而产生一种巨大的排斥力;当距离比这远的话,吸引力会迅速下降。
如前所述,范德华力的本质也是静电相互作用,主要产生于以下几个方面的相互作用:两个永久性的偶极之间的吸引力;一个永久性和一个诱导出来的偶极之间的吸引力;两个相互诱导出来的偶极之间的吸引力。
3.离子键 这是存在于两个完全或部分带相反电荷的原子或基团之间的相互作用力。相对而言,这是三种非共价相互作用中最强的一种。主要发生在碱性氨基酸侧链、N-末端自由氨基酸、酸性氨基酸侧链及C-末端羧基等带电基团之间。在液体环境中,这些非共价弱相互作用一般比同样条件下肽链中的共价减弱30~300倍。换句话说,对于单个非共价键来说,在37℃时仅仅分子的热运动就使它断开。因此,如果要使两个表面,包括蛋白质分子内部的两个表面、一个蛋白质分子与另外一个蛋白质分子之间的两个表面、或者是一个蛋白质分子与另外一类分子之间的两个表面相互结合在一起的话,必须有很多个非共价键在两个表面之间同时存在才行。这样的两个表面我们说它们是互补的两个表面。
4.疏水相互作用 生物学家们认为,水分子为了减少疏水基团对水分子之间形成的氢键网的破坏作用会将肽链上的疏水基团挤压在一起,这种“力”被称为疏水相互作用。
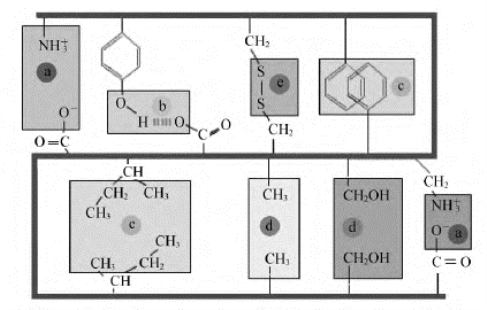
图8-13 蛋白质非共价相互作用的主要化学键
a.离子键(盐键);b.氢键;c.疏水键;d.Van der Waals力;e.二巯键
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















