根据物质可吸收某些波长的光谱鉴定物质的性质和含量的方法称为吸收光谱分析法,分为可见-紫外吸收光谱法、原子吸收光谱法和红外吸收光谱法。
(一)可见-紫外分光光度法
具有不同分子结构的物质对光谱有选择性吸收的特性,其吸收的光谱范围在可见光谱以内者主要为颜色的改变,故称为比色分析法。此外,利用物质对紫外线区或红外线区的选择性吸收的特性,对物质做定量分析者称为吸收分光光度法。可见和紫外吸收光谱是多原子分子的价电子在电磁辐射的作用下,发生跃迁而产生的分子吸收光谱。
1.分光光度法基本原理 不同的物质分子各有其特异的分子吸收光谱,被测物质溶液的吸光度或物质的摩尔吸光系数随投射于吸收溶液光线波长的不同而改变。如果在坐标图上记录各不同波长的吸收点,并连接各点成为吸收光谱,称为吸收曲线(图3-1)。曲线的形状和物质特性有关,故可作为物质定性鉴定的依据。根据物质吸收曲线的特性,选定适宜的波长,测量其吸光度,可对物质进行定量分析。如KMn O 4溶液对波长525nm附近绿色光的吸收最强,而对紫色光和红色光的吸收很弱,λmax=525nm。浓度不同时,光吸收曲线形状相同,λmax不变,吸光度不同。
物质吸光特性符合朗伯-比尔(Lambert-Beer)定律。当一束平行单色光照射有色溶液时,光的一部分被吸收,一部分被散射和反射,只有一部分透过溶液(图3-2)。

图3-1 高锰酸钾溶液的光吸收曲线
设入射光的强度为I 0,反射光强度为I R,吸收光强度为I A,透射光强度为I T,则
I 0=I R+I A+I T
在实际工作中,I R可通过运用适当的“空白”消除,因此,I 0=I A+I T。
透射光强度I T与入射光强度I 0之比称为透过度(T),常以百分数表示(T%),称为百分透光率。T= I T/I 0
透光度T的负对数称为吸光度(A),即A=-lg T =lg1/T=lg I 0/I T

图3-2 光的吸收
朗伯-比尔定律是描述溶液对光吸收的定律,是分光分析的理论基础,其表达式为
A=KLC
式中:A为吸光度;K为吸光系数;L为溶液层厚度,又称光径;C为溶液浓度。它表示一束单色光通过溶液时,溶液的吸光度与溶液的浓度和液层厚度的乘积成正比。
根据朗伯-比尔定律,当物质浓度为1mol/L和液层厚度为1cm时,在特定波长下物质的吸光系数称为摩尔吸光系数,用ε表示,单位为L/(mol·cm)。ε是物质的特征性常数,在固定条件下(入射光波长、温度等),特定物质的ε不变。当物质浓度以质量体积浓度(g/ml)表示时,吸光系数称为百分吸光系数,用e1%表示。
吸光系数越大,表示溶液对入射光越容易吸收,当C有微小变化,可使A有较大的改变,故测定的灵敏度较高。
2.分光光度分析的定性和定量方法
(1)定性方法:对待测物质进行定性分析,主要根据物质的最大吸收波长λmax和摩尔吸光系数ε。
λmax即最大吸收峰对应的波长,将不同波长的光透过待测溶液测定其吸光度,用波长和吸光度作图可找出待测物质的最大吸光度(吸收峰)的波长λmax。
ε的测定需配制浓度准确的待测物溶液,在最大吸收波长下测定吸光度,根据朗伯-比尔定律ε=A/L×C,可计算待测物的ε,与已知ε的标准液比较,可对待测物质进行定性分析。
(2)定量方法:分光光度法主要用于定量分析,几乎所有的无机离子和有机物都可以直接或间接的用此法进行定量分析。常见的可见-紫外分光光度法有:①标准曲线法。配制一系列不同浓度的待测物标准溶液,一般至少选5个等间距浓度,浓度范围在样品待测物浓度的0.5~2.0倍,吸光度范围在0.05~1.0较为合适,在与被测组分相同的最大吸收波长下测定各标准液的吸光度值,以吸光度为纵坐标,浓度为横坐标,连接各对应点,若符合朗伯-比尔定律,则各对应点可连成一直线,并通过原点。由此绘出的曲线称为标准曲线。在相同条件下处理待测物质并测定其吸光度,即可从标准曲线找出与吸光度相对应的浓度值,适用于大量样品检测。②对比法。通过与标准管比较算出待测物浓度。用已知浓度的标准液与待测液经相同条件处理,分别测定“标准管”和“待测管”的吸光度A S和A U,通过下式计算待测物浓度
C U=C S×A U/A S
式中:C S和C U分别为标准溶液和待测溶液的浓度。此法适用于浓度-吸光度曲线的线性较好,并且通过原点,为减少误差,使用的标准溶液尽可能与待测样品浓度接近。③差示法。有色溶液浓度太浓或太稀,透过度<10%或>90%时,即样品中待测物浓度过高或过低时,测定结果产生较大误差,此时可采用差示法。差示法是以一个浓度与样品溶液接近的标准溶液代替空白溶液作对比,根据测得吸光度计算待测物的含量。④多组分定量法。当试样中有两种或两种以上的组分共存时,可根据各组分吸收光谱的重叠程度,选用不同的定量方法。如果混合物各组分的吸收峰互不干扰,可按单组分的测定方法,选择测定波长,分别测定各组分的含量;若各组分的吸收峰相互重叠,可采用解线性方程组、双波长法等解决相互干扰的问题,从而确定各组分的浓度。
3.光谱分析技术的影响因素 根据朗伯-比尔定律,在相同条件下,被测物浓度和吸光度成正比,但在实际测定中,往往容易发生偏离直线的现象而产生误差,导致误差的主要原因有光学和化学两个方面。
(1)光学因素:朗伯-比尔定律要求入射光为单色光,在目前的分光条件下,所分出的单色光并不是严格的单色光,而是包括一定波长范围宽度的谱带,其他波长的杂色光是引起误差的主要原因。入射光的谱带越宽,其误差越大。
(2)化学因素:指被测物溶液不符合光吸收定律所引起的误差。①被测物浓度受有色物质的电离、水解、缔合等原因影响,当溶液稀释或增浓时,有色物质颜色的深浅并不按比例降低或增高,因而不完全符合光吸收定律。②溶液p H的影响。有些溶液的颜色对p H的改变十分敏感,因而溶液p H变化会产生误差,如溴甲酚绿法测定血清清蛋白。③杂质的影响。如被测物溶液中含有杂质,且这种杂质本身是有色的,或能与显色剂生成有色化合物或沉淀,或能与被测物质发生化学反应等,都会影响吸光度的变化。④放置时间的影响。某些有色物质能迅速生成,但不稳定,放置后色泽消退或起变化,而另一些有色物质须经过相当长的时间,反应才能完全,因此,若在不恰当的时间内进行比色,将会造成很大的误差。
此外,还有溶剂、温度、溶液体系的均匀性等都会引起测定误差。
4.下面介绍利用光谱分析技术原理制作吸收曲线
(1)原理:不同的物质分子各有其特异的分子吸收光谱。被测物质溶液的吸光度随投射于吸收溶液光线波长的不同而改变,通过722型分光光度计测定相应波长下各物质的吸光度并作图,分析各物质的最大吸收波长。
(2)器材与试剂
①器材:722型分光光度计1台、镨钕滤光片1片、方格坐标纸、50ml或100ml容量瓶、5ml、10ml吸管若干支。
②试剂
a.重铬酸钾标准贮存液(含铬量0.5g/L):精确称取重铬酸钾(K 2 Cr2 O7,AR)0.7072g,置于100ml烧杯中,用0.05mol/L硫酸溶解后移入500ml容量瓶中,再用0.05mol/L硫酸补足至500ml刻度,混匀,放棕色玻塞试剂瓶中贮存备用。
b.重铬酸钾标准应用液(含铬量分别为30mg/L、90mg/L、150mg/L、180mg/L):以吸管吸取重铬酸钾标准贮存液3.0ml、9.0ml、15.0ml、18.0ml,分别放入50ml容量瓶内,以0.05mol/L硫酸稀释至500ml刻度,混匀备用。
c.硫酸铜标准贮存液(含铜量20g/L):精确称取硫酸铜(CuSO4·5H 2 O,AR)39.295g,放入100ml烧杯中,加入0.05mol/L硫酸溶解后移置500ml容量瓶中,以0.05mol/L硫酸补足至500ml刻度,混匀,贮存于棕色玻塞瓶中备用。
d.硫酸铜标准应用液(含铜量分别为2g/L、4g/L、6g/L、8g/L):以吸管吸取硫酸铜标准贮存液5.0ml、10.0ml、15.0ml、20.0ml,分别放入50ml容量瓶中,以0.05mol/L硫酸稀释至50ml刻度,混匀备用。
e.0.05mol/L硫酸:用5ml吸管吸取浓硫酸(H 2 SO4,AR)1.4ml,缓缓加入约500ml蒸馏水中,然后移入1000ml容量瓶中,以蒸馏水补足至1 000ml刻度,置玻塞瓶中保存备用。
(3)操作
①配制标准应用液:取标准贮存液按上述配制要求,每人任选一个稀释度进行配制,但在本实验室组内,所配制浓度最好不要相同。
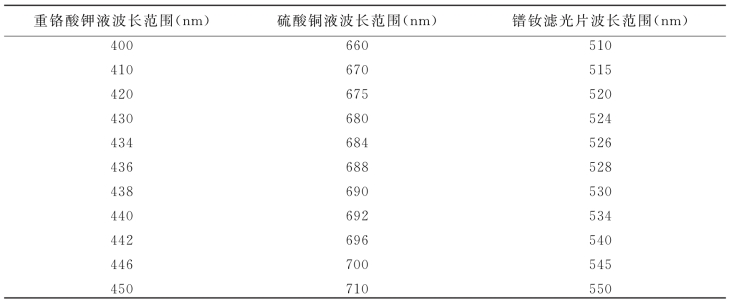
②波长测试:每人以自己所配制的标准应用液按下述要求,用722型分光光度计进行逐点测试,并记录测试透光率结果(表3-1)。
表3-1 规定波长范围及间距表
③绘图
a.取方格坐标纸,在X轴上标波长(每小格=2nm),在Y轴标透光率(每小格=1%T)。
b.将所测数据按相应波长点在图上。
c.连接各坐标点,即可得到某一标准物指定浓度的吸收曲线。
d.观察指定吸收峰波长(实测值)。
(二)原子吸收分光光度法
原子吸收分光光度法,即原子吸收光谱法,是基于元素所产生的原子蒸气中,待测元素的基态原子,对所发射的特征谱线的吸收作用进行定量分析的一种技术,使用的仪器为原子吸收分光光度计。
原子吸收分光光度法基本原理:当原子接收外界能量使其从基态激发成激发态,再从激发态返回基态时,将其从外界接收的能量以辐射的形式发射出来,此时发射的光谱谱线称为共振线。元素的结构不同,共振线也不同,并各具特性。原子吸收光谱分析就是测定被基态原子吸收共振线的程度进行定量分析。
原子吸收分光光度法具有灵敏度高、选择性好、操作简便、快速等优点,在医学检验中主要用于体液Ca、Mg、Al、Fe、Zn和Cu等多种金属元素的检测。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















