生物组织工程支架材料用于人体安全性的研究和对其生物学性能的评价在国内外早已引起了重视,自20世纪70年代起对生物组织工程支架材料及其制品的安全性检测方法的研究得到了加强,并建立了有关生物学性能的评价标准。20世纪80年代,国际标准化组织ISO、国际牙医联盟FDI和美国FDA制定了有关组织工程支架材料的生物学性能评价标准,英国、加拿大、日本、中国根据国情及以上文件制定了适合本国的具体实施标准。
我国自20世纪70年代后期开始研究医疗器械的生物学评价,基本上是跟国外同步展开这方面的研究的,目前生物学评价标准是通过细胞学、组织学和整体动物学来评价组织工程支架材料对生物体的影响,表7-1是我国国标中规定的生物学评价试验,该标准提供了生物组织工程支架材料的生物相容性评价的系统方法,规定了适当的生物学安全评价的最基本要求和所需试验及试验选择的基本原理。
表7-1 生物组织工程支架材料和医疗器材生物学评价试验(1997)
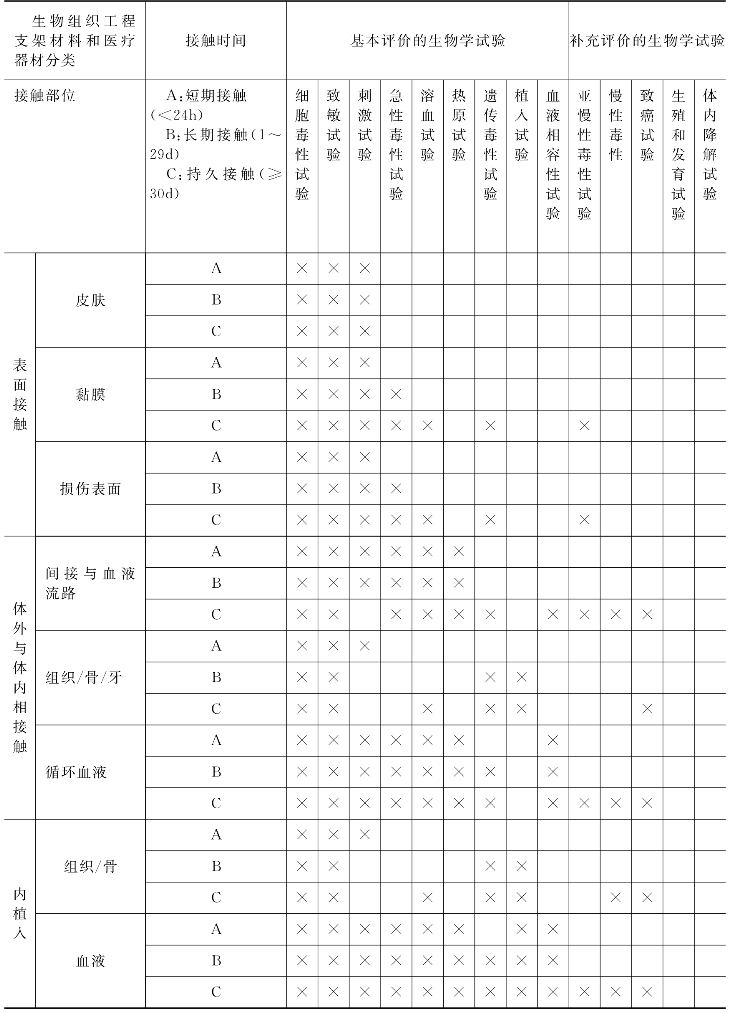
生物组织工程支架材料的生物学评价分为体外和体内试验两类,本节主要介绍常用的体外评价方法。
一、血液相容性试验
血液与组织工程支架材料接触,可能会有以下作用影响组织工程支架材料的性能:血液中的血红蛋白、类脂物、钙、血小板、白细胞、红细胞等被吸附到组织工程支架材料表面或被吸收,或者组织工程支架材料表面形成假膜或组织包囊。所以组织工程支架材料与血液的接触可能产生的不良反应有:血小板、白细胞或者其他细胞被激活或者凝血、纤维蛋白溶解、补体系统或者其他途径被激活;组织工程支架材料表面形成血栓;循环血细胞损伤导致贫血病、溶血、白细胞减少或者细胞功能改变等。所以在制订组织工程支架材料的测试方案时要考虑到组织工程支架材料与血液的相互作用、组织工程支架材料与体内接触的时间、部位等。
用于组织工程支架材料的血液相容性评价试验分为三类:体内、半体内和体外试验。ISO10993为血栓形成、凝血、血小板、血液学及免疫学五种类型试验提供了推荐和可选择的试验方法,本节主要介绍常用的体外试验方法,五种差异和其他因素可能会限制试验的直观性,所以体外试验应尽可能采用正常人血,采血后应该尽快试验,一般在4h内,血液性能会发生很大的变化。试验方案中应包括足够数量的试验和适当的对照试验,以使结果数据的评价具有统计意义。体外试验中应考虑的因素包括血细胞比容、抗凝剂、样本采集、样本年龄、供氧和pH值以及温度、试验与对照研究的顺序、表面积与体积之比和液体流动条件等。
(一)溶血试验
【试验目的】 本试验主要是检测组织工程支架材料对血液红细胞的溶血作用,测定红细胞溶解和血红蛋白游离的程度。
【试验组织工程支架材料】
(1)试样:试验组织工程支架材料5g,剪成5mm×25~30mm小条;
(2)稀释血:新鲜抗凝血或抗凝人血8ml,加生理盐水10ml稀释;
(3)阳性对照:蒸馏水10ml加稀释血0.2ml;
(4)阴性对照;生理盐水10ml加稀释血0.2ml。
【试验步骤】 将洁净试验组织工程支架材料用适量蒸馏水摇洗2次后,置于试管内,加入10ml蒸馏水,然后在37℃恒温箱中恒温30min。加入0.2ml稀释血,轻轻混匀,继续保温60min后,离心5min(750g)。吸取上清液至比色皿中,用分光光度计在545nm波长处测定吸光度。阳性对照和阴性对照(均不加入试验组织工程支架材料)操作同上。
溶血度用下列公式计算:
若组织工程支架材料的溶血率小于5%,则组织工程支架材料符合生物组织工程支架材料溶血试验要求,大于5%则显示组织工程支架材料有溶血作用。
(二)动态凝血时间试验
【试验目的】 动态观察实验组织工程支架材料对凝血时间的影响
【试验组织工程支架材料】
试样:将组织工程支架材料均匀、光滑地涂于烧杯底部中心,直径>2cm,涂后干燥保存。玻璃表面皿事先用10%甲基硅油硅化。
【试验步骤】 涂有组织工程支架材料的烧杯37℃恒温5min后,用微量针筒向组织工程支架材料中心注入0.2ml柠檬酸葡萄糖抗凝的血(ACD全血),恒温5min后,向血液中注入0.025mlCacl2水溶液(0.2mol/L),开动秒表记时,摇晃小烧杯1min,使Cacl2与血混合均匀,盖好烧杯再恒温设定时间后,取出烧杯,向烧杯中加入100ml蒸馏水,摇晃小烧杯10min,取上清液,用分光光度计测量血水在540nm波长处的吸光度,即烧杯中所剩余游离血红蛋白的光密度值(OD)。将测得数值绘制动态凝血时间曲线,曲线呈缓慢向下倾斜且经历时间长,表明抗凝血性能优,否则表示抗凝血性能劣。
(三)凝血酶原时间试验
【试验目的】 将组织工程支架材料涂敷于玻璃试管内壁,使组织工程支架材料与血液接触,判断组织工程支架材料对凝血酶原因子的激活所致的凝血时间的影响。
【试验组织工程支架材料】
(1)试样:将组织工程支架材料涂于10mm×100mm玻璃试管内壁,然后经环氧乙烷消毒。
(2)对照:玻璃试管和硅化的玻璃试管;新鲜兔血制备抗凝血浆;兔脑浸液。
【试验步骤】 试管内加入0.1ml抗凝血浆和0.1ml兔脑浸液,置于37℃恒温水箱中1~2min预温后,加入已经预温37℃的0.025mol/L氯化钙溶液0.1ml,同时开动秒表,立即摇动数次,将试管连续倾斜至出现凝块后,停止计时。此时为凝固时间。各试管及对照试管均取3次以上平均值。
如果涂敷有试验组织工程支架材料的试管与对照试管相比超出3s以上有意义。另外ISO10993还推荐了其他的相关方法:PTT(非激活)、PT、TT、血浆纤维蛋白原、FDP等,在此就不一一赘述了。
血小板在防止出血和形成血栓中起着关键的作用,血小板黏附也是血液相容性试验中经常遇到的一个指标。血小板的黏附、聚集都会引起血液中血小板的减少,血液中血小板的计数可由人工方法或者自动化仪器来进行测定,组织工程支架材料表面黏附的血小板通常用扫描电镜来观察其聚集状态,但是目前没有比较一致的试验方法,或者说目前所用的试验方法都存在一定的局限性,本文不再详细论述。
由于试验组织工程支架材料的用途、应用部位等不同,组织工程支架材料的血液相容性评价所采用的方法也具有不同的侧重点,其他如血浆复钙时间、血液保存试验、凝血时间试验等方法也经常被采用。
二、细胞毒性试验
细胞毒性试验定义为“用细胞培养方法进行毒理学风险评价”,细胞毒性是由于生物组织工程支架材料与细胞膜、细胞器(细胞线粒体或脂质体)、蛋白质合成、DNA合成和细胞周期、DNA顺序等方面相互作用而产生的,这样可以测定细胞的活性和死亡,以及对细胞功能和遗传毒性。
ISO10993制订的标准中通过三种形式进行评价:浸提液试验、直接接触试验和间接接触试验。
(一)浸提液试验
组织工程支架材料浸提液的制备是将组织工程支架材料浸入一浸提介质中(无血清哺乳动物细胞培养基或者带血清细胞培养基),于37℃恒温箱中放置不少于24h,组织工程支架材料表面积(或者重量)与浸提介质体积比为3~6cm2/ml(0.1~0.2g/ml)。
常规浸提液试验评价方法为细胞生长抑止法(MTT比色法)。
【试验目的】 将一定量的组织工程支架材料浸提液与培养细胞共同培养,以评价组织工程支架材料对细胞生长和增殖的影响,判断组织工程支架材料对细胞的潜在毒性作用。
【试验组织工程支架材料】 组织工程支架材料浸提液。
(1)细胞系:推荐使用L-929细胞,传代48~72h生长旺盛的细胞;
(2)MTT(四唑盐):浓度为5mg/ml溶于PBS中;
(3)培养基:Eagle’sMEM加入10%(V/ V)小牛血清;
(4)对照组:阴性对照和试剂对照按不同供试品而选择,阳性对照推荐使用64g/L苯酚溶液。
【试验步骤】 将细胞培养基配制1× 104个/ml细胞悬液分注于96孔塑料培养皿内,每孔100μl,每组每观察期至少8孔,置含5%(V/V)二氧化碳空气的37℃培养箱内培养24h。然后弃去原培养基,用PBS洗涤2次,试验组分别加入100μl 100%浸提液和含50%浸提液的新鲜培养液,对照组加入100μl相应的对照液,继续培养2d,4d和7d。各观察期,弃去培养皿中的浸提液和培养基,加入20μl/孔的MTT液,继续培养6h,吸去原液,加入150μl/孔二甲亚砜,振荡10min,在免疫酶标仪上以500nm波长测定吸光度,并计算细胞的相对增殖度(RGR)。
【毒性评定】 试验结果为0或1级为反应合格;试验结果为2级的应结合细胞形态分析,综合评价;试验结果为3~5级反应为不合格(表7-2)。
表7-2 反应分级标准

(二)直接接触试验
将一定量、密度均匀的细胞悬液移注于细胞培养皿内,轻轻转动培养皿使细胞均匀分散到器皿表面,根据培养基选择含或不含5%(V/V)二氧化碳空气的37℃培养箱内培养至单层近汇合。然后弃去培养皿中的培养基,加入新鲜的培养基,并在每只且皿中央放置一个试样,并防止组织工程支架材料的不必要移动给细胞造成的物理损伤。24、48、 72h后进行评价,测定细胞死亡、细胞生长抑止、蛋白总量及酶的释放等。这类方法在我国检测中应用较少。
(三)间接接触试验琼脂覆盖法
【试验目的】 本试验是为了评价生物组织工程支架材料可滤出成分的细胞毒性。
【试验组织工程支架材料】
(1)试验样品:制成表面积为100mm2边缘光滑整齐的圆片;
(2)细胞系:推荐使用L-929细胞,传代48~72h生长旺盛的细胞;
(3)培养基:Eagle’sMEM加入10%(V/V)小牛血清,以及30g/L、2倍Eagle’s琼脂培养基。
【试验步骤】 将细胞培养基配制3× 105个/ml细胞悬液分注于90mm直径的玻璃培养皿中,每皿10ml,轻轻转动培养皿,以使细胞均匀分散到培养皿的底部,然后置于含5%(V/V)二氧化碳空气的37℃培养箱内培养至单层近汇合。吸去原培养液,将混合的Eagle’s琼脂培养基沿壁加入10ml,并使其均匀分布在室温下凝固。中性红染色后1h内将一只阴性样品、一只阳性样品和两只相同试验组织工程支架材料对称放置在培养皿的琼脂表面,并轻轻加压使其与琼脂均匀接触。
【结果评定】 在白色背景下观察样品周围及样品下面脱色区范围。反应指标以R表示,R=Z/L,Z为区域指标,L为溶解指标(表7-3,表7-4)。
表7-3 区域指标的评判标准
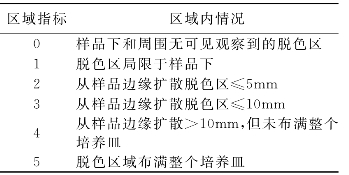
表7-4 溶解指标的评判标准

阴性对照样品的R应为0/0,阳性对照的R应达到2/2,否则该培养皿应弃之;如果一个指标的4个值仅丢失1个,则其他3个平均值可作为指标来报告;如果在同一个试验中,4个相同的样品指标值大小有2个或者2个单位以上的差异,其数值在0~3,应重复试验,如数值达到4~5,表示有高度弥散的毒性物质,则不必重复试验。
(四)间接接触实验——分子滤过法
【试验目的】 评价生物组织工程支架材料可浸出成分的细胞毒性。
【试验组织工程支架材料】 试验样品:制成直径约7mm的圆形薄片,小于3.5g;液体样品可用直径7mm的纤维素片吸取0.1ml样品放置在薄膜上;细胞系:L-929细胞或Hela细胞;培养基:Eagle’sMEM加入10%(V/V)小牛血清,以及30g/l、2倍Eagle’s琼脂培养基。
【试验步骤】 将细胞生长培养基配制1.5×105个/ml细胞悬液,移注于直径50mm培养皿中(6ml/皿),其中内含直径47mm、孔径0.45μm的分子滤膜,轻轻转动培养皿使细胞均匀分布在滤膜表面,然后置于含5%(V/V)二氧化碳空气的37℃培养箱内培养至近汇合单层。加5ml 40℃琼脂培养基于空白培养皿内,凝固后将滤膜的细胞面向下放在琼脂培养基表面,滤膜上放置3~5个样品。对照样品的操作方法相同。然后置于含5%(V/V)二氧化碳空气的37℃培养箱内继续培养2h。
移去试验样品,轻轻取下分子滤膜,用细胞化学方法(Barkla and Andersson 1963)来测定细胞琥珀酸脱氢酶的活性,37℃孵化3h,用蒸馏水洗涤,风干。
【结果观察与评定】 在显微镜下检查滤膜,含细胞的膜片上染色为深蓝色,细胞毒性评分标准见表7-5。
表7-5 细胞毒性评分标准

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















