一、概述
自然界的微生物在其生长过程中会产生一些具体有调节本身代谢和杀灭其他微生物作用的次级代谢产物,即现在被人类发现并广泛使用的抗菌药物。由于各种抗菌药物的广泛使用,各种微生物势必加强其防御能力,抵御抗菌药物的侵入,从而使微生物对抗菌药物的敏感性降低甚至消失,这是微生物的一种对环境的天然适应现象。细菌只要接触过某种抗菌药物就千方百计制造出能灭活抗菌药物的物质如产生各种灭活酶、钝化酶或改变本身代谢规律如结合蛋白构象、数量、活性的改变,使抗菌药物无法将其杀灭,这样就形成了细菌对抗菌药物的耐药性,使本来有效的抗菌药物对耐药菌引起的感染疗效下降或丧失。细菌耐药性能被多种因素放大和加速,尤其是大量使用抗菌药物时更易筛选出耐药菌株甚至超级耐药菌,称为细菌耐药“选择性压力”。
由于过去几十年间抗菌药物大量甚至过度使用,细菌耐药趋势有逐渐扩大和播散之势。监测数据显示,近年来我国医院内金黄色葡萄球菌中MRSA(耐甲氧西林金黄色葡萄球菌)的检出率高达70%(儿童大约40%),大肠埃希菌和肺炎克雷伯杆菌对第三代头孢菌素的耐药率超过50%,大肠埃希菌对氟喹诺酮类的耐药率约70%,不少ICU分离的鲍曼不动杆菌对碳青霉烯类的耐药率超过60%,甚至出现不少全耐药的鲍曼不动杆菌。从临床实践来看,目前多重耐药菌相关医院感染,极易导致重症肺炎、败血病治疗的失败。为遏制耐药菌感染,一方面应加强临床抗菌药物合理使用,另一方面应提高临床病原学诊断水平,采取切实可行的医院感染防控措施。
细菌耐药性可分为两类,即固有耐药性或称天然产生的耐药性和获得性耐药性。概括起来,细菌耐药性的产生机制包括产生灭活酶、改变靶部位、增加代谢拮抗物、改变通透性等。
二、细菌对儿童几类常用抗生素的耐药机制
(一)细菌对β-内酰胺类抗生素产生耐药性的作用机制
随着β-内酰胺类抗生素的广泛使用,对β-内酰胺类抗生素耐药的细菌越来越多,其耐药机制涉及以下4个途径。
1.细菌产生β-内酰胺酶
(1)β-内酰胺酶的分类:细菌耐药机制因革兰阳性菌和阴性菌的不同而有一定的差别,其中革兰阴性细菌产生的耐药主要通过β-内酰胺酶介导使β-内酰胺类抗生素开环失活。β-内酰胺酶是指细菌产生的能水解β-内酰胺类抗菌药物(即6-氨基青霉烷酸和7-氨基头孢烷酸及其N-酰基衍生物分子中β-内酰胺环酰胺键)的灭活酶,其早在β内酰胺类抗生素应用于临床前便已发现,它并不是细菌生长所必需的酶。革兰阳性菌的β-内酰胺酶分泌到细胞外,革兰阴性菌的β-内酰胺酶分泌到胞周间隙。有关β-内酰胺酶对β-内酰胺类抗生素的水解、开环的作用部位见图4-2。
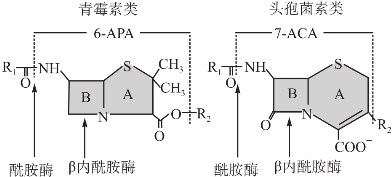
图4-2 β-内酰胺酶水解β-内酰胺环
β-内酰胺酶迄今为止报道的已超过300种,1995年Bush将β-内酰胺酶分为4型,其中重要者为第1型和第2型,β-内酰胺酶按分子结构、抑制特性及水解底物特征等进行分类,详见表4-1。
表4-1 β-内酰胺酶的分类

(2)Amp C酶:Amp C酶是Amp Cβ-内酰胺酶的简称,属β-内酰胺酶Bush功能分类法中的第1型,是由染色体或质粒介导产生,前者主要由阴沟肠杆菌、铜绿假单胞菌等产生,后者主要由肺炎克雷伯菌和大肠埃希菌产生。Amp C酶主要作用于大多数青霉素、第一、二、三代头孢菌素和单环类抗生素,不能被β-内酰胺酶抑制药所抑制,而第四代头孢菌素、碳青酶烯类不受该酶作用,临床上由产Amp C酶的耐药菌引起的感染死亡率很高。
AmpC酶根据产酶水平高低和AmpC基因表达方式不同可分为高诱导型、持续高产或去阻遏突变型、持续低产型和野生型,检测不同类型的Amp C酶或检测产不同类型Amp C酶的菌株,其方法也有所不同。
高诱导型一般在有合适的诱导物(如头孢霉素类)存在的条件下,可使AmpC酶的表达水平增加10~100倍,当去除诱导剂后,酶表达水平将恢复到正常水平。
持续高产或去阻遏突变型是与AmpC酶调控基因之一AmpD相关的一种基因表达方式,质粒介导的Amp C酶一般以此种类型为主。Amp D通过编码Amp D酶蛋白质而负性调节Amp C酶的表达,Amp D基因发生突变时产生有缺陷的Amp D蛋白,不能与另一种调控蛋白Amp R蛋白质结合形成复合物,Amp R蛋白质即以激活子状态发挥激活作用,引起AmpC酶的大量表达(去阻遏表达),Amp D的突变频率高达10-5~10-8,且β-内酰胺类抗菌药物对这种突变具有选择作用,产生这种类型AmpC酶的细菌对临床的危害最大,是临床微生物实验室检测的重点。AmpD的突变也可以影响高诱导型AmpC酶的表达水平,导致细菌持续产生中等到极大量的AmpC酶或导致细菌在诱导因子存在时的产酶量大大超过野生型菌株在诱导因子存在时的产酶量。持续高产或去阻遏突变型不论在有无β-内酰胺类抗生素存在的条件下均可持续高水平合成AmpC酶。
持续低产型又称基础型,极少部分菌株产此型AmpC酶,大部分大肠埃希菌属于此种类型,其特点是不论在有无β-内酰胺类抗生素存在的条件下均持续低水平合成Amp C酶,原因可能是Amp C酶另一调节基因-Amp R基因发生突变,产生有缺陷的Amp R蛋白,不能在无β内酰胺类抗生素存在的条件下起到抑制子的作用,也不能在有β内酰胺类抗生素存在的条件下起到激活子的作用,故Amp C酶得以持续低水平非诱导性地表达。
野生型即通常所指的染色体介导的诱导型Amp C酶。
产AmpC酶的革兰阴性杆菌已逐渐成为医院感染的流行菌。在美国,肠杆菌属造成的医院感染菌血症占5%~7%,特别当存在以下危险因素时:如长期住院(尤其ICU)、严重的基础疾病、各种原因的免疫抑制、高龄、导管装置、抗生素使用等更易发生医院内感染。肠杆菌属感染的暴发流行主要发生在大量使用头孢菌素和其他广谱β内酰胺类抗生素的肿瘤病房或新生儿、心脏外科的ICU。造成感染暴发流行的多种细菌来源于使用头孢菌素而形成的选择性压力使患者体内原有细菌如肠杆菌属细菌逐渐成为肠道菌中的优势菌,最终造成患者感染。研究发现,在肠杆菌属细菌所致的菌血症中,使用第三代头孢菌素治疗比使用氨基糖苷类或其他β内酰胺类治疗更容易导致多重耐药性的产生,当减少或终止头孢菌素类抗生素使用时,可减少产诱导酶的肠杆菌科细菌的流行和耐药菌株的出现。
(3)ESBLs:细菌在持续的各种β-内酰胺类抗生素的选择压力下,被诱导产生活跃的及不断变异的β-内酰胺酶,扩展了其耐受头孢他啶、头孢噻肟、头孢吡肟等第三代及第四代头孢菌素,以及氨曲南等单内酰环类抗生素的能力,这些新的β-内酰胺酶被称为ESBLs,按Bush分类属2be。ESBLs最早被发现由克雷伯菌属和大肠埃希菌等肠杆菌科细菌产生,然后又在假单胞菌、不动杆菌、流感嗜血杆菌和奈瑟菌中发现。ESBLs由质粒介导,大多由编码TEM-1基因、SHV-1基因突变而形成,多数可为β内酰胺酶抑制药(如克拉维酸,三唑巴坦及舒巴坦)所抑制(克雷伯菌例外),种类最多的是TEM族酶(已超过90种)、SHV族酶(已超过25种)和CTX-M族。有研究认为第三代头孢菌素类抗生素的滥用是引起这类耐药细菌出现的主要因素,而β-内酰胺酶抑制和碳青霉烯类药物不易诱导ESBLs产生。
根据质粒所携带编码基因同源性的不同,ESBLs主要有TEM、SHV、CTX-M、OXA型。还有一些少见的ESBLs型别如PER、VEB、CMZ等。目前我国发现的ESBLs以CTXM、SHV、TEM型为主,但因不同省市、不同研究,其报告比例各不相同。ESBLs主要存在于临床分离的革兰阴性杆菌中,产酶菌为15%,其中又多见于肠杆菌科细菌,以肺炎克雷伯菌最为常见,其他常见的产ESBLs的细菌有大肠埃希菌、产酸克雷伯菌、产气肠杆菌、变形杆菌、沙门属菌、阴沟肠杆菌等。我国大陆肺炎克雷伯菌中产ESBLs菌株的发生率为20%~50%,大肠埃希菌为20%~30%。
TEM型ESBLs由广谱酶TEM-1、2发生1~5个氨基酸改变衍生而来,发生在个别位点的氨基酸取代对ESBLs表型至关重要,目前已发现其突变位点主要集中在104、164、238、240位点,其中Glu-104→Lyx、Arg-164→Ser/His、Gly-238→Ser及Glu-240→Lys最常见。SHV型ESBLs由广谱酶SHV-1发生氨基酸突变衍生而来,其突变位点集中在179、238、240位点,Ser-238→Gey、Lys-240→Glu最常见,如SHV-2与SHV-1相比仅有一个氨基酸的变化,即由238位点Ser(SHV-1)变为Gey(SHV-2),引起SHV-2酶水解底物谱的扩大。
TEM型和SHV型ESBLs突变位点中164、179、238位点中任一点的突变都将导致ESBLs活性作用位点丝氨酸-70所处的催化腔体积的增大,使分子结构较大的三代头孢菌素能够进入催化腔底部被酶水解,在此基础上104、240等位点的突变将使酶对三代头孢菌素的亲和力增强,从而进一步提高其水解效率。突变的位点不同其水解效率也不同,如238位点的突变主要促进酶对头孢噻肟的水解,而240、104等位点的突变主要促进酶对头孢他啶的水解,其他部位的氨基酸变化仅起到辅助作用。
CTX-M型ESBLs是近年来在世界各地被发现的非TEM和非SHV起源的ESBL,总体上CTX-M型呈逐渐增多趋势,其主要特征是对头孢噻肟水解力强,而对头孢他啶水解力弱,他唑巴坦对其抑制能力强于舒巴坦和克拉维酸,体外药敏试验中产生此酶的菌株常对头孢噻肟耐药而对头孢他啶较敏感。国内报道产ESBLs的大肠埃希菌和肺炎克雷伯菌的基因型主要是CTX-M型,这与我国头孢噻肟用量多于其他三代头孢菌素有关。CTX-M型ESBLs的237位点的Ser与超广谱的水解活性密切相关,其与TEM或SHV型β-内酰胺酶同源性仅约40%,而与产酸克雷伯菌产生的染色体介导的头孢菌素酶的同源性较高(75%~78%)。CTX-M型ESBLs菌株可通过转座子从染色体转移至质粒,并通过质粒使耐药性广泛传播,从而存在暴发感染流行的潜在性。
OXA型ESBLs对苯唑西林和邻氯西林的水解活性高,不被克拉维酸所抑制(OXA-18例外),大多数的OXA型ESBLs由OXA-10衍生而来。该型菌株对三代头孢菌素和氨曲南轻度耐药。
驱动ESBLs进化的选择压力通常要归因于氧亚胺β-内酰胺类抗生素的使用强度。β-内酰胺类抗生素的强选择压力不仅对ESBLs基因的编码区而且对启动子、拷贝数以及其他基因起作用,这些改变可明显增加菌株的耐药水平和扩大底物谱。细菌高产ESBLs通常是诸如启动子上调突变、可转座因子插入启动子区域附近、ESBL基因拷贝数增加或产生2种不同的ESBLs等原因造成,此外还发现不少菌株产ESBL同时伴有AmpC酶去阻遏突变,所以抗生素的使用情况不同,ESBL的类型在不同国家和地区是不同的。
目前认为产ESBLs细菌已成为除耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌外的医院感染的主要致病菌。产ESBLs的细菌耐药性较强,其携带的ESBLs质粒上可同时带有对喹诺酮类、磺胺类和氨基糖苷类等多种抗生素的耐药基因,往往具有多重耐药性,其编码基因绝大多数位于质粒上,可将耐药质粒通过转化、转导、转座、接合转移和整合等方式在同种和不同种细菌间传递造成暴发流行,极易导致院内交叉感染和耐药菌扩散。此种耐药质粒还可以在正常人群中长期存在。由于ESBLs的可传播性和对三代头孢菌素敏感而引起误导治疗,且它的产生使治疗更加困难,抗菌药物的选择范围更窄,因此被认为是革兰阴性杆菌中最危险的耐药形式,应引起临床高度重视。临床工作中已经能够通过实验掌握ESBLs和AmpC型酶并针对性应用抗生素。
2.改变抗生素与PBP的亲和力
(1)概述:青霉素结合蛋白(PBPs)是β-内酰胺类抗生素的主要作用靶位,不同细菌其种类及含量均不相同,并非所有PBP均是青霉素的作用靶位。每个菌种都有一套特异的PBPs,称PBPs谱。在一种菌种中PBPs按分子量大小排序,分别称PBP1、PBP2、PBP3等,每种又有若干亚型如PBP1 A、PBP1B。不同PBP含量变化很大,如大肠埃希菌中高分子量的PBP1、PBP2和PBP3量很少,而低分子量的PBP5和PBP6却占PBPs量的70%~90%。
β-内酰胺类抗生素的抗菌活力主要根据其与PBP亲和力的强弱、对PBP及其亚型的选择(即对细菌的作用特点)而决定。PBP基因的变异使β-内酰胺类抗生素无法与之结合或结合能力降低,是形成耐药的根本原因。如PBP1A、PBP2X、PBP2B的基因排序已经证明1~3个位点基因变异可造成PBP结构变化,使β-内酰胺类抗生素与PBP结合的亲和力下降导致抗菌力低下。PBP改变包括对抗生素低亲和力的PBP的获得如葡萄球菌、本身发生修饰导致对抗生素亲和力下降的PBP的表达如肺炎链球菌。青霉素结合蛋白结构与数量的改变是细菌对β-内酰胺类抗生素产生耐药的一个重要机制,其单独作用或与β-内酰胺酶产生、外膜通透性降低、细胞膜主动外排及生物胶膜等机制协同作用可导致临床抗感染治疗失败。
(2)革兰阳性细菌:革兰阳性细菌没有细胞外膜,β-内酰胺酶和通透性屏障等在其耐药机制中发挥的作用有限,因此与PBP相关的耐药问题在本类细菌中显得尤为重要。
革兰阳性细菌中金黄色葡萄球菌含有5种PBP——PBP1、PBP2、PBP3、PBP3′、PBP4。目前全球范围内发生率最高的院内感染病原菌——耐甲氧西林金黄色葡萄球菌(MRSA)对所有β-内酰胺类抗生素均耐药,其原因是由于获得了未知起源的DNA编码的新的耐β内酰胺的PBP,因其电泳率介于PBP2与PBP3之间,故称为PBP2a或PBP2′。当β-内酰胺类抗生素与MRSA接触后,药物穿过细菌表面并以共价结合方式使正常的4种主要PBP失活,但PBP2a对β-内酰胺类抗生素亲和力很低,因而很少或不被β-内酰胺类药结合。在β-内酰胺类抗生素存在的情况下,PBP2a能替代其他几种PBP完成细胞壁合成的功能,细菌仍能正常生长,因而MRSA对β-内酰胺类抗生素表现出耐药性。
PBP2a的产生是由染色体甲氧西林耐药基因(mec A)来编码的,由于mec A与其他几种耐药性决定基因紧密相邻、共同传播,因此MRSA常表现为对多种类型的抗菌药物多重耐药。但细菌具有mec A并不一定表现出对β-内酰胺类抗生素的耐药性。体外研究发现,mec A基因的表型表达受多种因素的影响,包括p H、温度、渗透性、上游调节序列和其他不相关染色体基因。有些MRSA的mec A基因上游存在着调控基因mecR1和mecI,其序列和功能分别与β内酰胺酶的调控基因blaR1和blaI相似,对mec A的表达进行负调控。
mec A基因的转录即PBP2a的表达有3种形式。①非诱导持续表达型,此型MRSA缺少mecR1-mecI基因和β内酰胺酶质粒。②即刻诱导型,此型MRSA缺少mecR1-mecI基因而具有β内酰胺酶质粒,通过β-内酰胺酶的调控基因blaR1和blaI调控mec A的表达。③延迟表达型,此型MRSA具有mecR1-mecI基因,其耐药性在甲氧西林诱导后48h才能充分表达,临床常规药敏试验常误将此型菌株判断为敏感,因此具有重要的临床意义。
除mec A基因外甲氧西林的耐药还与fem基因(包括fem A、B、C、D、E、F等)的表达有关。Fem的功能是直接或间接参与细菌细胞壁的生物合成,不影响PBP2a的合成,但其缺失将导致细菌对甲氧西林的耐药性降低。
凝固酶阴性葡萄球菌中最常见的表皮葡萄球菌存在mec A基因,可以产生与金黄色葡萄球菌PBP类型相似的低亲和力的青霉素结合蛋白(PBP2a),导致对β-内酰胺类抗生素的耐药。有研究表明,近年来在耐苯唑西林的凝固酶阴性葡萄球菌中,75%能测出含有mec A基因,因此凝固酶阴性葡萄球菌被认为是新的重要的医院内感染病原体,不仅导致侵袭性感染,而且已经成为耐苯唑西林和多重耐药的病原体。
肺炎链球菌通常不产生β-内酰胺酶,该菌包括6种PBP(1a、1b、2a、2x、2b、3),并分别有相应的基因pbp1a、pbp1b、pbp2a、pbp2x、pbp2b、pbp3编码,其对β-内酰胺类抗生素的耐药与PBPs的广泛改变有关,主要是PBP1a、PBP2a、PBP2b和PBP2x发生改变导致其与β-内酰胺类抗生素的亲和力降低而产生耐药性。肺炎链球菌耐青霉素是一个连续突变、逐步获得的过程,具有多基因特性。肺炎链球菌PBP单个基因突变会导致低水平耐药,高水平耐药则是多个基因连续突变的结果,如对青霉素低度耐药是由于PBP2x的改变,对青霉素高度耐药是由于PBP2b、PBP2x的改变所导致,对广谱头孢菌素的耐药则涉及PBP1a、PBP2x的改变。此外编码表达耐药肺炎链球菌菌株PBP蛋白的基因pbp1a、pbp2x与pbp2b可在同种肺炎链球菌之间转移或异种细菌间横向转移,如由肺炎链球菌把耐药基因转移至草绿色链球菌,pbp2b基因起着重要的作用。
粪肠球菌和屎肠球菌具有相似的5种PBPs,对多数β-内酰胺类抗生素天然耐药。粪肠球菌对大多数β-内酰胺类耐药是由于PBP1与PBP3亲和力下降,并且在耐药菌中PBP3(个别文献中为PBP5)不但亲和力下降并且有过量生产。屎肠球菌主要是PBP1与PBP2的亲和力下降。
(3)革兰阴性细菌:革兰阴性细菌的产酶机制和通透性等因素在其耐药机制中的作用明显,PBP在耐药机制中的作用并不十分显著,因此革兰阴性细菌对β-内酰胺类抗生素的耐药性与PBP改变的关系不如革兰阳性细菌明显和重要。PBP改变介导的细菌耐药在革兰阴性菌中较少见,主要为铜绿假单胞菌、流感嗜血杆菌、淋病奈瑟菌、脑膜炎奈瑟菌、醋酸钙不动杆菌和脆弱类杆菌。
目前对大肠埃希菌PBP的研究最为清楚,典型的大肠埃希菌具有7种PBP(1a、1b、2、3、4、5、6),迄今为止没有发现由PBP介导的大肠埃希菌耐药。铜绿假单胞菌的PBP类型与大肠埃希菌高度相似,临床和实验室均发现耐药铜绿假单胞菌中有PBP改变现象的存在,其中PBP3对β-内酰胺类抗生素的亲和力下降或缺失与耐药性有关:PBP3改变可以增加菌株对β-内酰胺类抗生素的耐药水平;低水平耐药的铜绿假单胞菌中PBPs或者缺失或者丧失对青霉素的结合力,中等水平耐药的铜绿假单胞菌降低所有的PBPs与青霉素的亲和力。流感嗜血杆菌有8种PBP,临床分离株中不产生β-内酰胺酶而对β-内酰胺类抗生素耐药的流感嗜血杆菌与耐药性相关的PBP是PBP3、PBP4、PBP5,这些菌株的耐药性有多重因子决定,其中外膜蛋白的改变可降低PBP对抗生素的亲和力。淋病奈瑟球菌有3种主要PBP,分别为PBP1、PBP2、PBP3,淋病奈瑟球菌耐药株中PBP1、PBP2对β-内酰胺类抗生素的亲和力下降,6个遗传位点pen A、mtr、penB、tem、pem、env控制菌株内在的β-内酰胺类抗生素耐药性,其中pen A基因与PBP2的亲和力降低有关,env基因突变则减弱青霉素耐药性的表达。脑膜炎奈瑟球菌对β-内酰胺类抗生素耐药性与其PBP2亲和力降低有关,脑膜炎奈瑟球菌耐青霉素菌株pen A基因变化很大并可从共生菌(黄色炎奈瑟球菌)通过转化整合到脑膜炎奈瑟球菌和淋病奈瑟菌中。厌氧脆弱类杆菌已检出4种PBP,临床分离株对头孢西丁耐药可能与PBP1、PBP2亲和力降低有关,对头孢噻吩及其他头孢菌素耐药与PBP3的亲和力降低有关。
3.细菌外膜通透性改变 革兰阴性菌被一层有通透性的外膜包绕着,外膜约60%的表面覆盖膜孔蛋白(porin),膜孔蛋白聚合起来形成孔道。膜孔蛋白是跨膜蛋白通过重组形成的充满水分的孔道,允许小分子亲水性物质包括大多数抗生素跨膜扩散,外膜通透的下降可以放大酶失活造成的抗生素耐药效应。β-内酰胺类抗生素可以通过革兰阳性菌的细胞壁,而某些β-内酰胺类抗生素不易通过革兰阴性菌的细胞壁,β-内酰胺类抗生素必须通过细菌的膜孔蛋白进入菌体内才能发挥杀菌作用。在抗生素选择压力作用下,耐药菌可产生基因突变,改变外膜蛋白尤其是膜孔蛋白的组成和数量,使跨膜孔蛋白失活,菌体外膜通透性降低,阻碍抗生素进入菌体内而产生耐药性。虽然外膜孔蛋白缺失或突变不是革兰阴性菌主要的耐药机制,但可与其他耐药机制协同作用使细菌耐药性增强。
一般情况下,膜孔蛋白的组成是以Omp F和OmpC为主,属于非特异性跨膜通道,孔径分别为1.16nm和1.08nm,β-内酰胺类抗生素可以透过。接触抗生素后,突变菌株的该蛋白基因失活使蛋白质合成减少或消失或结构发生改变,使β-内酰胺类抗生素进入菌内大量减少而耐药,如大肠埃希菌、鼠伤寒沙门菌等。还有一种跨膜孔蛋白为特异性通道,存在于铜绿假单胞菌外膜,由Opr D组成,只允许亚胺培南进入,突变后使该药不能进入菌体内,形成特异性耐药。
大肠埃希菌膜孔蛋白主要有5种:Omp F、Omp C、PhoE、LamB和蛋白K,其合成主要受EnvZ(Omp R)系统、Cpx系统以及MicF调控。大多数β-内酰胺类抗生素可通过的膜孔蛋白主要是Omp F、OmpC,其特点为对带有负电荷的物质通透性明显降低,Omp F的通透性较Omp C高10倍。研究发现,耐头孢西丁的大肠埃希菌膜孔蛋白Omp F、Omp C缺失,对抗生素的敏感性降低。大肠埃希菌膜孔蛋白缺失的原因主要包括点突变或多位点插入干扰了编码序列、启动子区域的点突变影响了转录、未知机制作用于转录水平的机制或阻止膜蛋白插入外膜。大肠埃希菌膜孔蛋白OmpF基因存在较普遍的突变,RT-PCR检测显示突变株均存在膜孔蛋白转录水平下调,在产AmpC酶的大肠埃希菌中膜孔蛋白下调比例为43.75%。大肠埃希菌通透喹诺酮类药物的膜孔蛋白主要为OmpF与OmpC,在喹诺酮药物作用下,对膜孔蛋白发生变异而缺失Omp F的菌株,药物不能进入细胞内而产生耐药性。
肺炎克雷伯菌的膜孔蛋白包括Omp K35、Omp K36、Omp K37,其中Omp K35、Omp K36为两个主要膜孔蛋白,Ompk35是细菌发生耐药最主要的膜孔蛋白,Omp K37一般情况下不表达或表达量极少。研究发现,头孢西丁体外诱导和临床抗生素治疗均可使细菌Omp K36基因发生突变,使基因不能正常表达,导致膜孔蛋白缺失而引起耐药。此外还有一些未知的机制作用于转录水平或阻止蛋白插入细菌外膜影响膜孔蛋白功能,膜孔蛋白转录水平的下调也可能引起耐药。相对于大肠埃希菌,肺炎克雷伯菌膜孔蛋白的调控机制尚无更为深入的研究。研究发现,膜孔蛋白缺失这一单独因素并不能引起肺炎克雷伯菌对亚胺培南的耐药,其仅可使碳青霉烯类抗生素的MIC升高。对大肠埃希菌和肺炎克雷伯菌主要膜孔蛋白的检测发现,所有膜孔蛋白缺失的菌株都伴有ESBL阳性,膜孔蛋白合并产酶菌株较单一产酶菌株的耐药率高出约20%,膜孔蛋白的表达水平在细菌耐药中起着不可忽视的作用。
目前研究已经发现,铜绿假单胞菌仅是大部分革兰阴性菌膜孔蛋白数(约105)的四分之一,限制了β-内酰胺类抗生素进入其体内,使其比大肠埃希菌对β-内酰胺类抗生素更加耐药。研究也表明,无论是体外的还是临床上分离出来的铜绿假单胞菌,外膜膜孔蛋白Opr D的缺失或改变都会造成其对碳青霉烯类抗生素的耐药。此外,不动杆菌膜通透性降低是对β-内酰胺类抗生素耐药的原因之一;鲍曼不动杆菌对亚胺培南的耐药与外膜蛋白有明显的29k D蛋白缺乏有关;淋球菌细胞膜上的主要膜孔蛋白由penB基因编码,penB基因的突变引起膜通透性降低引起耐药。
4.主动外排 细菌的耐药机制非常复杂。常见的耐药机制包括抗菌药物灭活酶(钝化酶)的产生、抗菌药物作用靶位的改变以及细胞膜通透性的改变。但是,尚难以完全解释多重耐药菌株对许多化学结构完全不同的抗菌药物所产生的高度耐药性。近年来的研究表明,在一些细菌中存在能量依赖性主动转运蛋白(主动外排),即细菌能够将扩散进细胞内的多种抗菌药物主动泵出细胞外,降低了抗生素吸收速率或改变了转运途径,导致细菌耐药性的产生。所有活细胞都有外排机制,外排系统既是天然也是获得性的抗生素耐药机制。外排系统的高度表达,导致细菌不只是对某一种而是对所有外排底物(抗生素)的MIC显著升高,包括氟喹诺酮类、青霉素、头孢菌素类、大环内酯类等,形成细菌多重耐药。主动外排机制和细菌外膜通透性改变单独或协同赋予细菌对多种抗生素获得性或固有耐药,而且还可以和其他耐药机制共同作用,使细菌高度耐药。对于介导细菌多重耐药性的主动外排泵的研究起于对大肠埃希菌和铜绿假单胞菌多重抗生素的研究,近年的研究还发现许多革兰阳性球菌和革兰阴性杆菌的细胞膜存在能量依赖性外排系统。
随着分子生物学的进步,尤其是基因测序技术的飞速发展,依据序列相似性以及底物特异性,可以对细菌各种转运体进行鉴别和归类。目前所知与细菌多重抗菌药耐药性有关的主动外排泵系统主要归于以下5个家族:ATP结合盒转运体类(ATP-binding cassemembrane affinity filtration transporters,ABC),主要易化子超家族(major facilitator superfamily,MFS),药物代谢物转运体家族(drug metabolite transportors superfamily,DMT),多重药物与毒物外排家族(multidrug and toxic compound extrusion family,MATE),耐药结节分化超家族(resistance-nodulation-division superfamily,RND)。以上各类外排泵系统中除ABC类以ATP水解能量驱动外排泵外,其余各类均以质子驱动力为能量,并形成质子与药物的反转运体。ABC外排泵家族主要存在于真核生物中,在细菌中只发现很少结构、功能与ABC类似的外排泵。MATE类则只有数种已测序的外排泵,其作用机制尚不清,可能介导细菌代谢产物的外排,在细菌多药耐药(MDR)外排泵中,以MFS、RND、DMT质子驱动型外排泵系统的研究最为深入。细菌中许多MDR外排泵转运体基因受到转录调节因子的严格调控,目前所知的MDR外排泵转录调控因子分为两大类数个家族:转录激活因子有Mer R、ArcR、LysR家族,转录抑制因子有TetR、Mar R、LacI家族。
细菌中较常见且意义较大的MFS类转运蛋白有:Bmr、Blt(枯草芽胞杆菌)、Qac(金黄色葡萄球菌)、Emr B(大肠埃希菌)等多药耐药外排泵系统。Bmr、Blt同源序列达51%,具有相似的底物谱,均介导溴化乙啶、罗丹明、吖啶黄染料、喹诺酮、氯霉素等外排,Bmr R、Blt R是这两个外排泵的转录调节蛋白,均属于Mer R型转录激活蛋白。金黄色葡萄球菌的qac转运系统由qac A、qac R基因构成,由质粒编码。第一个被克隆的SMR多药转运体是Smr,是一个由质粒编码的多耐药外排泵,主要存在于革兰阳性菌(金黄色葡萄球菌和其他葡萄球菌)中,介导对多种药物和染料的外排。
虽然细菌耐药主动外排转运体种类众多,但是目前研究显示RND类的主动外排泵系统与细菌多重耐药性形成密切相关。RND多重耐药外排系统普遍存在于革兰阴性细菌中,以铜绿假单胞菌、大肠埃希菌、淋病奈瑟球菌等具有重要临床意义的细菌研究较为深入。常见RND外排泵系统包括:铜绿假单胞菌的Mex AB-Opr M、Mex CD-OprJ、Mex EF-Opr N系统,大肠埃希菌的Acr AB-TolC系统,淋病奈瑟球菌的Mtr D系统等,并且在对多重耐药大肠埃希菌的研究中发现其存在四环素和水杨酸钠的主动外排系统。
铜绿假单胞菌对多种β内酰胺类抗生素呈现固有的耐药性,长期以来将这种耐药性归结为该菌具有低通透性外膜,现在已认识到这种耐药性是能量依赖的主动外排系统Mex ABOpr M和低通透性外膜协同作用的结果。Mex AB-Opr M系统是铜绿假单胞菌最普遍的外排系统,可在野生型铜绿假单胞菌中表达,是其固有耐药的原因之一,其缺失可使多种抗生素的敏感性增加,它由3种蛋白组成,其中内膜蛋白起到“泵”的作用,膜孔蛋白将胞浆周围空间中的外排底物排出到细菌体外,另外一种蛋白起到将上述两种蛋白连接起来的作用。mex AB-opr M基因在染色体上呈串联排列,其转录受Mex R调控且十分复杂。研究表明,Mex R突变,不能编码具有抑制活性的Mex R,致使Mex AB-Opr M外排泵系统去阻遏高表达,细菌对多种抗生素的外排活性增强、耐受程度提高,如对β-内酰胺类、β-内酰胺酶抑制药、喹诺酮类、四环素、氯霉素等耐药。研究显示,铜绿假单胞菌主动外排系统Mex AB-Opr M仅影响美洛培南,而对亚胺培南无作用。MexCD-OprJ、MexEF-Opr N在野生型铜绿假单胞菌中无表达,但在各自的突变株中表达显著提高,可因为转录阻遏蛋白NfxB基因的突变所致,细菌获得对氯霉素、四环素类、喹诺酮类、大环内酯类、新生霉素等耐药。
大肠埃希菌是发现外排泵最多的一种细菌,在大肠埃希杆菌上发现了30多种外排泵,但一般认为Aer AB-TolC是最主要的外排泵,它属于RND家族,对亲脂性和两性的抗生素均具有强大的外排能力。Acr AB-TolC系统主要由3个部分组成,即膜融合蛋白(Acr A)、外排转运蛋白(AcrB)和外膜通道蛋白(TolC),其中Acr A位于周浆间隙中,两端连接着Aer B和TolC,Acr B和TolC分别位于细胞内膜和外膜上。Acr AB-TolC系统是一种三聚体复合物,通过复合物构象的改变,孔道可以定期开放或闭合,在其中央存在一个贯通内外膜的孔道,是药物外排的最直接途径。Acr AB-TolC系统可以提供两种途径对药物实现外排,一种是捕获胞质内的药物,直接穿越双层膜将药物排出到外界,如该系统介导对氯霉素和四环素等膜渗透性药物的耐药,另一种是捕获周浆间隙中的药物分子,通过外膜通道蛋白Tolc将药物转运到外界,如该系统对β-内酰胺类抗生素的泵出。Acr AB的表达主要受多种调控因子的调节,激活acr AB和tolC转录的主要调节蛋白是通用调节元件Mar A、SoxS和Rob。当大肠埃希菌的Acr AB-TolC外排泵过量表达时,大肠埃希菌对许多药物的耐药性随之增强,但当其过量表达超过一定水平时,又可明显排出一些代谢中间产物而对菌体细胞产生毒性。在肺炎克雷伯菌中也有类似于大肠埃希菌的Acr AkpBkp-KocC外排泵系统,其在头孢他啶耐药组的肺炎克雷伯菌中表达增高的比例远远高于敏感组,当产酶和外排泵高表达二者同时存在时,肺炎克雷伯菌耐药率将显著升高。
细菌的主动外排系统已被认为是导致细菌对多种抗生素产生耐药性的重要原因之一。此外,当细菌同时存在多种耐药机制时,不同耐药机制彼此产生协同或相加作用共同提高细菌耐药水平,细菌主动外排泵系统与其他细菌耐药机制具有协同作用提高细菌耐药水平表明细菌对多种药物耐药并非单一因素作用。
(二)细菌对氨基糖苷类抗生素产生耐药性的作用机制
氨基糖苷类抗生素主要作用于需氧革兰阴性菌和革兰阳性球菌,对链球菌和肠球菌往往无效。天然氨基糖苷类抗生素耐药主要是药物的摄入减少,而获得性耐药主要产生于质粒编码的修饰酶,此外获得性耐药也可通过染色体变异引起的核蛋白体靶位改变或抗生素摄入减少等产生。
1.酶的修饰钝化作用 细菌产生钝化酶是其对氨基糖苷类抗生素产生耐药的主要机制。目前已知许多革兰阴性菌、金黄色葡萄球菌和肠球菌等均可产生钝化酶,能使氨基糖苷类抗生素失活而致细菌耐药。已知的氨基糖苷类钝化酶有3类:乙酰转移酶(AAC),主要以乙酰辅酶A作为乙酰基的供体使氨基糖苷类游离氨基乙酰化;核苷转移酶(ANT),利用ATP作为第二底物使氨基糖苷类游离羟基核苷化;磷酸转移酶(APH),利用ATP作为第二底物使氨基糖苷类游离羟基磷酸化。
钝化酶位于细胞膜表面,催化氨基糖苷抗生素氨基或羟基的共价修饰,使进入细菌的抗生素被酰化、核苷、磷酸化,其与细菌核糖体的结合减少,同时促进药物摄取的能量依赖药物转运促进期(accelerated energy dependent drug transport,EDP)-Ⅱ也被阻断,药物吸收被向下调节,从而使药物失去抗菌活性,导致细菌耐药。三类钝化酶中磷酸转移酶对抗生素的耐药性最高。不同细菌和不同菌株的耐药性相差很大,影响因素包括酶量、催化效率及用药量。依据修饰位点的不同,每种酶又分为多种同工酶及其亚型,各亚型有不同的耐药表型,相同的表型还可由不同的基因编码。氨基糖苷类钝化酶按其所钝化的抗生素不同和作用点的不同而分为许多种。
一种氨基糖苷类抗生素能被一种或多种酶所钝化,而几种氨基糖苷类抗生素也能被同一种酶所钝化,一种钝化酶可产生不同的耐药表型,因此在不同的氨基糖苷类抗生素间存在着不完全的交叉耐药性。氨基糖苷类抗生素钝化酶通常由质粒介导和染色体所编码,同时与可动遗传因子(整合子、转座子)也有关,质粒的交换和转座子的转座作用都有利于耐药基因掺入到敏感菌的遗传物质中去,因此产生钝化酶的质粒(或DNA片段)可通过接合方式在细菌细胞间转移,使原来不耐药的细菌产生耐药性。
2.药物摄入减少 氨基糖苷类抗生素是一类分子量较大的复合物,属于非亲脂性抗生素,难以通过膜孔蛋白,因此细胞膜有显著屏障作用。由于细胞外膜的不通透性而引起抗生素摄取的减少,这在铜绿假单胞菌及其他革兰阴性杆菌中较为常见,同时抗生素摄入减少会引起细菌对所有氨基糖苷类天然或获得性低水平的交叉耐药。
氨基糖苷类抗生素主要通过膜上的载体蛋白系统如寡核系统主动转运进入细胞内膜作用于细菌质核糖体,在作用靶位前要经过细菌外膜(革兰阴性菌)和胞质膜(革兰阴性菌和阳性菌)。寡核结合蛋白(oligopeptide binding protein,OPPA)是寡核转运系统的重要组成部分,大肠埃希菌耐卡那霉素突变株的OPPA数目明显减少,有的突变株甚至不含OPPA。前者是因为在翻译水平上OPPA合成减少,后者则是由于编码OPPA的基因OPPA发生了无义突变。此外,基因突变可导致膜的不可渗透性,使能量代谢如电子转运受到影响,也可使药物的转运系统缺损而减少药物的摄取量,从而减少了氨基糖苷类抗生素的吸收,导致耐药,例如庆大霉素以及奇异变形杆菌的多重耐药菌株就发现有外膜蛋白的减少或缺失使膜通透性下降、摄取量减少而导致耐药的现象。
氨基糖苷类抗生素转运进入细胞内膜是一个电子转运过程,受到二价阴离子,高渗透压,低p H及厌氧性的调节。由于细菌对氨基糖苷类抗生素的摄取是一个需氧耗能的主动转运过程,在厌氧环境下,这一过程则不能进行,因此氨基糖苷类抗生素对厌氧菌无抗菌作用(天然耐药)。在革兰阴性菌中,氨基糖苷类抗生素首先须通过离子结合,破坏外膜上阴离子物质(包括脂多糖、外膜蛋白和两端的磷脂),其中Mg2+和Ca2+是脂多糖和磷脂结合所必需,氨基糖苷类抗生素中的阳离子可取代Ca2+,使抗生素穿透胞膜进入胞浆。某些菌株对氨基糖苷类抗生素敏感性降低,就是因为一些离子转移系统缺陷,造成药物摄入减少,如肠球菌、链球菌和某些肠杆菌科细菌。
3.核糖体结合位点的改变 氨基糖苷类抗生素的结合位点在核糖体RNA(r RNA)上,而核糖体是编码蛋白质的中枢,是经过周密保护的,因此,由核糖体结合位点的减少而产生耐药的情况较少见,但r RNA特定的突变却是造成链霉素耐药性的一个原因。链霉素作用于核糖体30S亚基,导致基因密码的错读,引起m RNA翻译起始的抑制和异常校读。S12蛋白是30S亚基中的一个组分,主要控制链霉素与30S亚基的结合,它可以稳定由16Sr RNA所形成的高度保守的假节结构。研究表明,编码S12核糖体蛋白的rplS基因及编码16Sr RNA的rrs基因突变引起Rpsl氨基酸的置换,使核糖体结合位点改变,影响16Sr RNA的高级结构,16Sr RNA结构的改变破坏了16Sr RNA与链霉素的相互作用,导致细菌对链霉素产生显著水平的耐药。例如在某些肠球菌属的突变株中由于核糖体结合靶位的改变,产生对链霉素的高度耐药,但通常与庆大霉素、卡那霉素、妥布霉素等之间无交叉耐药性。因核蛋白体靶位修饰致结合位点改变产生对链霉素耐药的菌株还有淋病奈瑟菌、金黄色葡萄球菌、铜绿假单胞菌和粪肠球菌,由这种机制引起的耐药亦可发生于结核杆菌,耐链霉素的结核分枝杆菌也是由于16Sr RNA和核蛋白体S12基因发生突变引起的,但很少发生于其他细菌。
也有研究发现,大肠埃希菌中编码16Sr RNA的基因发生突变,使核糖体结合位点改变,可导致细菌对氨基糖苷类中的一些抗生素产生耐药,该类抗生素通常具有4,5-或4,6-双取代基团,主要包括新霉素、巴龙霉素、核糖霉素以及庆大霉素、卡那霉素等,而且这种突变可在革兰阴性菌中通过质粒传播,造成广泛耐药。
4.主动外排 主动外排系统作为细菌耐药机制之一,存在于许多细菌中。细菌的主动外排系统主要包括ATP结合盒转运体类(ABC)、主要易化子超家族(MFS)、药物代谢物转运体家族(DMT)、多重药物与毒物外排家族(MATE)、耐药结节分化超家族(RND)等5个家族。氨基糖苷类抗生素的耐药机制主要是质粒介导的钝化位酶修饰而致药物灭活、外膜通透性下降而致摄入减少以及染色体基因突变致药物与作用靶点结合力下降,主动外排机制较为少见,典型的如铜绿假单胞菌的MexB蛋白、嗜麦芽寡养单胞菌的SmeB,这两种主动外排蛋白属于RND家族。
以氨基糖苷类抗生素为作用底物的铜绿假单胞菌外排蛋白包括Mex B和Mex XY。铜绿假单胞菌中Mex AB.Opr M系统包括位于质膜上的转运因子(MexB)、外膜蛋白通道(Opr M)和胞质接头蛋白(Mex A),后者能将Mex B和Opr M连接起来,这种结构可以直接将底物排到胞外,去除Mex B基因使突变株对氨基糖苷类抗生素的敏感性恢复,提示Mex AB泵出系统是导致细菌对氨基糖苷类抗生素产生耐药的重要机制。通常认为铜绿假单胞菌中MexB蛋白只能转运亲脂或两亲化合物,而亲水性氨基糖苷类抗生素并不是此外排系统的底物,但近年来从铜绿假单胞菌中发现的RND型外排泵——Mex XY.Opr M在目前所知的铜绿假单胞菌多药外排泵中具有最广的底物特异性,通常可影响细菌对多种药物的摄取,从而导致对氨基糖苷类、喹诺酮类、四环素类、氯霉素等多种抗菌药物的耐药。目前认为正是Mex XY.Opr M主动外排泵主要介导了铜绿假单胞菌对氨基糖苷类抗生素的天然或获得性耐药。Opr M基因位于mexB基因的下游,可以和mex AB基因同时或单独复制,而mex XY基因则不位于Opr M基因附近。mex XY基因上游的分叉复制基因mex Z(也称amr R)编码了mex XY表达的去阻遏因子。
有研究表明,大肠埃希耐药菌中膜蛋白mdf A是一种新的多药转运蛋白,属于MFS型转运蛋白,由mdf A基因编码,由质子电化学梯度驱动,能将新霉素、卡那霉素泵出菌体外。
(三)细菌对大环内酯类抗生素产生耐药性的作用机制
1.靶位结构改变或修饰 细菌可以针对大环内酯类抗生素产生耐药基因,由此合成一种甲基化酶,使核糖体的药物结合部位甲基化而产生耐药。
肺炎链球菌、化脓性链球菌、肠球菌、葡萄球菌等对红霉素耐药的主要机制是由核糖体甲基化酶(Erm)基因介导的核糖体甲基化修饰。Erm基因编码核糖体甲基化酶,使23Sr RNA上的单个腺嘌呤残基N-6位二甲基化,阻断大环内酯类抗生素与核糖体的结合。Erm基因中ErmB是耐药最主要的基因。目前研究认为我国肺炎链球菌对大环内酯类抗生素耐药的主要机制是由于Erm B基因编码的核糖体靶位点的改变。国外发现了肺炎链球菌耐药Erm A基因,与金黄色葡萄球菌高度相关,介导红霉素和克林霉素的交叉耐药,称为ML表型耐药。此外,目前认为幽门螺旋杆菌(Hp)对克拉霉素耐药机制系编码23S rRNA的基因V区点突变,使核糖体结合部位构象发生改变,从而与药物的亲和力明显下降。
2.主动外排或外排增多、摄入减少 耐药细菌可以使膜成分改变或出现新成分,导致大环内酯类抗生素进入菌体内量减少,但药物与核糖体的亲和力不变。细菌的细胞膜成分改变可形成一种依赖ATP质子泵的膜蛋白,通过耗能过程将药物排出体外而阻止药物作用于靶部位,此过程称为药物的主动外排系统(外排泵)。细菌膜蛋白由膜通道蛋白、融和蛋白和胞质膜外排蛋白3部分组成,它们的编码基因主要有主动外排转运体(Mef)、Msr和Mac AB等。Mef是肺炎链球菌、化脓性链球菌的外排泵(在化脓性链球菌中为Mef A,在肺炎链球菌中为Mef E),Msr A、MsrC分别是葡萄球菌、粪肠球菌的外排泵。如耐药肺炎链球菌、化脓性链球菌存在Mef基因,该基因能编码膜蛋白将进入细菌体内的红霉素泵出菌体外。Mef基因是染色体通过结合转移传递的,该机制将引起低、中度水平耐药(红霉素MIC 1~32 mg/L),这种由Mef基因编码的耐药性是20世纪90年代以后发现的耐药模式,称为M表型耐药,主要针对14元环、15元环大环内酯类抗生素,对16元环大环内酯类抗生素如交沙霉素耐药作用较弱或无效。
3.产生灭活酶 酶介导的药物灭活是由于细菌产生大环内酯类抗生素的钝化酶,破坏药物而使其失去抗菌活性。钝化酶包括大环内酯酯酶、2′-磷酸转移酶、甲基化酶、乙酰转移酶和核苷转移酶等,这些酶使大环内酯类抗生素或水解或磷酸化或甲基化或乙酰化或核苷化而失活。大环内酯酶编码基因为ere A和ereB,存在于金黄色葡萄球菌、链球菌和大肠埃希菌以及其他一些革兰阴性菌中,2′-磷酸转移酶分为MPH1和MPH2两类,分别由mph A和mph B基因编码。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














