第二节 散射光信号和荧光信号
一、散射光信号
细胞在鞘流中通过测量区时,经激光照射产生散射光线,分为FSC和SSC(图8-3)。散射光不依赖于任何细胞样品的制备技术(如染色),因此被称为细胞的物理参数或称固有参数。①FSC与激光照射方向平行,反映细胞对光的衍射能力,与被测细胞的大小有关,细胞大,FSC强。通过光电二极管收集前向光强。通常在流式细胞仪应用中,选取FSC作阈值(阈值是一个电子控制阀,它触发细胞仪收集信号),来排除样品中的各种碎片及鞘液中的小颗粒,以避免对被测细胞的干扰。②SSC是与激光束正交90°方向的散射光信号。对胞膜、胞质、核膜的折射率更敏感可提供细胞内精细结构和颗粒性质的信息。细胞内结构越复杂,SSC就越强。通过光电倍增管收集侧向光强。FSC和SSC都是来自激光的原光束,其波长与激光的波长相同。目前采用这两个参数组合,可区分红细胞裂解后的外周血白细胞中的淋巴细胞、单核细胞和中性粒细胞3个群体,或在未进行红细胞裂解处理的全血中找出血小板和红细胞等细胞群体。
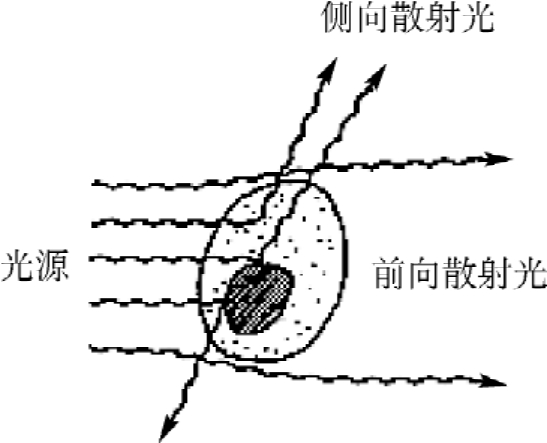
图8-3 散射光信号
二、荧光信号
当激光光束与细胞正交时,一般会产生两种荧光信号(fluorescence signals):①细胞受照射发出的微弱荧光,称细胞自发荧光;②对细胞染色的特异性荧光染料受到激光激发后发射的,通过对这类荧光信号的检测和定量分析,就能对所研究的细胞进行定性和定量测定(图8-4,8-5)。
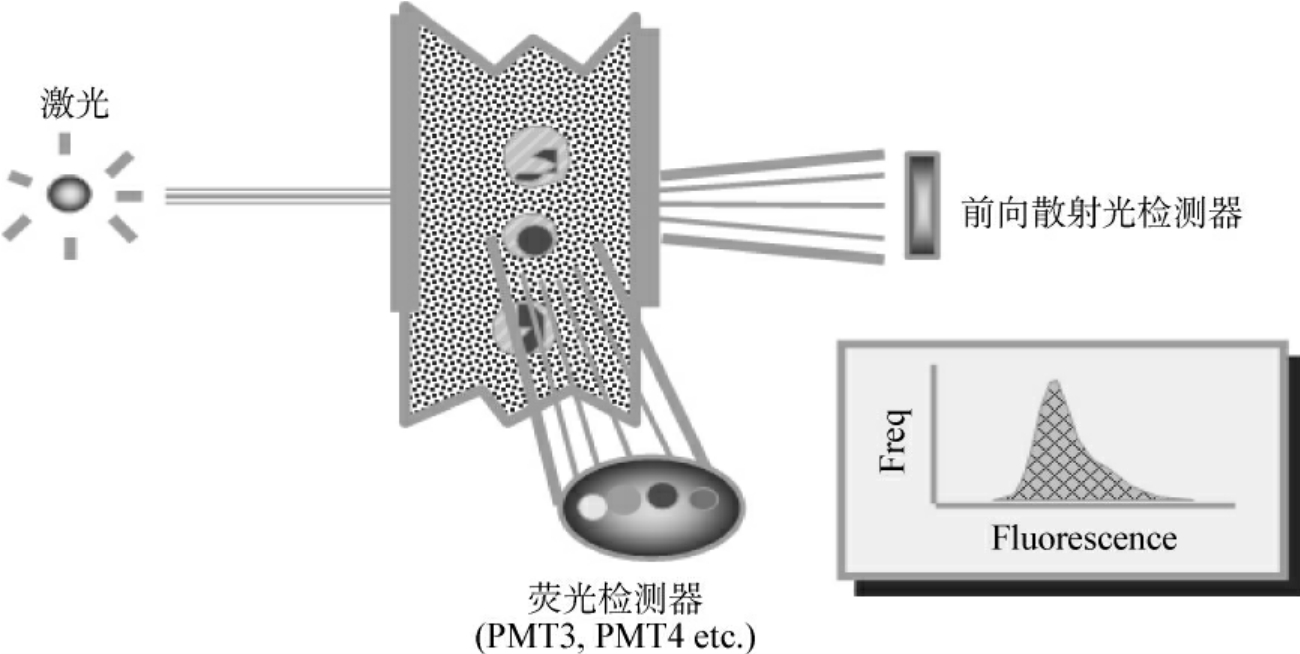
图8-4 荧光信号探测器
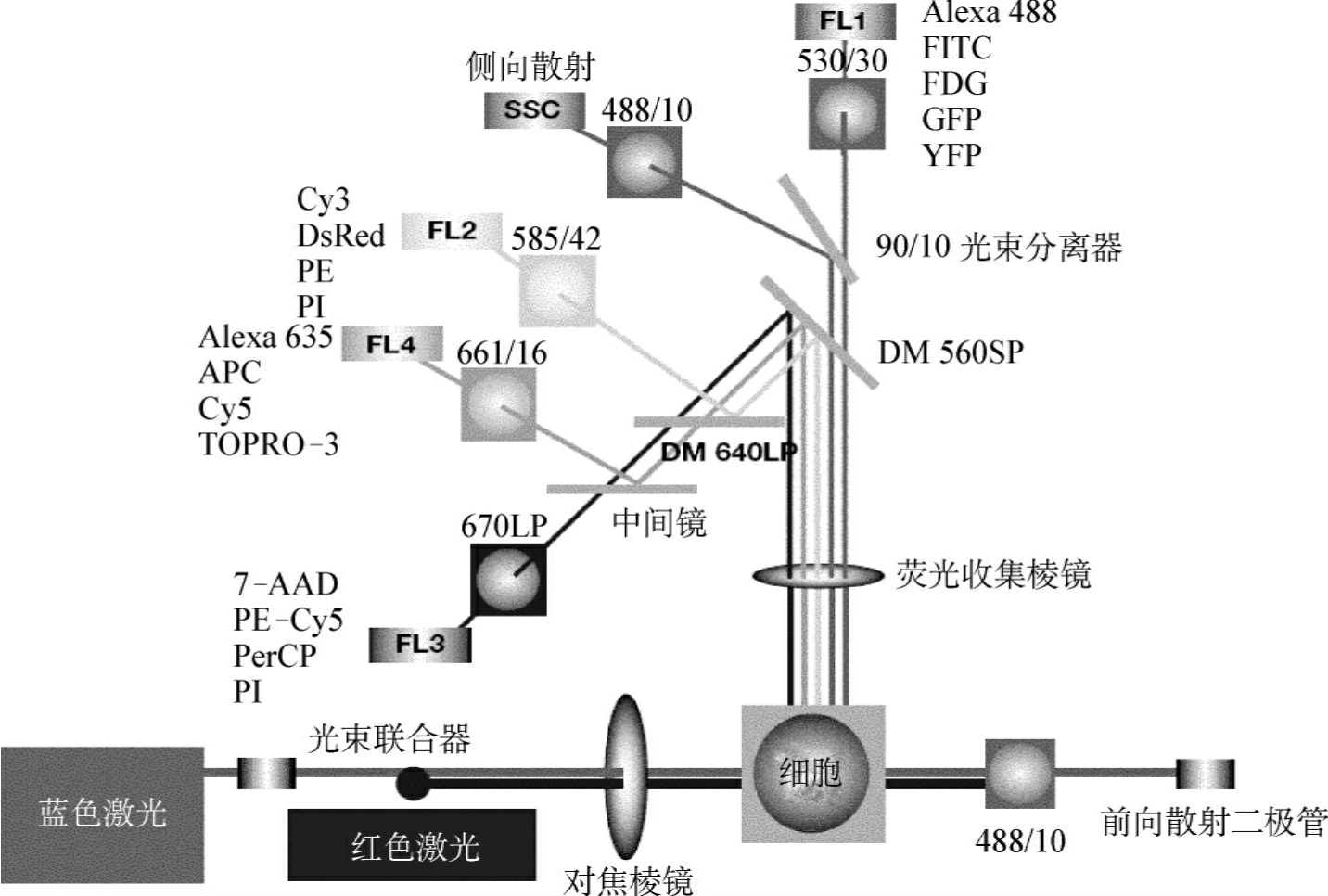
图8-5 不同通道检测不同波长荧光
荧光染料可选用的荧光素有多种多样,由于它们分子结构不同,其荧光激发谱与发射谱也各异。选取染料或用来标记单抗的荧光素,必须考虑仪器所配置光源的波长。目前,流式细胞仪台式机常配置的激光器波长为488nm,通常可采用的染料有碘化丙啶(propidiumiodide,PI)、藻红蛋白(Phycoerythrin,PE)、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、叶绿素蛋白(PerCP)、藻红蛋白-花青素(PE-CY5)等。
(一)荧光信号的检测
由光学滤光片将各种荧光信号送到所对应的检测器(FL1、FL2、FL3、FL4)上进行检测。如FITC在绿色光通道FL1处被检测到,PE在橘黄色光通道FL2处被检测到,PI在黄色FL2或红色FL3通道都能被检测到(参见图8-5)。一般情况下荧光信号强弱常用FL-High来表示(参见图8-4)。
1.荧光信号的线性测量与对数测量 主要由电子线路来完成。当携带荧光素的细胞与激光正交时,受激发发出荧光,经过滤光片分离不同波长的光信号分别到达不同的光电倍增管(PMT),PMT将光信号转换成电信号,电信号输入到放大器放大。放大器分为两类:线性放大和对数放大。线性放大器,即放大器的输出与输入是线性关系,细胞DNA含量、RNA含量、总蛋白质含量等的测量一般选用线性放大测量。但在细胞膜表面抗原等的检测时,通常使用对数放大器,如果原来输出是1,当输入增大到原来的10倍时,输出为2;当输入增大到原来的100倍时,输出为3等。在免疫样品中,细胞膜表面抗原的分布有时要相差几十倍,甚至几万倍。如用线性放大器,将无法在一张图上清晰地将细胞阳性群、阴性群同时显示出来。
2.荧光信号的面积和宽度 所谓荧光信号的面积是采用对荧光光通量进行积分测量,一般对DNA含量测量时,均采用面积(FL2-A)来计算。这是因为荧光脉冲的面积比荧光脉冲的高度更能准确反映DNA的含量。例如,形状差异较大而DNA含量相等的两个细胞,得到的荧光脉冲高度是不等的,但经过对荧光信号积分后,所得到的信号值就相等。荧光信号的宽度(FL2-W)常用来区分双联体细胞,由于DNA样本极易聚集,当两个G1期细胞粘连在一起时,其测量到的DNA荧光信号(FL2-A)与G2/M期细胞相等,这样得到的测量数据G2/M期细胞比率会增高,影响测量准确性。通过设“门”(gate)的方法(参见本章第三节),将双联体细胞排除。其原理是双联体细胞所得到的荧光宽度信号(FL2-W)要比单个G2/M细胞大,因此设“门”后才能得到真正的DNA含量分布曲线和细胞周期。不过通过荧光强度的高度峰和面积峰也可做同样分析见图8-6(1)、(2)。
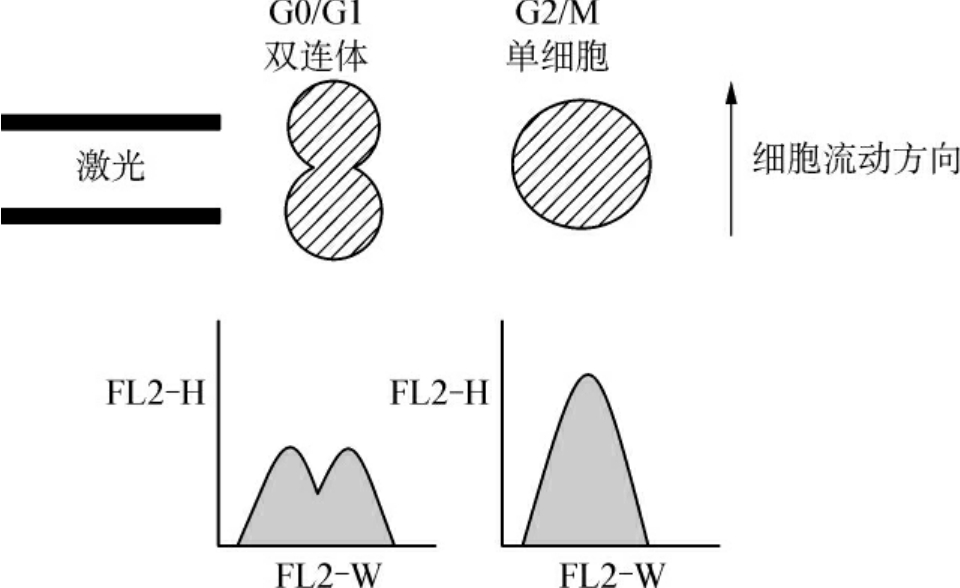
(1)双连体与单细胞形成的信号脉冲比

(2)通过设门去除双连体细胞与聚集细胞
图8-6 双连体细胞信号的形成及其设门去除
(二)光谱重叠与补偿
流式细胞分析中的荧光染色常需要两种或两种以上标记有不同荧光素的单克隆抗体或不同染料的荧光色素进行多色分析。当细胞携带两种荧光素(如PE和FITC)受激光激发而发射出两种不同波长的荧光时,理论上可选择滤片使每种荧光仅被相应的检测器检测到,而不会检测到另一种荧光。但由于目前使用的各种荧光染料都是宽发射谱性质,虽然它们之间各自发射峰值各不相同,但发射谱范围有一定重叠。如图8-7可以看出,柱状图部分为探测器检测光谱的范围,FL1探测器检测FITC,但仍可探测到少量的PE荧光,FL2探测到PE,但仍有较多FITC、PC5的荧光重叠;FL3检测PC5,但有部分PE荧光干扰,出现光谱重叠现象。克服这种误差最有效的方法是使用荧光补偿(compensation)。在流式细胞分析中,补偿是指纠正发射荧光光谱重叠的过程,即从一个被检测的荧光信号中去除其他任何干扰荧光信号。利用已知标准样品或荧光小球,可合理设置荧光信号的补偿值。
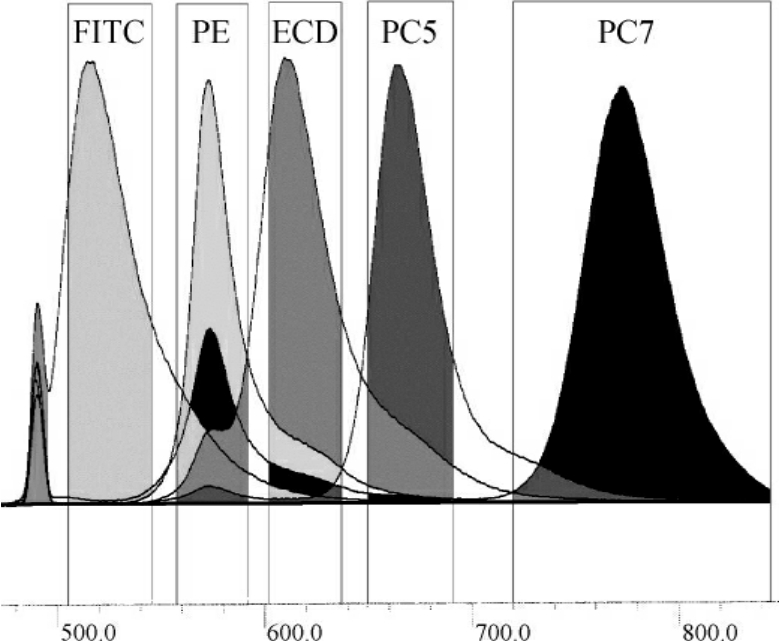
图8-7 光谱重叠
1.设置补偿的基本步骤 ①选择标准荧光微球或正常细胞(标准微球可以从厂家购买,如BD公司的Calibrite Beads);②调节PMT电压,使未染色细胞或微球的荧光峰处于10道以内;③画出被分析的细胞或微球的门(Gate)或区域(Region),注意将聚集的细胞或微球除外,同时能观察到未染色细胞或微球的自发荧光;④增加补偿设置,直至阳性和阴性细胞群或微球处于最合适的位置。还有就是采用双激光立体光路技术,以减少各种荧光间相互干扰,其原理是在光路上的光电倍增管前置一小孔,作为空间滤波器,排除其他杂散光信号,从而确保光源程序间互不干扰。因此,可以避免第1激光(488nm)激发出的FLl、FL2、FL3和第2激光(635nm)激发出的FL4间的光谱重叠。当然,FL1、FL2、FL3是来自同一点光源,它们之间的补偿是不可避免的。
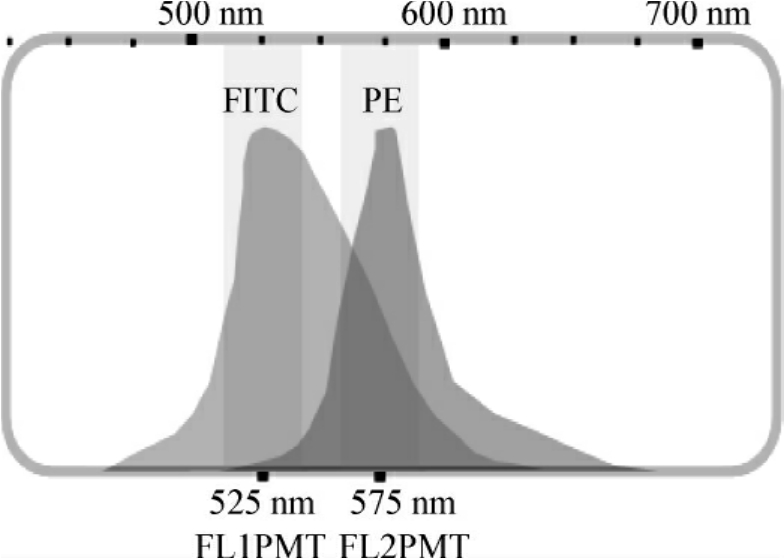
图8-8 FITC和PE发射波长的叠加
2.光谱重叠补偿设置方法 根据图8-8中FITC和PE发射波长的叠加情况,在流式细胞仪检测光信号时,PE荧光探测器便会误检由FITC发射的575nm左右波长的光,此时计算机会将此部分信号计入PE荧光信号中从而引起错误。同样PE受刺激后也会发出部分525nm左右的光,进入FITC荧光检测器中,此时就需要进行一系列仪器设置,人为地去除该部分干扰。现在商业提供的荧光直标抗体上所结合的FITC,PE等荧光分子性状十分接近,其发射光的光谱分布也十分稳定。通过一系列调节,可以推算出漏入其他荧光探测器的信号占本探测器信号的百分比,一旦设定该值,计算机会在其他探测器中减去根据本探测器信号乘以百分比后的数值。由于补偿前的信号都已经过放大电路处理,所以光信号可以被划为任何强度的电信号。同时又因为补偿电路在放大电路的后面,故补偿过程的百分比数值将由两部分决定,即原荧光探测器信号与流进的其他探测器的信号,计算公式为:
原探测器的信号×N%-漏进的其他探测器的信号=0
由此补偿的百分比数值将随着各荧光探测器的放大倍数(电压)变化而变化。特定电压对应特定的补偿参数,要确定补偿中百分比数值(N%),需要用以上补偿调节的原理结合特定的标本来实现。如进行FITC、PE双色分析,先准备阴性对照管(1)(图8-9)。
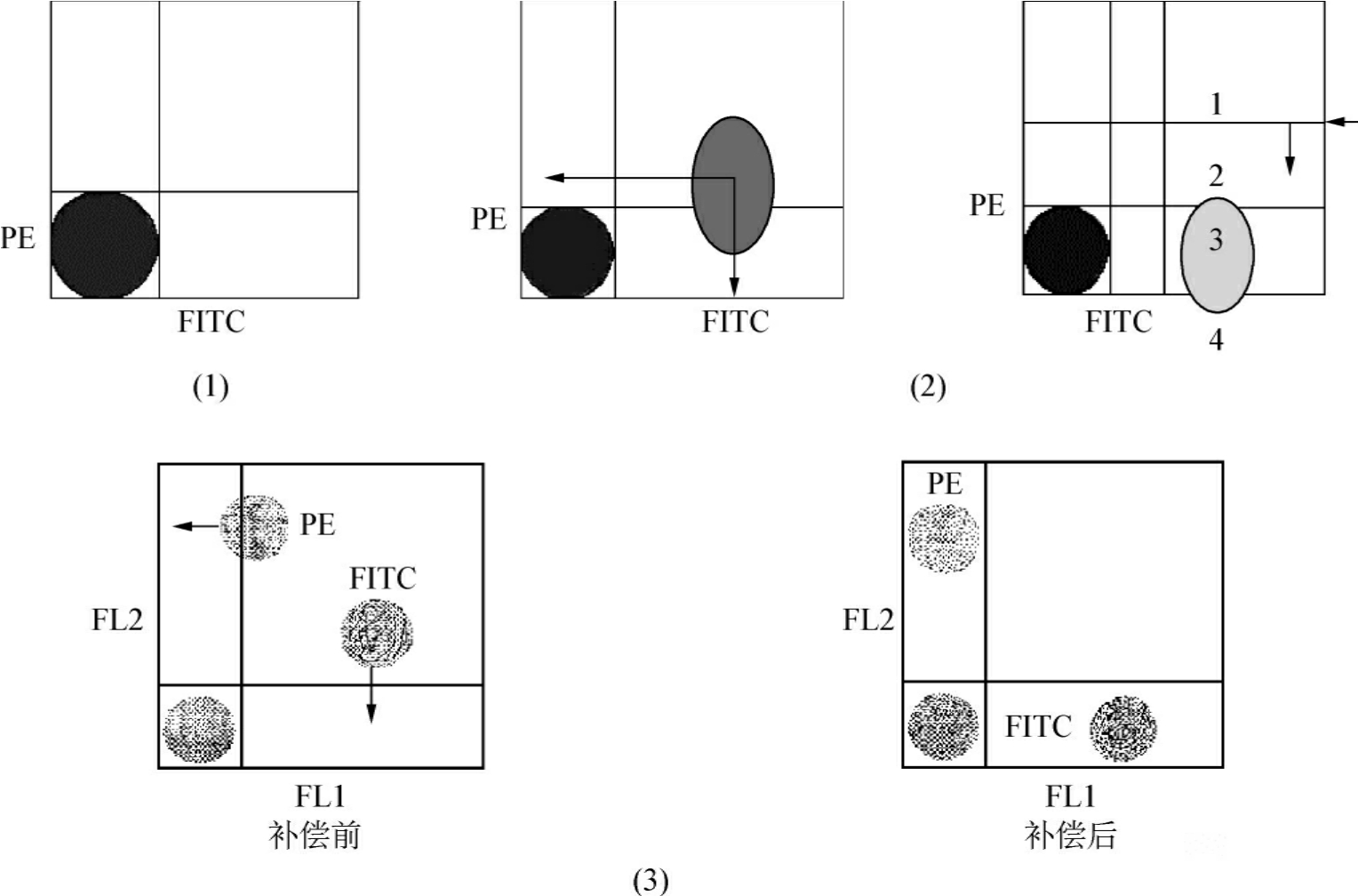
图8-9 光谱重叠补偿设置
注:Coulter用户用FastComp直接调节BD用户通过数字式调节补偿百分比
图中(1)管为FITC阴性对照/PE阴性对照,通过调节电压使阴性群落落在FITC及PE双阴性区。进行补偿时必须使原补偿全部归零。阴性对照的作用是调节各荧光探测器合适的放大倍数,即归零。
图中(2)管为FITC标记抗体/PE阴性对照。图8-9中图(1)为未调补偿的双参数直方图。如果在理想情况下,因为检测管中只含有PE标记的IgG阴性对照[如同图中(1)管一样],所以仍将没有任何信号出现,但实际情况并不如此,在PE坐标轴上出现了阳性信号。这个信号就是由于FITC荧光漏入PE探测器中而引起的。此时要取一合适的百分比与FITC信号相乘后去抵消PE中的信号。此时电压已通过阴性对照设定,绝不能动!调节补偿参数如图8-9(2)所示。此时补偿调节过头,PE的信号会比原来的本底还低,调节不足或过头都会造成结果不准确。当FITC漏入PE的信号恰好全都减除时,即PE信号与原来的本底相同时,此时的补偿是正确的,即FITC单阳性细胞的PE的平均荧光强度与双阴性细胞PE的荧光强度一致。对于FITC阳性的细胞,通过调节补偿将PE中的信号恢复为与其本底一致。调节荧光信号首先要知道双阴性细胞的情况,即通过图8-9(1)管调节电压确定阴性范围,其次在检测的FITC标记管中必须存在阳性细胞和阴性细胞,只有这样才能有本底参照将PE的信号降至与本底一致而不会过多或过少的补偿。
同理检测图8-9(3)管:FITC阴性对照/PE标记抗体,可将漏入FITC中的荧光滤出去,但前提条件是图8-9(3)管中要存在FITC/PE双阴性细胞和PE单阳性细胞。
在多荧光分析时必须做荧光之间的补偿,其补偿调节原理同上。如做FITC、PE、PE-Cy5三色荧光分析,原则上需要调节的补偿有:FITC—%PE、FITC—%PE-Cy5、PE—% FITC、PE—%PE-Cy5、PE-Cy5—%FITC、PE-Cy5—%PE等6组补偿。选用各种标记的荧光阴性对照,调节确定合适的放大电压,逐管加入各种荧光标记的特异性抗体与其他荧光的对照,然后调节特异性荧光对每个荧光的补偿。在日常应用中,可以用CD3/CD4/CD8多色抗体来调节荧光补偿。
三、自发荧光
未染色的细胞受到光照射后会发出自发荧光。用流式细胞计测定细胞的特异性荧光染料的荧光时,这种自发荧光对所欲测定的特异性荧光是一种本底信号。自发荧光在多种情况下都会干扰特异性荧光信号,尤其是对低水平结合的荧光抗体它会缩小染色的和未染色的细胞间的区别,使我们难以确定细胞中荧光信号的水平。自发荧光的强弱与细胞的大小、细胞的类型、激发光的波长、发射光的检测范围等都有关系。产生自发荧光的分子可能是正常细胞的组成成分如核黄素、细胞色素等。这些成分在较大的细胞中含量较多,相应的自发荧光也就强一些。培养的死细胞比活细胞的自发荧光要强,在某些组织如脾和骨髓细胞样品中,除了含有淋巴细胞和其他自发荧光的细胞外还可能会有一些占不同比例的亮细胞,它们会干扰用免疫荧光方法本应能检测出来的、稀有的和细胞数目较少的亚群。
为减少自发荧光,可选用较亮的荧光染料,还应使用与荧光发射光谱相匹配的光学品质优良的滤光片系统。利用较长波长的光线,也可减弱自发荧光。最后,对自发荧光还可用电子线路补偿的方法将自发荧光补偿掉。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















