(一)渗透现象和渗透压
当我们用一种能使溶剂分子通过而不使溶质分子通过的半透膜把一种溶液和它的纯溶剂分隔开时(或用半透膜把稀溶液和浓溶液分隔开),纯溶剂将通过半透膜扩散到溶液中使其稀释,这种现象叫做渗透。实际上,溶剂是同时沿着两个相反方向通过半透膜而扩散的,只不过纯溶剂向溶液的扩散速度要比相反方向的扩散(即溶剂分子从溶液向纯溶剂的扩散)速度大得多。许多动植物的膜,如萝卜皮、香肠的外皮和动物的膀胱,以及有些人造薄膜如火棉胶制成的薄膜和筒壁上沉积着亚铁氰化铜(Cu2[Fe(CN)6])沉淀的素烧瓷筒等,都可以用作渗透的半透膜。
图4-2是一个渗透现象实验装置。将一半透膜紧扎在漏斗管的口上,将漏斗内充入浓糖水并倒置在一杯水中。由于渗透作用,水将扩散而进入糖水溶液,可看到溶液体积逐渐增大,垂直的管子中液面上升。随着液柱的升高,压力增大,从而使漏斗中糖水溶液的水分子通过半透膜的速度增大,当压力达到一定的数值时,在单位时间内,水分子从两个相反方向通过半透膜的数目相等,体系达到平衡状态,可看做是渗透过程已经“终止”。这种刚刚可以阻止渗透过程进行所外加的压力叫做溶液的渗透压。
渗透压只有当溶液与溶剂被半透膜隔开时才能显示出来。如果用半透膜将稀溶液和浓溶液隔开,为了阻止渗透作用发生,必须在浓溶液液面上施加一压力,但此压力既不代表浓溶液的渗透压,也不是稀溶液的渗透压,而是两种溶液渗透压之差。
图4-2 渗透现象实验 1.渗透压;2.糖水溶液 3.半透膜;4.纯溶剂(水)
(二)渗透压与浓度、温度的关系
1886年,荷兰化学家范特霍甫(Van’t Hoff)根据实验结果指出:【在一定温度下,非电解质稀溶液的渗透压π和溶液的物质的量浓度成正比,与溶质的本性无关】。其数学表达式为:
π=cBRT(4-12)
式中,π是溶液渗透压,单位是kPa,cB是物质的量浓度,R是气体常数(8.314kPa·L·mol—1·K—1),T为绝对温度。
对于稀溶液来说,其物质的量浓度近似地与质量摩尔浓度相等,所以又有:
π=bBRT(4-13)
式中,R为8.314kPa·kg·mol—1·K—1
若cB用溶质的nB除以溶液体积V来表示,则式(4-12)可写成:
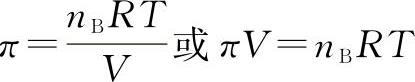
此式形式上与理想气体状态方程完全相同。但是,方程形式上的一致,决不意味着稀溶液的渗透压π与气体压强p相同,因为不仅它们产生的原因不同,而且测定它们的方法也不一样。气体压强p可以直接测定,而渗透压π只有在半透膜两侧分别存在溶剂和溶液时才能表现出来。
稀溶液的渗透压是相当大的,这往往令人惊奇。例如25℃时,0.1mol·L—1溶液的渗透压为:
π=0.1mol·L—1×8.314kPa·L·mol—1·K—1×298K=248kPa这相当于25m多高水柱的压力,可见渗透推动力是十分可观的。正因为有如此巨大的推动力,自然界才有高达几十米甚至百余米的参天大树。据说澳洲的桉树最高可达155m。
由于直接测定渗透压相当困难,因此对一般不挥发的非电解质摩尔质量的测定,常用沸点上升和凝固点下降法。但对高分子化合物的测定,因为待测的某些极高分子量的物质,一般物质的量浓度很小,这时用渗透法有其独特的优点。
【例4-11】人的血浆在272.44K结冰,求在体温310K(37℃)时的渗透压。
解:水的凝固点为273K,故血浆的ΔTf为:
可见人体血液在37℃时的渗透压是776kPa。
【例4-12】将1.00g血红蛋白溶于水中,配成100ml溶液,在293K时测得溶液渗透压为0.366kPa,求血红蛋白的摩尔质量。
血红蛋白的摩尔质量为66557g·mol—1。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















