莽草酸的微生物代谢工程
范长胜(1) 辛及娣 苑兴卉
(复旦大学生命科学学院微生物系 上海 200433)
摘要:利用微生物发酵法生产莽草酸是一条非常有效的途径,但目前还处于起步阶段。发酵法生产莽草酸大都集中在大肠杆菌的研究,也有以枯草芽孢杆菌和柠檬酸杆菌为研究对象的报道。莽草酸的代谢工程研究几乎都是利用莽草酸激酶基因缺陷菌株,这类工程菌株以葡萄糖为碳源生产莽草酸的产率最高达84 g/L,糖酸转化率为0.33 mol/mol。此外,也可利用EPSP合成酶基因缺陷菌株进行莽草酸生产。莽草酸生物合成途径还可被用于其他相关代谢物的产品开发研究,包括奎宁酸(quinic acid) 、原儿茶酸(protocatechuate) 、儿茶酚(catechol) 、没食子酸(gallic acid)和焦没食子酚(pyrogallol) 。莽草酸是抗病毒药物Tamiflu的合成原料,也是许多手型药物合成中间体,莽草酸本身具有消炎和镇痛作用。莽草酸代谢途径的研究意义重大,它已经用于芳香氨基酸(Trp、Tyr,Phe)生产,还将用于多种与莽草酸途径相关的高价值产品生产。
关键词:莽草酸;代谢工程;大肠杆菌;枯草芽孢杆菌;柠檬酸杆菌
莽草酸是抗病毒首选药物——达菲(Tamiflu)合成的原料,由于禽流感的爆发导致莽草酸市场一度供不应求。除此之外还有抗炎,镇痛作用;作某些抗肿瘤、心血管的新药原料。目前莽草酸是从八角中提取的,来源有限。利用微生物发酵法生成莽草酸与从八角中提取方法相比优势明显:例如发酵原料易得,生产周期短,产品质量稳定,生产规模大,不受季节气候地理环境影响。因此,利用微生物生产莽草酸是经济有效的途径。
1 莽草酸的生物合成与代谢工程
莽草酸的生物合成途径如图1所示。莽草酸(SHIK (Shikimic acid))是芳香氨基酸共用合成途径中第一个分离并鉴定到的化合物,因此,这条途径被称为莽草酸途径。它存在于微生物和植物代谢过程中,用于合成L-苯丙氨酸、酪氨酸和色氨酸以及其他生物质。该途径受芳香化合物的严密调控。
这条芳香氨基酸合成途径起始于磷酸烯醇丙酮酸(PEP)和赤藓糖4磷酸(E4P)缩合生成3-脱氧-D-阿拉伯糖型庚糖酸-7-磷酸(DAHP) 。在大肠杆菌中,存在三种同功的DAHP合成酶,分别由aroF,aroG和aroH基因编码。而三个基因又分别被三个末端产物苯丙氨酸、酪氨酸和色氨酸的反馈抑制。在枯草芽孢杆菌中DAHP合成酶由aroA (G)编码,受该途径的中间产物分支酸抑制。
E.coli脱水奎宁酸合成酶由aroB编码,它催化DAHP转化为3-脱氢奎宁酸(DHQ) 。DHQ脱水酶由aroD编码,催化脱水反应合成3-脱氢莽草酸(DHS) 。紧接着,由(E.coli) aroE编码的莽草酸脱氢酶利用NADPH将DHS还原合成莽草酸。由aroK和aroL编码的两个同功酶-莽草酸激酶分别催化合成莽草酸-3-磷酸(S3P)和5-烯醇丙酮酰-莽草酸-3-磷酸(EPSP) 。再由aroA编码的EPSP合成酶催化合成该途径分支点的产物-分支酸(CHA) 。
大肠杆菌中的DHQ合成酶、DHQ脱水酶和莽草酸脱氢酶是组成型表达,而DAHP合成的三个同功酶以及莽草酸激酶II则是受转录调控的,莽草酸脱氢酶受莽草酸的反馈抑制调控。已经确认的大肠杆菌莽草酸合成途径的限速酶有DHQ合成酶(aroB编码)和莽草酸激酶(aroL和aroK编码) 。
目前有两种不同策略用于莽草酸的菌种构建。第一种是机理上非常明确的,即通过剔除莽草酸激酶基因来阻断莽草酸合成S3P的反应,从而达到积累莽草酸的目的。这一方法效果显著,Draths et al将大肠杆菌中的两个莽草酸激酶基因全都剔除,构建了大肠杆菌生产莽草酸的工程菌株; Iomantas et al利用随机诱变筛选到芽孢杆菌中莽草酸激酶基因缺失菌株;还有Shirai et al使用同样的手段构建了柠檬酸杆菌的产莽草酸工程菌株,均获得了产莽草酸的菌种。
第二种是通过EPSP合成酶失活来切断S3P之后的芳香氨基酸的合成途径,从而使中间产物S3P积累转化形成莽草酸,这是由于细菌中的磷酸化酶活性导致S3P脱磷转化为莽草酸(Iomantas et al) 。这种工程菌株构建策略也有人用于枯草芽孢杆菌和大肠杆菌。
大肠杆菌是目前利用代谢工程原理进行微生物发酵生产莽草酸最成功的例子。在该菌种的芳香氨基酸合成途径中编码莽草酸激酶I和II的两个基因aroK和aroL均被敲除了(Draths et al) 。为了增加碳代谢中间物从中心途径更多地流向莽草酸途径,途径上游导入了一个反馈抑制被解除的DAHP合成酶基因aroFfbr。这一抗性基因和编码DHQ合成酶基因aroB配合使得aroK基因敲除菌株消除极性效应,克服DHQ合成酶催化的限速反应。此外,还扩增了编码莽草酸脱氢酶基因aroE,用于增强合成过程中抗莽草酸反馈抑制的作用。
莽草酸脱氢酶的高表达同时还可以降低脱氢莽草酸转化为奎宁酸,因为奎宁酸的生成会导致中间代谢物分流从而降低莽草酸的产量。对于莽草酸生产来说是一个副反应,这一反应类似于肺炎克氏菌的奎宁酸脱氢酶催化的反应。有意义的是利用这步反应在大肠杆菌中已构建了一条利用葡萄糖发酵生产奎宁酸的有效途径(Draths,Ran et al) 。
伴随着莽草酸发酵生产(27g/L)的副产物最多的是脱氢莽草酸(4.4g/L)和奎宁酸(12.6g/L) 。副产物严重影响莽草酸的产量提高,尤其是奎宁酸消减了合成途径下游生成莽草酸的代谢流量。除此之外,副产物还影响后工艺的莽草酸结晶反应,因而会降低莽草酸的纯度和质量(Knop et al) 。Draths et al.为了研究莽草酸生产菌株的莽草酸和副产物之间的关系,曾经在培养基中添加莽草酸为碳源,获得的结果表明该菌株可以利用莽草酸合成奎宁酸和脱氢莽草酸。对于结果的解释是莽草酸生产菌株的莽草酸和这两种副产物之间处于一种动态可逆的平衡状态。为了验证莽草酸、奎宁酸和脱氢莽草酸的合成是否需要这种平衡,研究者将大肠杆菌的莽草酸生产菌株的aroFfbr基因敲除,抑制DAHP合成酶(AroF,AroGand AroH)活性等方法,来阻止莽草酸全程合成。然后观察莽草酸、奎宁酸和脱氢莽草酸之间的产物比值变化,结果证明了莽草酸可以由培养基直接提供给菌种利用,事实上这三种化合物之间的合成途径是相通的可逆的。
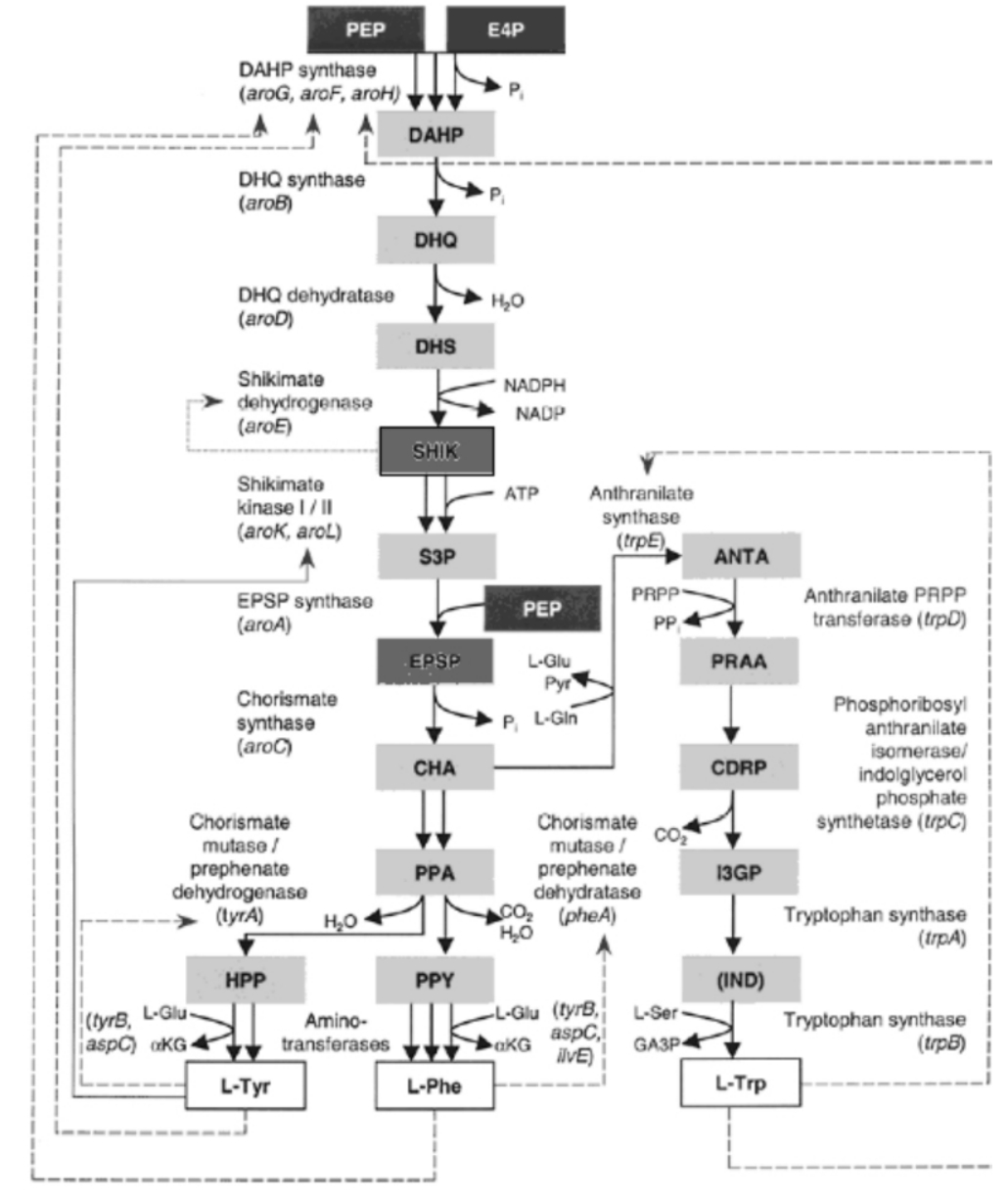
Fig. 1. Pathway of aromatic amino acid biosynthesis and its regulation in E.coli. To indicate the type of regulation, different types of lines are used: ---, transcriptional and allosteric control exerted by the aromatic amino acid end products;· · ·, allosteric control only; -, transcriptional control only. Abbreviations used: ANTA, anthranilate; aKG, aketoglutarate;CDRP,1-(o-carboxyphenylamino)-1-deoxyribulose 5-phosphate; CHA, chorismate; DAHP, 3-deoxy -d -arobino -heptulosonate 7 -phosphate;DHQ,3 -dehydroquinate; DHS,3 -dehydroshikimate;EPSP,5 enolpyruvoylshikimate3-phosphate; E4P, erythrose4 -phosphate;GA3P, glyceraldehyde 3-phosphate; HPP, 4-hydroxyphenlypyruvate, I3GP, indole 3 -glycerol-phosphate; IND, indole; l-Gln, l-glutamine; l-Glu, l-glutamate; l-Phe, l-phenylalanine; l-Ser, l-serine; l-Trp, l -tryptophan; l -Tyr, l -tyrosine; PEP, phosphoenolpyruvate; PPA, prephenate; PPY, phenylpyruvate; PRAA, phosphoribosyl anthranilate; PRPP, 5-phosphoribosyl-α-pyrophosphate; Pyr, pyruvate; SHIK, shikimate; S3P, shikimate 3-phosphate.
2 莽草酸生物合成的影响因素
2.1 葡萄糖对莽草酸合成的影响
大肠杆菌的莽草酸运输受葡萄糖的分解阻遏作用,因此,过高的葡萄糖浓度可能会阻遏莽草酸的运输效率,也可降低奎宁酸的生成。事实发现提高葡萄糖的使用浓度之后,莽草酸的产量降低大约25%,奎宁酸的生成量则很快降低90%,但另一副产物脱氢莽草酸的量没有减少。
2.2 葡萄糖类似物的作用
根据莽草酸运输受葡萄糖分解阻遏机理的理论推测,在生产莽草酸的大肠杆菌培养基中添加葡萄糖类似物甲基葡萄糖吡喃糖苷(methyl-α-D-glucopyranoside)可减少莽草酸的耗损(吸收)量。实验发现,当甲基葡萄糖吡喃糖苷添加到培养基之后,奎宁酸的形成显著地减少,从19 g/L降到2.8 g/L;而莽草酸产量从28 g/L提高到35 g/L,对葡萄糖的转化率从0.14提高到了0.19 mol/mol。
2.3 莽草酸运输基因shiA的缺失效应
当芳香氨基酸合成途径上游的前三步反应的任何一步被阻断时,莽草酸可作为碳源用于大肠杆菌的芳香氨基酸和芳香族维生素的合成,这种补偿能力与莽草酸运输系统有关,这一运输蛋白由shiA基因编码。为此,使莽草酸运输系统失活是防止胞外的莽草酸重新吸收进入胞内的一条有效途径。Knop et al研究了同一菌种的shiA基因激活或缺失状态下加入大量莽草酸对其他副产物形成的影响。两者比较,发现完整shiA基因菌株副产物平衡能力低于shiA缺失菌株。但是实验也证实基因缺失菌株中的莽草酸的运输与副产物平衡现象仍然存在,它不依赖于shiA基因存在与否。这种观察结果表明菌株中还可能存在另外一种莽草酸运输系统。
2.4 代谢途径的中间产物的相互转换
Knop et al研究了植物中AroDE双功能酶底物传递对3-脱氢莽草酸(3-dehydroshikimate(DHS))支路产物的影响。在烟草中aroDE编码3-脱氢奎宁酸(3-dehydroquinate(DHQ))脱水酶和莽草酸脱氢酶,将这一编码双功能酶的基因导入缺失aroD和aroE的产莽草酸的大肠杆菌。发现3-脱氢奎宁酸(DHQ)的运输与莽草酸的形成直接相关,因此细胞质中DHS的积累量并不重要。然而,实验观察到脱氢莽草酸底物量仍可维持在导致莽草酸抑制莽草酸脱氢酶的水平。相比之下,菌株中的奎宁酸形成则减少,这可能是烟草AroDE酶活性的选择性所致,它们在烟草中偏向于降低DHS向莽草酸的转化而不是3-脱氢奎宁酸向莽草酸的转化。
2.5 糖代谢中心途径对莽草酸合成的作用
莽草酸发酵产量可以通过增加中心代谢途径的中间物E4P和PEP的有效性得到提高,因为E4P和PEP是莽草酸途径起始的第一步缩合反应的两个底物。在丰富的葡萄糖培养基中,高表达转酮醇酶基因(tktA)也就意味着增加E4P的合成量,从而导致羟基芳香化合物总量的增加,这些化合物包括莽草酸、奎宁酸、脱氢莽草酸,糖酸转化率从0.15增加到0.24 mol/mol (最大理论转化率为0.43 mol/mol) ,其中莽草酸的量从0.12增加到0.18 mol/mol,产率从38提高到52 g/L。 Chandran et al.报道莽草酸对葡萄糖的转化率理论化学计量值可从0.43提高到0.86 mol/mol,为了提高莽草酸的产量,采用两种策略也可提高PEP的利用效率。第一种方式是利用PEP合成酶(ppsA编码)使丙酮酸重新生成PEP,从而使莽草酸产量大幅提高,达到66g/L,转化率为0.23 mol/mol。第二种方式是改变以消耗PEP为代价的葡萄糖运输系统。
2.6 细菌的葡萄糖运输(吸收)系统对莽草酸合成的作用
大肠杆菌吸收葡萄糖是依赖于PTS系统消耗PEP进行的。要提高PEP利用的有效性,应该通过PEP以外的物质来使系统失活或者取而代之,例如利用ATP依赖性吸收和磷酸化系统,它来源于运动单胞菌的葡萄糖促进吸收蛋白(glucose facilitator(Glf)和葡萄糖激酶(glucokinase(Glk))组成的系统(Gibson,Chandran et al) 。结合tktA基因高表达的运用,可使得莽草酸的发酵含量达到71 g/L,转化率达0.27 mol/mol。在10 L规模的无机盐发酵培养基中补充酵母提取物也可以提高发酵产量,莽草酸从原来的62 g/L提高到了84 g/L,转化率从0.26提高到0.33 mol/mol。
有人研究Glf介导的葡萄糖运输系统对菌株发酵产量的影响,将运动单胞菌的glk基因导入PTS运输系统完整的大肠杆菌中,考察gik对PTS系统是否有影响。结果使莽草酸产量反而下降到46 g/L,转化率为0.21 mol/mol。原因可能是高浓度的葡萄糖-6-磷酸形成,以及紧随着丙酮酸激酶、丙酮酸脱氢酶、磷酸转乙酰基酶和乙酸激酶的有序催化作用使得PEP过于丰富,反而导致莽草酸量降低而乙酸增加(Chandran et al) 。不导入外源基因而仅仅利用大肠杆菌的葡萄糖激酶(Glk)的磷酸化作用也可使莽草酸产量提高(70 g/L) ,转化率可达0.24 mol/mol,也不存在乙酸积累的问题。这可能与葡萄糖-6-磷酸形成和PEP产生速率降低有关(Chandran et al) 。
3 利用5-烯醇丙酮酰-莽草酸-3-磷酸(EPSP)合成酶缺陷菌株生产莽草酸
Davis和Mignioli观察到aroA缺失的大肠杆菌可以分泌S3P到培养基中,收集该菌的发酵上清液,加热或者酸化,即可使S3P转化为莽草酸。因此,莽草酸生产也可以通过阻断合成途径中的EPSP合成酶来实现。这种利用EPSP合成酶缺失菌株生产莽草酸的报道不多。Iomantas et al报道EPSP合成酶活性丧失的枯草芽孢杆菌可积累1.1 g/L莽草酸,0.2 g/LDHS,但没有检测到S3P,推测原因可能是S3P脱磷酸后转化成了莽草酸。为克服合成莽草酸途径中的反馈抑制现象,一种来自淀粉液化芽孢杆菌(B. amyloliquefaciens)的莽草酸脱氢酶引入上述菌中,该基因大量表达之后可提高产量,莽草酸浓度达到2.8 g/L,而副产物DHS为1.1 g/L。
利用莽草酸激酶缺失的大肠杆菌生产莽草酸的不足之处是副产物DHS的生成量较高,这是由于DHS和莽草酸合成之间具有平衡反应机制。但是,S3P的产生可以打破DHS和莽草酸合成之间平衡,使反应朝着S3P合成方向进行。为了利用S3P的转化来生产莽草酸,Kramer et al.构建了一种EPSP合成酶缺陷型的大肠杆菌,菌株的合成S3P的代谢调控被解除,它的DAHP合成酶(AroFfbr) ,DHQ合成酶(AroB)和莽草酸激酶II(AroL)均是抗反馈抑制的,发酵48小时后,莽草酸和S3P的总含量高达20g/L。这条技术路线可以降低DHS的生成比例,总酸(莽草酸,S3P,DHS)的转化率约为40%。
为了进一步降低细菌细胞内DHS含量,有人构建了一株莽草酸运输酶基因shiA被破坏的E.coli菌株,它不能从胞外吸收莽草酸,这样可防止培养基中的莽草酸再进入胞内,使胞外莽草酸积累增加。然而实验数据表明shiA基因缺失并没有改变DHS与莽草酸(包括S3P)合成的平衡,两者浓度比值没有任何改善。该实验结果与其他实验手段得到的结果是一致的,由此推断大肠杆菌不止一个莽草酸运输系统。
4 枯草芽孢杆菌和弗氏柠檬酸杆菌的莽草酸代谢工程
类似于大肠杆菌利用葡萄糖发酵生产莽草酸的枯草芽孢杆菌(Bacillus subtilis)也有报道。与大肠杆菌不同之处是,它仅需要进行一个莽草酸激酶基因(aroI)的缺失。 Iomantas et al报道一株枯草芽孢杆菌aroI缺陷菌产莽草酸达8.5 g/L,但是副产物DHS高达9.5 g/L,DHS与莽草酸产量之比值达1.1。将自体的DAHP合成酶基因aroA (G)基因通过质粒载体导入aroI缺失的枯草芽孢杆菌中,结果导致DHS与莽草酸产量之比值更高(2.7) 。推测这是莽草酸抑制了莽草酸脱氢酶所致,这种抑制作用不受莽草酸浓度的影响。然而,将淀粉液化芽孢杆菌的莽草酸脱氢酶基因导入枯草芽孢杆菌中高表达,则成功地提高了莽草酸的含量,达到14g/L,而DHS只有6.8 g/L,DHS与莽草酸产量之比值降到了0.48。Iomantas et al还将aroD整合到染色体上,再通过质粒引入aroA (G)基因,这样工程菌的莽草酸发酵浓度达到19.7 g/L,但副产物DHS的含量也有9.8 g/L。 Shirai et al利用弗氏柠檬酸杆菌(Citrobacter freundii)进行基因工程改造用于生产莽草酸也有报道,莽草酸产量可达到10 g/L。
5 微生物发酵生产莽草酸的结论与展望
莽草酸的发酵生产是在代谢途径工程原理指导下构建微生物工程菌株,用于生产高价值产物的一条经济有效途径。目前,发酵法生产莽草酸的代谢工程大都集中在大肠杆菌的研究,达到了工业化生产水平。也有少量报道利用枯草芽孢杆菌和柠檬酸杆菌来生产莽草酸。
尽管有报道利用EPSP合成酶缺陷菌株来生产莽草酸,但目前几乎所有的生产菌都是利用莽草酸激酶缺陷菌株,最好菌株是以葡萄糖为碳源生产莽草酸,其产率达到84 g/L,糖酸转化率为0.33 mol/mol (Chandran et al) 。
作为芳香氨基酸合成途径上的一种中间代谢物,莽草酸生产的不同于芳香氨基酸的生产。它的副产物是由于菌种自己代谢平衡反应或者其他代谢分支酶催化的结果,而非与高流量代谢产物相关的中间代谢物降解所引发的。除了应用代谢工程生产莽草酸之外,作为芳香氨基酸合成途径的中间代谢物的其他产品也已在进行开发研究,例如奎宁酸(quinic acid) 、原儿茶酸(protocatechuate) 、儿茶酚(catechol) 、没食子酸(gallic acid)和焦没食子酚(pyrogallol) (见图2) 。
通过引入或者高表达脱氢奎宁酸脱氢酶基因可以构建一条奎宁酸合成途径,该酶由肺炎克氏菌的qad基因编码;也可高表达大肠杆菌莽草酸脱氢酶基因aroE来实行。以脱氢莽草酸为起点,芳香氨基酸途径可以延伸,引入肺炎克氏菌的DHS脱水酶基因能形成原儿茶酸,利用肺炎克氏菌的原儿茶酸脱羧酶基因aroY,又可使原儿茶酸转化为儿茶酚(Draths and Frost) 。
利用铜绿假单胞杆菌(Pseudomonas aeruginosa)变异株编码的p-羟基苯甲酸羟基化酶(p-hydroxybenzoate hydroxylase)基因pobA的活性可使原儿茶酸转化成没食子酸。通过原儿茶酸脱羧酶的引入又可以进一步将没食子酸转化成焦没食子酚。这些代谢工程菌构建的例子表明利用莽草酸途径开发生产新产品的范围正在不断扩大,莽草酸的微生物代谢工程研发大有发展前途(Kambourakis et al) 。

Fig. 2. Pathway of aromatic amino acid biosynthesis to 5 -enolpyruvylshikimate -3 -phosphate in E. coli and eterologous pathways to hydroaromatic and aromatic compounds derived thereof (indicated as dashed arrows) . Abbreviations:E4P,erythrose-4-phosphate;PEP,phosphoenolpyruvate;DAHP,3-deoxy-d-arabino-heptulosonate-7-phosphate; DHQ,3-dehydroquinic acid; DHS,3-dehydroshikimic acid; SA,shikimic acid; S3P,shikmate-3-phosphate; EPSP,5-enolpyruvylshikimate-3-phosphate; QA,quinic acid; PCA,protocatechuate; GA,gallic acid. Genes: aroF,DAHP synthase(l-tyr) ; aroG,DAHP synthase(l-phe) ; aroH,DAHP synthase(l-trp) ; aroA,DHQ synthase; aroD,DHQ dehydratase; aroE,shikimate dehydrogenase; aroL,shikimate kinase II; aroK,shikimate kinase I; aroA,EPSP synthase; qad,dehydroquinate dehydrogenase; aroZ,dehdroshikimate dehydratase; aroY,protocatechuate decarboxylase; pobA,mutant p-hydroxybenzoate hydroxylase.
参考文献(省略)
1,Marco Kra¨mer,Johannes Bongaerts,Roel Bovenberg,et al. Metabolic engineering for microbial production of shikimic acid. Metabolic Engineering,2003,5:277~283
2,Louise Johansson,Anna Lindskog,GustavSilfversparre,et al. Shikimic Acid Production by a Modified Strain of E. coli (W3110.shik1)Under Phosphate-Limited and Carbon-Limited Conditions. Biotechenology and Bioengineering,2005,92 (5) :541~552
【注释】
(1)通讯地址:上海市杨浦区邯郸路220号,电话: 021-55664536,Email: csfan@fudan.edu.cn
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















