L-赖氨酸发酵过程氮源控制的研究
孙玉华1 冯志彬1 徐庆阳1 陈宁1,2
(1.天津科技大学生物工程学院; 2.天津市工业微生物重点实验室 天津 300222)
摘要:谷氨酸棒杆菌TK12发酵生产L-赖氨酸过程中,(NH4)2SO4浓度直接影响到L-赖氨酸的积累,但是关于氨基酸发酵过程中氮源控制的研究只是简单地通过对最终结果的比较得到的结论而缺少对过程的深入分析,本文在发酵过程动力学基础上,通过控制硫酸铵浓度而对产酸影响的研究,比较了几种补加硫酸铵的方式,提出了较佳的控制模式。
关键词:氮源;流加发酵; L-赖氨酸;谷氨酸棒杆菌
L-赖氨酸是人体和动物不能合成的八种氨基酸之一。赖氨酸在食品或饲料中含量不足时会降低其他氨基酸的利用率,导致蛋白质合成障碍,使人和动物生长发育受到严重影响,故它被认为是谷物蛋白的第一限制性氨基酸,广泛应用于饲料、食品和医药等行业[1,2]。本文在分析TK12在10L罐发酵过程参数变化的基础上,结合菌株TK12发酵生产的特点,进一步研究了L-赖氨酸合成期不同的硫酸铵流加参数对L-赖氨酸合成影响,以期能得出较佳的无机氮源流加策略,从而提高L-赖氨酸的生产率和糖酸转化率。
1 材料和方法
1.1 菌种
L-赖氨酸产生菌为谷氨酸棒杆菌(Corynebacterium glutamicum) TK12,天津科技大学代谢控制发酵研究室保藏菌种。
1.2 培养基(g/L)
种子培养基:蔗糖20.0,玉米浆(含氮2.0%) 30.0ml,(NH4)2SO42.0,乙酸6.0 MgSO4·7H2O0.4,KH2PO41.0,L-丙氨酸0.35,味精0.1,FeSO4· 7H2O 0.01,MnSO4· H2O 0.01,生物素0.1mg/L,菸酰胺5mg/L,硫胺素0.2mg/L,pH7.0~7.2,0.1Mpa,15min。
发酵培养基:葡萄糖120.0,玉米浆(含氮2.0%) 40.0ml,(NH4)2SO445.0,KH2PO43.0,MgSO4· 7H2O1.5,FeSO4· 7H2O 0.015,MnSO4· H2O 0.015,生物素0.8mg/L ,菸酰胺0.8mg/L,硫胺素0.45mg/L,pH7.0~7.2,0.1Mpa,15min。
1.3 培养方法
种子罐培养:吸取适量无菌生理盐水于活化斜面中,将所有菌悬液全部接入5L发酵罐中,搅拌转速300~600/min,培养温31.5±0.5℃,流加25%的氨水以控制pH在7.0左右。
10L发酵罐培养:初始装液量5.4L,接种量为10%,通气量为1.0L/min。通过自动流加25%氨水控制控制pH在7.0左右,培养温度31.5±0.5℃,每隔2~3小时取样检测残糖浓度,采逐次流加葡萄糖的方法维持残糖浓度在1.0%~2.0%之间。
1.4 分析方法
pH值:采用酸度计测定。
菌体生长量(OD620) :吸取样品菌液0.2ml注入9.8ml水中,摇匀后于620nm处测定吸光度。
还原糖: SBA-40C生物传感分析仪测定。NH4+浓度:改进后的Berthelot反应法[3]。L-赖氨酸含量:纸层析法、氨基酸分析仪测定。
2 结果与讨论
2.1 赖氨酸产生菌TK12发酵过程分析
初始硫酸铵浓度为20g/L,整个过程只以pH反馈流加25%氨水以补充氮源。发酵过程曲线如图1。
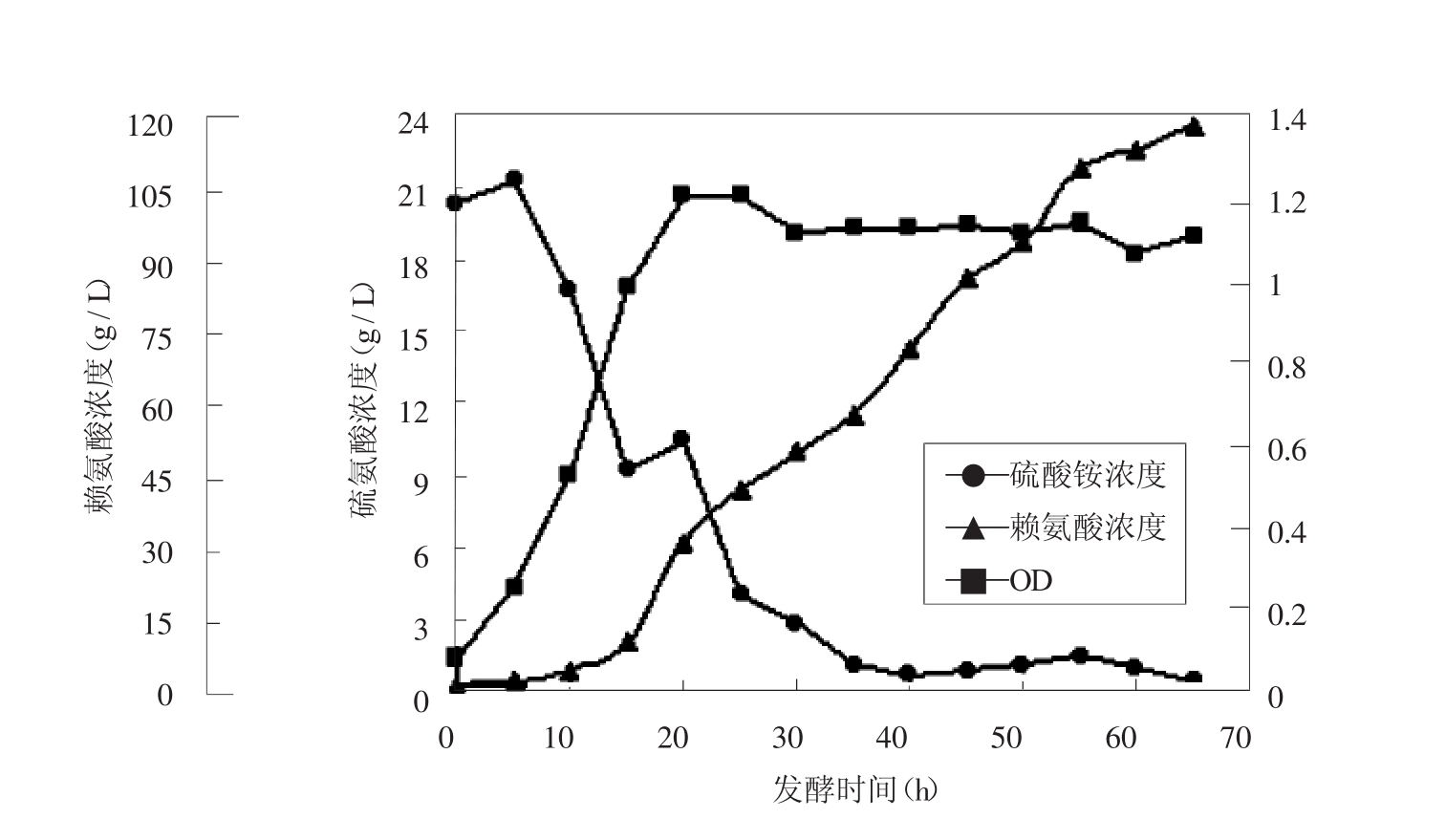
图1 TK12发酵过程曲线
L-赖氨酸发酵过程是典型的动力学Ⅱ型,从谷氨酸棒杆菌TK12合成L-赖氨酸的过程来看(图1) ,前期主要是菌体生长繁殖,很少产酸,铵氮主要用于菌体生长,而氨水的补入使得硫酸铵在一段时间内维持在9g/L左右。20h后菌体浓度达到最大值,发酵进入产酸期,此时硫酸铵浓度消耗的速度加快,氨水的补入速率明显跟不上铵根离子的消耗速率。30h以后硫酸铵维持在很低的浓度,低于3g/L。低浓度的硫酸铵不能满足发酵产酸的需求,因为硫酸铵不但可以用作氮源,而且NH4+和SO42-可激活赖氨酸合成的关键酶之一的天冬氨酸激酶[4],控制合适的浓度有利于获得较大的赖氨酸生产强度。
2.2 硫酸铵非反馈型控制和反馈型控制方式的比较
2.2.1 采用中后期一次性补加氮源的方式
在相同的葡萄糖流加条件下,硫酸铵为被控氮源,总是都为60g/L.比较了初始硫酸铵浓度分别为10g/L、20g/L、30g/L、40g/L,24小时后一次补入剩余量对发酵的影响,硫酸铵变化过程如图2。
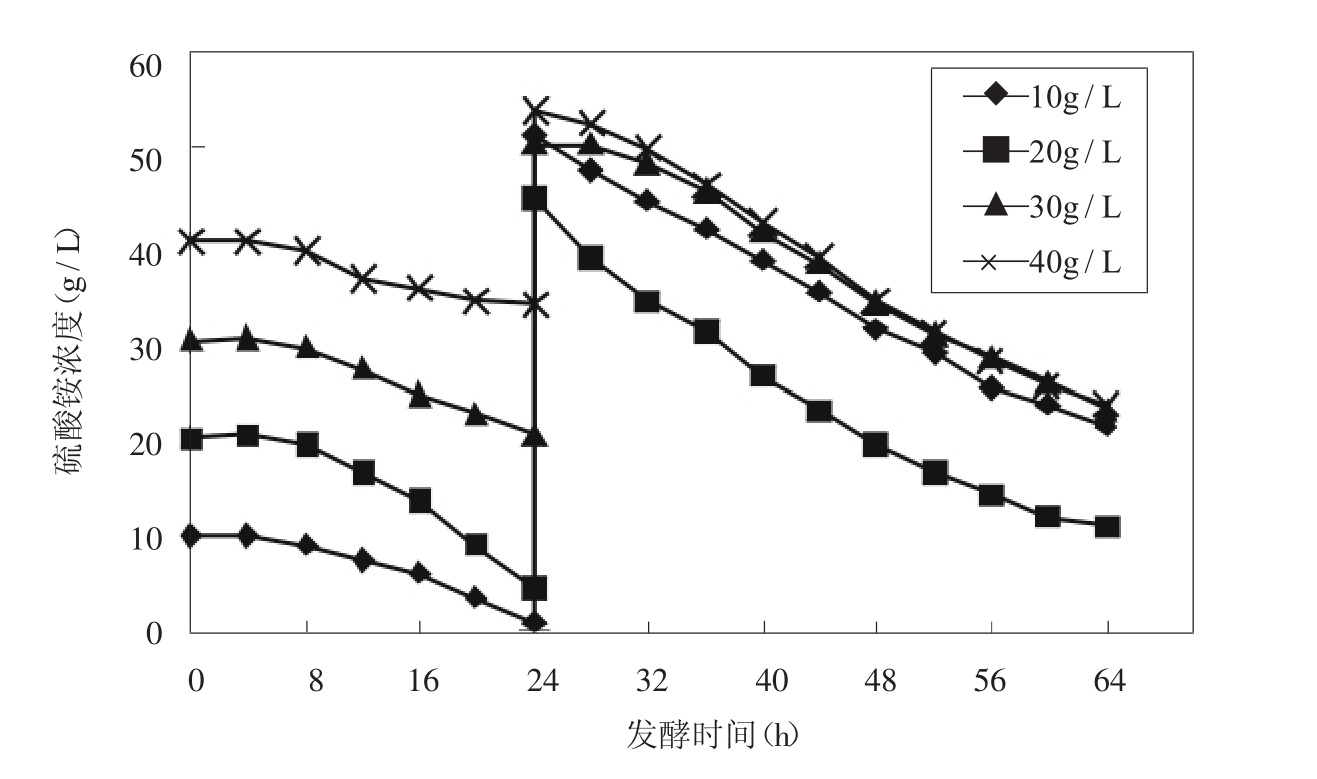
图2 硫酸铵浓度变化过程曲线
表1 硫酸铵的初始浓度及一次补加量对产酸的影响

因为TK12发酵生产赖氨酸对硫酸铵的需求比较高,一次补加控制方式使得硫酸铵浓度前低后高(图2) 。初始浓度为30g/L、40g/L时,整个过程硫酸铵一直保持较高的浓度,细胞生长环境中过高的离子(NH4+)会影响物质代谢特征、代谢过程中关键酶的活性和细胞中某些成分的生成[5],从而影响菌体生长和赖氨酸的积累。故初始硫酸铵浓度为较高30g/L,40g/L时,菌体浓度和产酸量都比较低(表1) 。L-赖氨酸发酵过程分为两个阶段,发酵前期为长菌期,较低浓度的硫酸铵有利于菌体生长,直接影响到菌体最终浓度;中后期以产酸为主,较高浓度的硫酸铵会严重影响到L-赖氨酸的生成。
2.2.2 采用恒速流加的方式
在相同的葡萄糖流加条件和初始硫酸铵浓度下,比较了以不同速率流加硫酸铵对发酵的影响。在发酵中后期,以相同体积流速补加不同浓度的硫酸铵溶液,使流加硫酸铵的速率达到5g/h,10g/h,15g/h,在流加发酵过程中铵浓度呈现波峰状态变化(如图3) 。
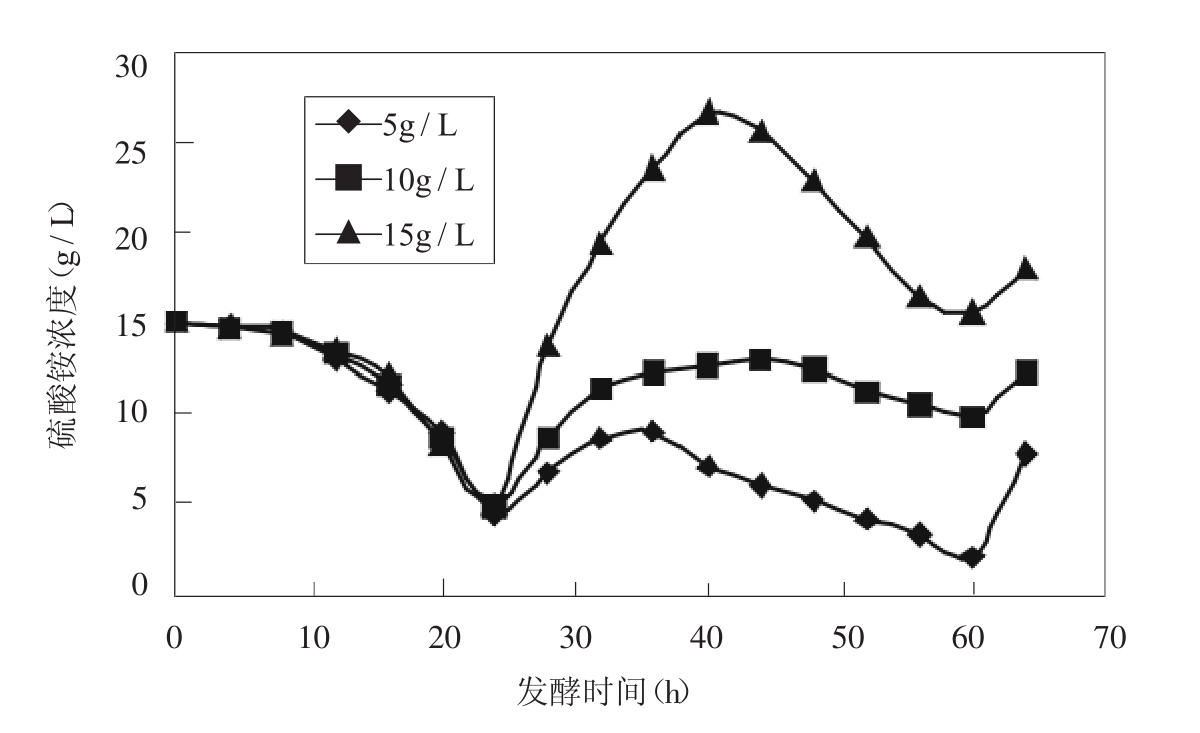
图3 不同补铵速度对硫酸铵浓度的影响
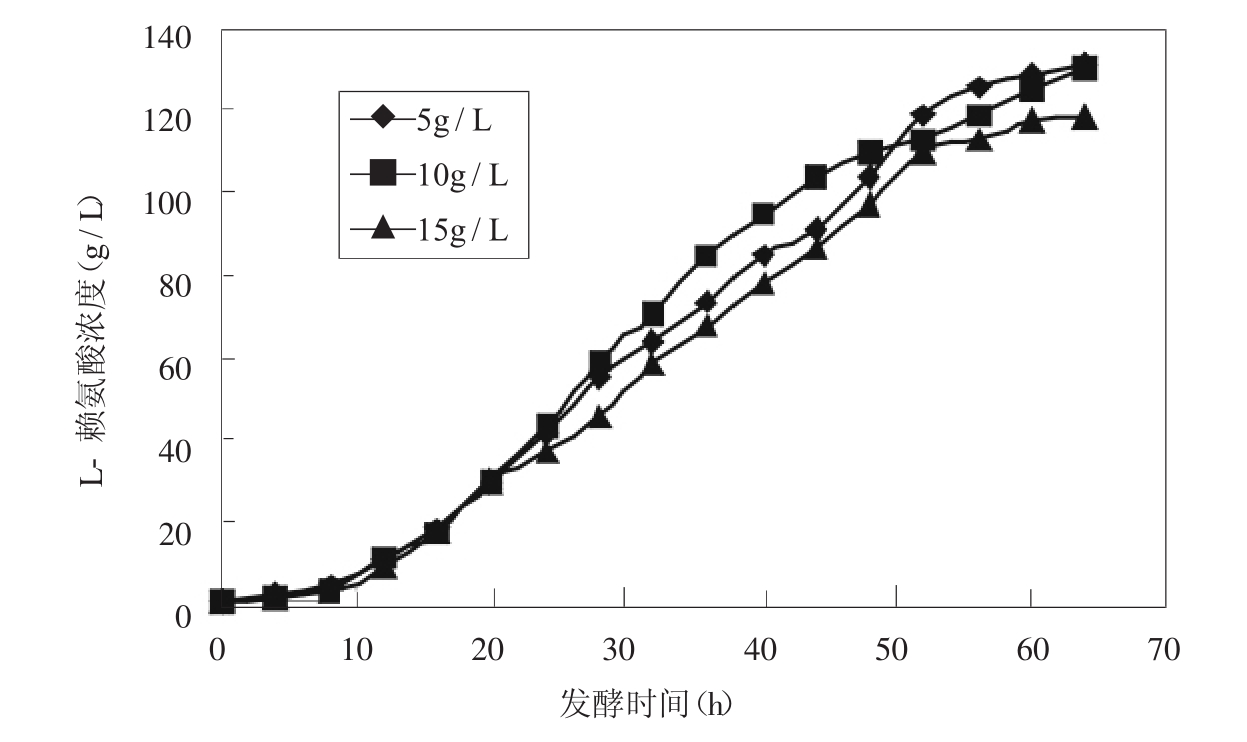
图4 不同补铵速度对赖氨酸产量的影响
流速5g/h时的硫酸铵一直低于0.9%。流速维持为10g/h时,硫酸铵补入速率与消耗速率大致相等,使得硫酸铵浓度变化幅度不大,浓度在1.0%~1.5%之间变化;流速为15g/h时,硫酸铵浓度为波形变化明显,主要在1.5%~3.0%之间波动。从它们产酸情况来看,5g/h,10g/h恒度流加时对产酸没有明显影响15g/h恒速流加时因为硫酸铵浓度偏高,影响了L-赖氨酸的生成。由图4,我们发现48h前10g/h的速度流加硫酸铵也就是说硫酸铵浓度维持在1.0%~1.5%之间时有利于产酸,48h后低硫酸铵浓度,处于0.5%左右时有利于L-赖氨酸的积累,因此在发酵中后期硫酸铵含量分阶段控制更为合理。
2.2.3 采用恒定浓度控制方式
在相同的初铵浓度和流加糖的条件下,用改进后的Berthelot反应法测定发酵液中硫酸铵的浓度从而反馈控制硫酸铵浓度,比较了进入产酸期后硫酸铵浓度分别维持在5g/L,10g/L,15g/L时对产酸的影响。
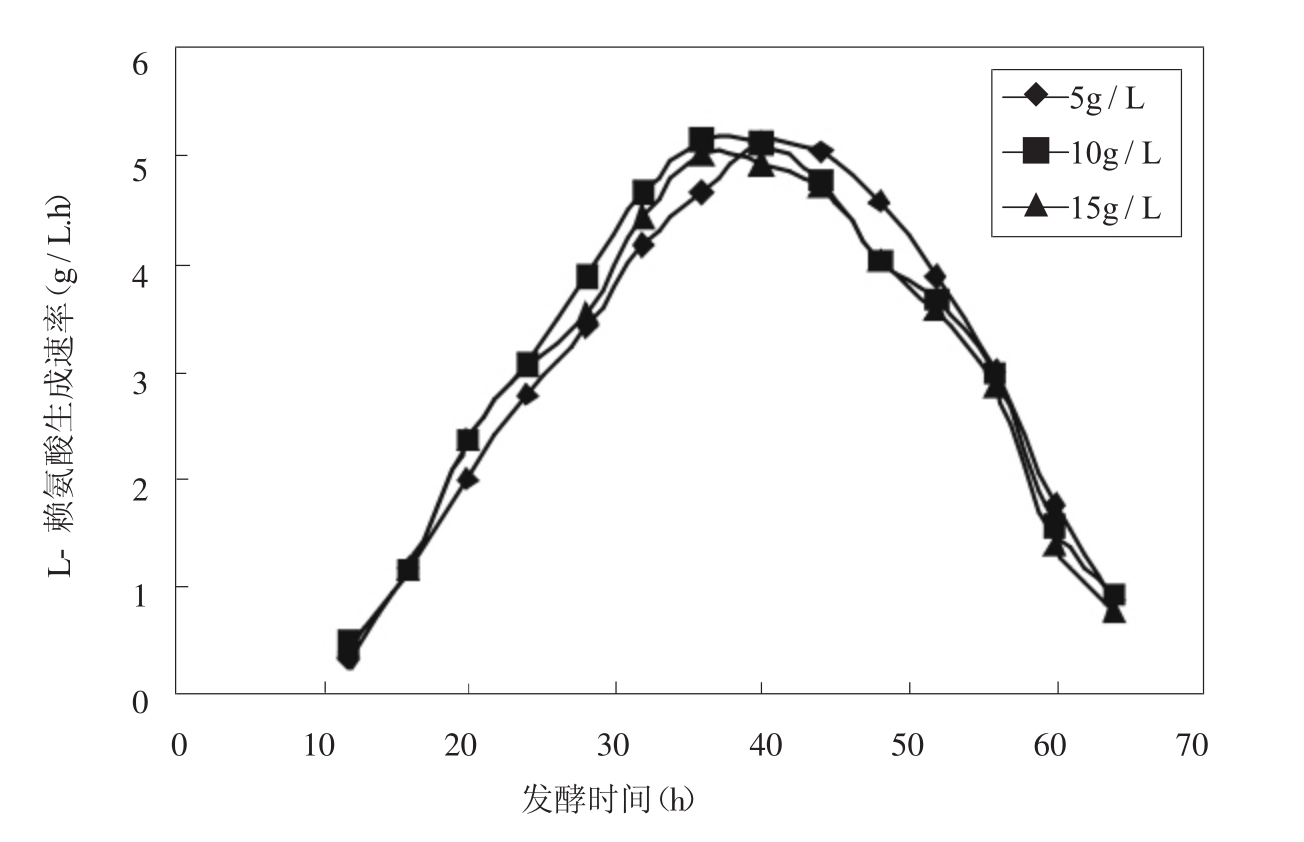
图5 不同硫酸铵浓度下赖氨酸合成速率
维持不同硫酸铵浓度下赖氨酸合成速率如图5所示。产物合成速率均呈峰形,在达到最大值后随发酵过程的进行而降低,从图上看,40h前硫酸铵控制在10g/L时,产物合成速度快,高于或低于10g/L都会影响产物的生成。 40h后硫酸铵维持在5g/L时赖氨酸合成速率要好于其他两种情况。也就说,赖氨酸发酵过程中,分阶段控制硫酸铵浓度更有利于赖氨酸的生成和提高生产强度,这于前面的结论一致。
2.2.4 采用葡萄糖溶度反馈控制方式
TK12进入产酸期后,耗糖耗铵的速度很快,赖氨酸合成过程中碳源的消耗速率在某段时间内一定程度上与氮源的消耗速率成线性关系,采取将硫酸铵按一定比例配入葡萄糖流加液中随其一起补加到发酵液中,使用恒定流加液中碳氮比的方法,以葡萄糖浓度反馈方式控制发酵过程硫酸铵的浓度,使其在较小的范围内波动,本文采用三种不同比例进行对比实验,结果如下表。
表2 糖氨混合补料对L-赖氨酸发酵的影响
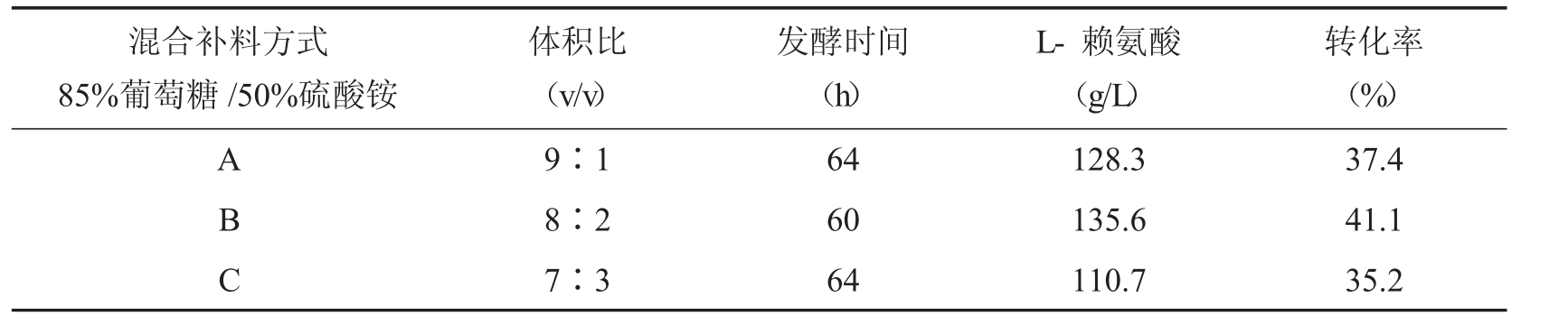
从表2可知,方式B葡萄糖反馈流加效果最好,在此方式下,糖氨比例能够满足菌体生长和产酸需要,并且能缩短发酵周期,提高发酵强度。 C/N直接影响菌体的生长和代谢,如果C/N偏小,会导致菌体生长过剩,易造成菌体提前衰老自溶; C/N过大,菌体繁殖数量少,发酵密度低,细菌代谢不平衡,不利于产物的积累。
总的来说,中后期一次性补加或恒速流加硫酸铵补充氮源的方式是基于发酵过程动力学与生化学分析,按预设控制模式进行流加控制。这两种非反馈型控制微生物生长的营养因子的方式虽然操作简便,但不能使可控氮源维持在一个较合适范围内,正是其波动幅度大影响发酵过程中菌体生长与赖氨酸的积累。后两种方式是根据发酵过程中某状态变量变化而及时直接或间接反馈控制调整营养因子浓度,在这种控制模式下,体系被量按规律变化便于进行发酵过程分析与优化所以更为合理,但检测相对繁琐,人力投入较大。实验表明维持较低或较高的硫酸铵浓度均不利菌体生长和赖氨酸的积累。在研究硫酸铵恒速流加和恒定浓度控制对发酵产酸影响时发现,在产酸过程中出现一个拐点,拐点前后分别控制硫酸铵浓度更有利赖氨酸的积累,这个拐点一般在45h左右,主要与接种量和种子生长情况有关。从图5上看前期控制在10~15g/L,后期控制在5~10g/L。再根据混料流加的优点,得出:在进入产酸期后,采用葡萄糖浓度反馈流加可控氮源硫酸铵的浓度,中后期的拐点前后采用不同糖铵比例以控制硫酸铵的浓度维持合适产酸的范围内。
参考文献:
[1]许朝阳,马杰,等.赖氨酸的生产及发展建议.安徽化工2003,5:14~15
[2]张克旭.氨基酸工艺学[M].北京:中国轻工业出版社.1992
[3] STE INBU CHEL A ,SCHL EGEL H G. Excret ion of pyrurate by mutants of A lcaligenes eutrophus,which are impaired in the accunulation of poly (β -hydroxybutyric acid) (PHB) ,under conditions permitting synthesis of PHB [J ]. ApplM icrobiol Biotechnol,1989,31: 168~175
[4] Shijo I,Kawamura K,J Biochem,1969,65 (6) :1541
[5] Deniel.Wang JC et al.: Fermentation And Enzyme Technology .Chapter 6,A Wiley -Inter -Science Publication ,New York ,1979
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














