(一)实验目的
电转染法通过外加电场的瞬时电击使细胞膜形成微孔,外源基因能够通过可逆孔洞进入细胞得以表达,该方法适用范围广,转染效率高,并且能够一次转染大量细胞,可以满足基因功能研究的需要。
(二)实验试剂
1.真核表达质粒。
2.RPMI1640培养液 5μg/ml胰岛素(insulin),5μg/ml转铁蛋白(transferrin),100U/ml青霉素(penicilin)、链霉素(streptomycin)。
3.电转仪、电击杯(0.4cm、200ohms)。
4.电转染缓冲液 20mmol/L HEPES、137mmol/L NaCl、5mmol/L KCl、0.7mmol/L Na2HPO4、6mmol/L Glucose、0.1mmol/L β-mecaptoethanol。
(三)实验流程
以大鼠肾小球系膜细胞系(ratmesangial cell,RMC)为例。
1.肾小球系膜细胞系RMC的培养 原代RMC于含15%胎牛血清的原代细胞1640培养液中,置37℃,5%CO2孵箱中培养。
2.将细胞融合程度达到 70%~80%的RMC常规胰酶消化,1200r离心5min,弃上清,加入700μl电转染缓冲液,混匀,加入40μg质粒,混匀,室温孵育10min。
3.将上述细胞-质粒的混合物移入电击杯,以550μF电容和340V电压组合进行电转染。室温静置10min,再铺入6孔板,置37℃、5%CO2孵箱中培养。
4.24h后,收集细胞,观测转染效率,进行后续实验,图1-15、图1-16为不同转染效率的RMC的荧光图。

图1-15 转染GFP的系膜细胞,转染效率20%。荧光显微镜下的形态(×100)
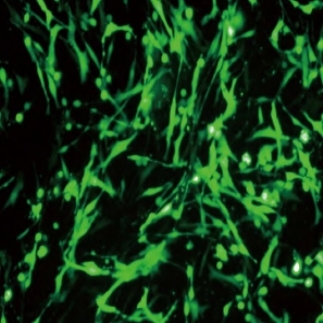
图1-16 转染GFP的系膜细胞,转染效率90%。荧光显微镜下的形态(×100)
(四)常见问题及注意事项
影响电转染效率和细胞活力的因素有很多,其中电压、电容是影响转染效果的重要因素。
1.如何提高转染效率?
答:特定强度的电压可以造成细胞胞膜穿孔(称为穿孔电压),随着电压的增大,穿孔直径也逐渐增大,有利于DNA分子进入细胞。而电容与电压持续时间呈正相关,随着放电时间的延长,电穿孔数目增多,转染效率也随之提高。通常较低的电压与电容组合会导致脉冲穿孔条件不充分,电转染效率不佳。而过高的电压和电容组合则会使细胞膜穿孔数量增加或者孔径激增,导致膜组织断裂、细胞凋亡,影响细胞活力。
2.为什么会有细胞死亡?
答:适当提高电容确实能够提高电转染的效率,但同时也增加了细胞的死亡率。
3.什么样的质粒DNA浓度及细胞密度适合转染?
答:质粒DNA浓度和待转染细胞状态也会影响到电转染效果。可以进行预实验,选取合适质粒浓度获得较佳的电转染效果。而细胞融合度在70%~80%处于对数生长期的原代RMC生命力旺盛,细胞膜恢复能力强,有利于增加电转染成功率。
[1]徐峰,吕杨,谢院生,等.原代大鼠肾小球系膜细胞最佳电转染条件的探索和验证.军医进修学院学报,2010,31:459-461.
[2]Loram LC,Harrison JA,Sloane EM,et al.Enduring reversal of neuropathic pain by a single intrathecal injection of adenosine 2A receptor agonists:a novel therapy for neuropathic pain.J Neurosci,2009,29:14015-14025.
[3]Han SY,Gai W,Yancovitzm,et al.Nucleofection is a highly effective gene transfer technique for human melanoma cell lines.Exp Dermatol,2008,17:405-411.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














