6.7.2 邹承鲁作图法
1962年邹承鲁提出了以统计学为基础的作图法(简称邹氏作图法)。由于具有简便、可靠、适用性广的优点,四十多年来邹承鲁作图法在国际上成为主要的方法而得到广泛的应用。
在这个方法中,根据必需和非必需基团与试剂作用的反应速度和其他性质的不同,邹承鲁将化学修饰分为6种情况处理。由于化学修饰试剂专一性的提高,修饰技术的发展,从四十多年来应用邹氏作图法进行定量的文献看,这6种情况中前3种用得比较普遍,下面对这几种情况作分别介绍。
(1)修饰试剂仅用于一类基团,其中必需基团与非必需基团作用速度相同。
今设a是作用过程剩余的具有全部活性的分数(在简单情况下a亦为其活性剩余分数),而xе代表其必需基团剩余分数。若在酶蛋白中,同类基团中仅有一个为表现活性所需,则a=xе。但如果必需基团数为i,即在同类基团X之中,有i个均为必需,此时如果所有的基团X作用速度相等,即破坏程度相同,那么,具有全部活性的分子应该是那些所有的必需基团未受到破坏者,所以
![]()
如果同类基团X的平均剩余分数为x,由于此类基团的破坏程度都相同,即xe=x,则有
![]()
上式有两种作图法。
第一种,以a的对数相对于x的对数作图,所得的直线斜率为i,亦即必需基团的数目。
第二种,假设有一系列i值,以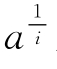 对x作图,能获得直线者,其i值即为所求的必需基团的数目。
对x作图,能获得直线者,其i值即为所求的必需基团的数目。
图6-8表示卵类黏蛋白的酯化对其作为胰蛋白酶抑制剂活性的影响。从图6-8可以清楚地看出,虽然此物质含有约28个羧基,但其中仅有2个(即i=2)为必需基团。自1962年以来应用邹承鲁作图法的文献中,相当大部分属于这一情况,都得到了很满意的结果。下面再举几个例子:①用对羟基苯甲酰甲醛(p-hydroxyphenyl-glyoxal)修饰牛胰核糖核酸酶A,用邹承鲁的方法处理得到的图6-9所示的结果表明i=1,则只有一个精氨酸残基是酶的必需基团。②用(2-羟基-5-硝基苄基)溴化硫(di-methl(2-hydroxy-5-nitrobenzyl)sulfonium bromide)修饰兔肌酸激酶,如图6-10所示,i=1,即每一个亚基只有一个色氨酸残基是酶的必需基团,这是因为肌酸激酶表现活性的最小功能单位是亚基。值得注意的是,当我们不能确切得到可反应基团的总数时,无法计算出基团剩余分数,此时我们可以用基团被破坏的数目m作为横坐标,同样可以求得必需基团的数目。③胰蛋白酶二硫键的还原与活性的关系,由图6-11的结果可知i=3时为1条直线,表明此酶中有3对必需二硫键。
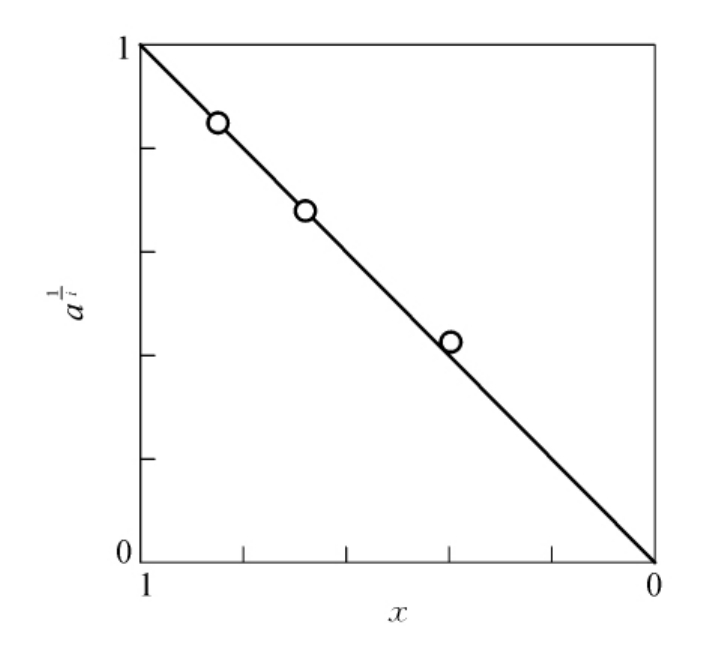
图6-8 卵类黏蛋白的酯化对其作为胰蛋白酶抑制剂活性的影响
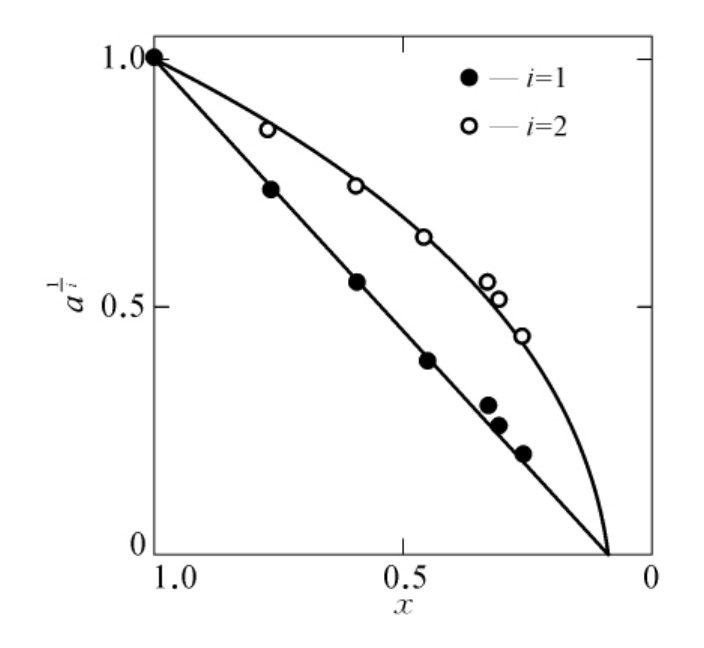
图6-9 用对羟基苯甲酰甲醛修饰牛胰核糖核酸酶时,活性剩余分数a和精氨酸残基剩余分数的关系
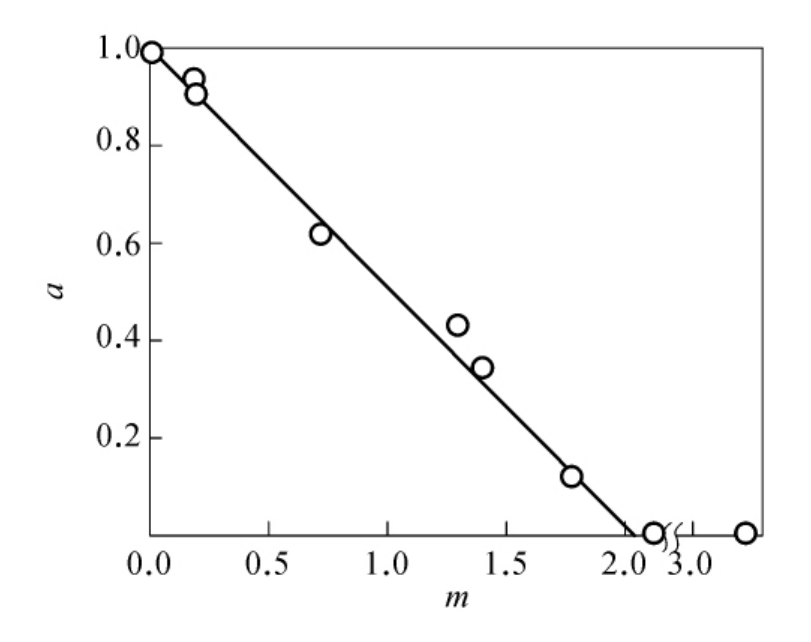
图6-10 2-羟基-5-硝基苄基的引入对肌酸激酶的活性的影响
a为活性剩余分数,m为被修饰的色氨酸残基数。
本图引自Zhou H M et al.Biochim.Biophys.Acta.,1985。

图6-11 胰蛋白酶二硫键还原与活性的关系
本图引自邹承鲁,等.生物化学与生物物理学报,1963。
(2)同类基团X中,必需基团与非必需基团作用速度相差很大。
这种情况较第一种情况更为普遍。如果我们假定同类基团X的总数为n,其中按照反应速度不同,可以分为3类:第一类是反应速度最快的非必需基团,其总数为s,当这些基团已基本上全部破坏时,其余基团的破坏还可以忽略不计;第二类是p个反应速度较快的基团,其中包括i个必需基团;第三类是反应最慢或根本不被破坏的基团,其数目是n-p-s。当必需基团开始破坏,生物活性开始下降时,总的基团X的剩余分数的关系是:
![]()
将式(6-1)代入,移项整理得
![]()
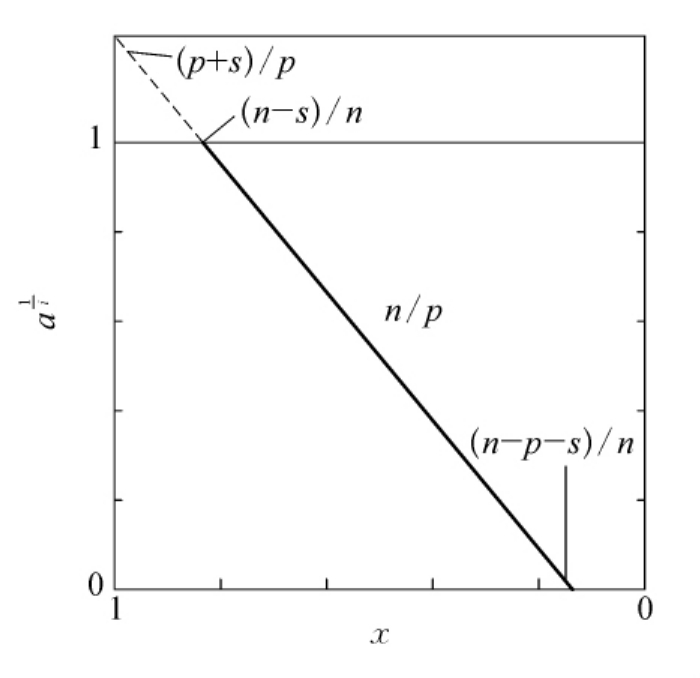
图6-12 基因改变对蛋白质生物活性的影响
有时当同类基团X的总数为未知,无法计算此类基团的剩余分数,而此时可以测定已改变的基团数m,则由于
![]()
代入式(6-3)整理得
同样以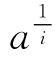 对m作图,可以求得p和s。
对m作图,可以求得p和s。
![]()
属于这种情况的一个典型例子是DTNB对猪肾氨基酰化酶的化学修饰。图6-13是用修饰时酶的剩余活性分数与被修饰的—SH数m之间的关系(实验值)。从这样的曲线上很难直观地判定必需基团的数目。若采用图6-13的数据,用邹承鲁作图法进行处理,以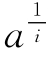 对x作图,i分别取1,2,3,得到了图6-14中的3条线。可以看出,i=2时得到很好的线性关系。从线2的数据,可以计算得到s=2,p=2,因此可以认为4个反应的—SH基中,2个—SH反应很快,是非必需基团,2个—SH反应较慢,均为必需基团。这一结果与用Ray-Koshland方法测定的结果是一致的。
对x作图,i分别取1,2,3,得到了图6-14中的3条线。可以看出,i=2时得到很好的线性关系。从线2的数据,可以计算得到s=2,p=2,因此可以认为4个反应的—SH基中,2个—SH反应很快,是非必需基团,2个—SH反应较慢,均为必需基团。这一结果与用Ray-Koshland方法测定的结果是一致的。
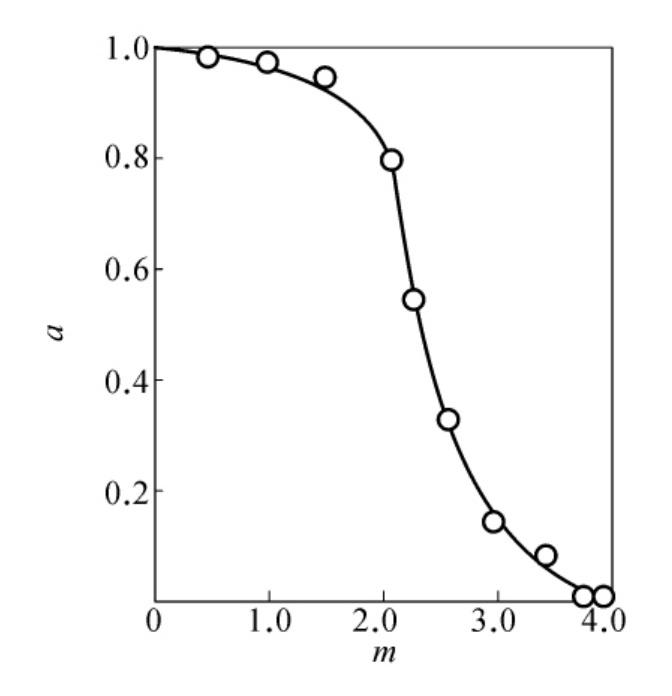
图6-13 用DTNS修饰氨基酰化酶时酶的活性剩余分数a与被修饰巯基数m之间的关系

图6-14 用DTNB修饰氨基酰化酶时活性剩余分数a与巯基剩余分数x的关系
本图引自周海梦,等.生物化学杂志,1991。
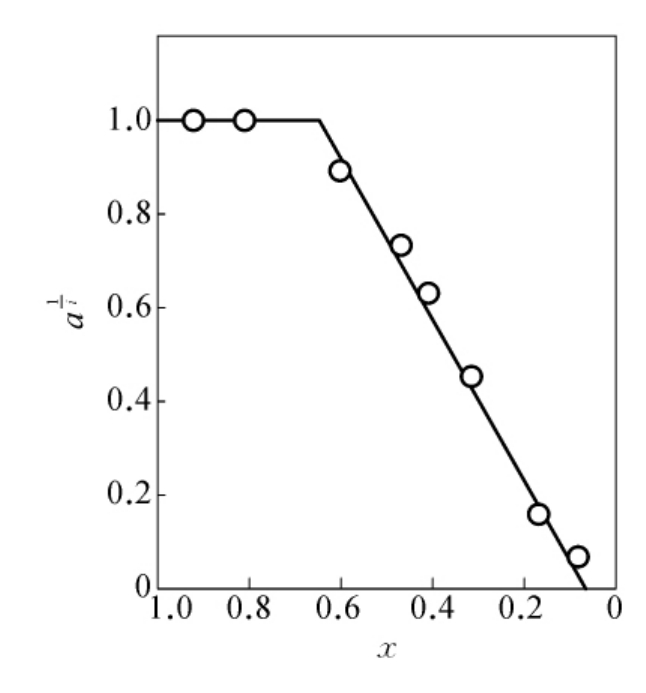
图6-15 文昌鱼碱性磷酸酯酶被N-溴代琥珀酰亚胺修饰时活性剩余分数a与色氨酸残基剩余分数x之间的关系
另一个例子是用N-溴代琥珀酰亚胺修饰文昌鱼碱性磷酸酯酶。酶分子中含有8个色氨酸残基(n=8)。在pH为4.0的条件下用NBS作用,以活性残余分数a对残余色氨酸残基分数x作图,得到较好的线性关系(见图6-15)。从图6-15中可以得到:s=3,p=4(其中i=1),n-p-s=1。由此可以判断:文昌鱼碱性磷酸酯酶分子中,有3个反应很快的色氨酸残基,它们是非必需的;有4个反应较快的色氨酸残基,其中有1个必需基团;有1个反应极慢的残基,它对酶活性也是必需的。
在很大程度上,式(6-4)较式(6-3)有更为广泛的应用价值,即使当能与某一试剂起反应的基团总数n为未知数时,也能根据已经被改变了的基团数,利用式(6-4)求值。图6-16是根据Whitaker与Jandorf所报道的胰凝乳蛋白酶与二硝基氟苯作用过程中活性丧失的数据,按照式(6-4)作图的结果。从图6-16可以看出,虽然在pH为7.2或pH为7.9时,p的数值可能略有不同,但在已与FDNB作用时的基团中仅有1个是胰凝乳蛋白酶的必需基团。由于胰凝乳蛋白酶在与FDNB作用时,其酚基、氨基和组氨酸的咪唑基均能被二硝基苯化,因此判断这一必需基团性质就要分别测定这些基团的改变。Whitaker和Jandorf曾报道在pH为10时,FDNB对胰凝乳蛋白酶的作用比较专一,酶分子中两个咪唑基仅有1个与FDNB作用,从活性降低与二硝基苯化程度的关系看来,此咪唑基是必需基团。
另一个典型的例子是胃蛋白酶羧基被修饰的情况(见图6-17),从图中可见i=2时为一条直线,显然胃蛋白酶的必需羧基是两个。
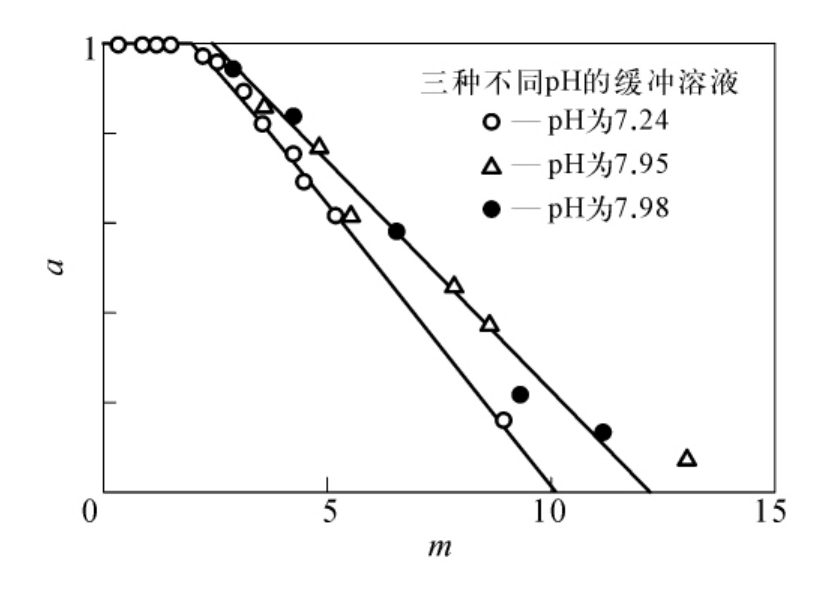
图6-16 胰凝乳蛋白酶二硝基氟化物对其活性的影响
(横坐标为与每分子酶结合的二硝基氟苯数)
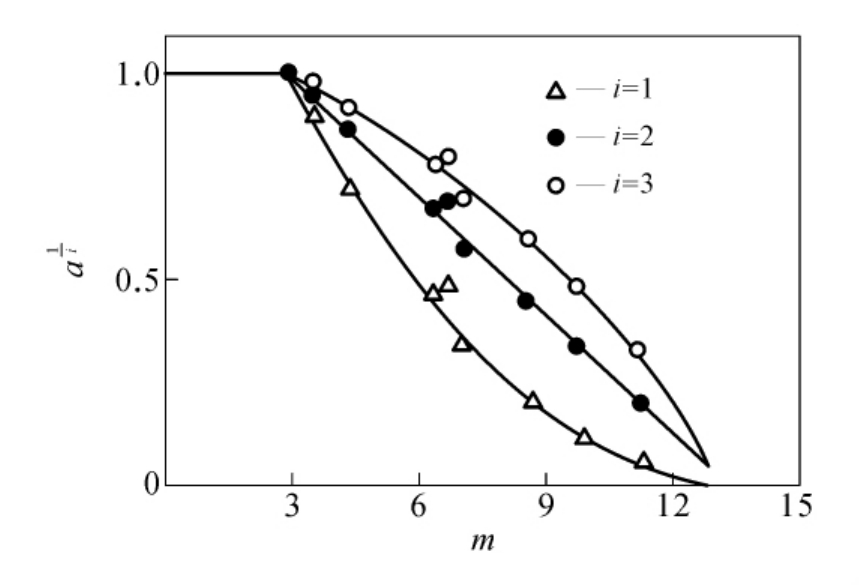
图6-17 胃蛋白酶羧基的化学修饰
本图引自Paterson AK,et al.Eur.J.Biochem.,1972。
(3)同类基团X中,必需基团与非必需基团的反应速度不相等但又不是相差很大。
这类情形的活性降低与基团改变的定量关系略微复杂一些,并且随反应级数的不同其数学关系也不同。由于在一般情况下,引起基团性质改变的试剂通常都是过量存在,所以这里仅考虑当反应级数为一级时的情形。
如果必需基团被破坏时的一级反应速度常数为k1,非必需基团的相应常数为ak1,其中a为两类基团与试剂作用速度常数的比值。必需基团和非必需基团的残余分数各为x和x′,则
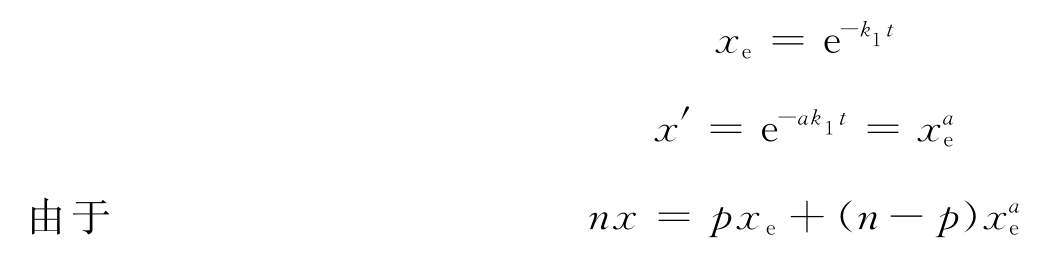
将式(6-1)代入上式,得
![]()
由于i常为不太大的正整数,a一定小于1。所以,当a》1及a《1时,式(6-5)可以分别简化为式(6-6)和式(6-7)
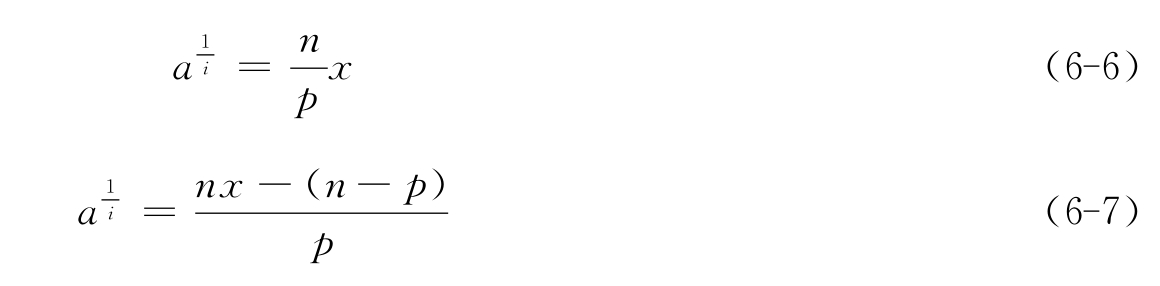
式(6-6)和式(6-7)也可以同样在当n-p-s=0及s=0时从式(6-3)简化得到。
在核糖核酸酶光氧化的过程中,根据Weil等的数据,随着酶活性的丧失,组氨酸残基被破坏,以a直接对x作图(见图6-18)或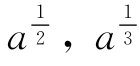 对x作图均不能得到直接关系。但从图618中-线1和线2的直线部分估计,p和i最可能为1或2。
对x作图均不能得到直接关系。但从图618中-线1和线2的直线部分估计,p和i最可能为1或2。
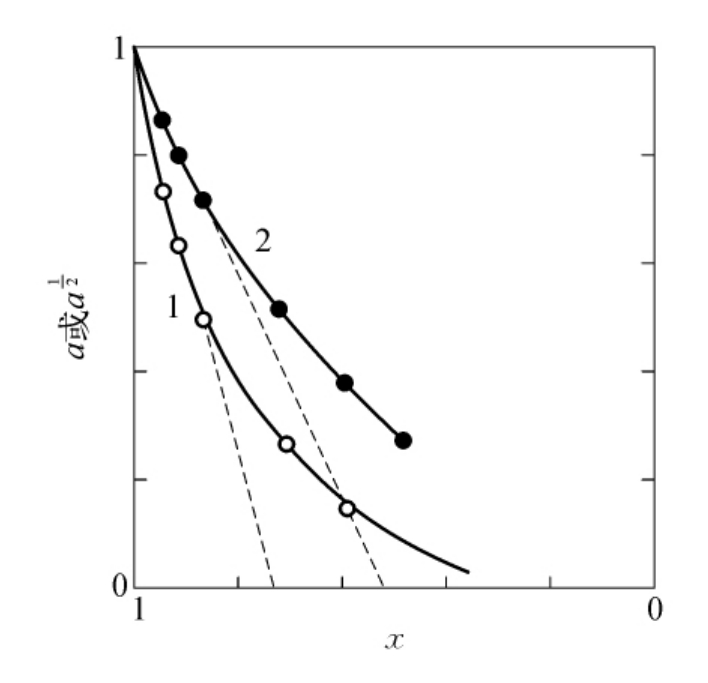
图6-18 核糖核酸酶光氧化过程中组氨酸残基的破坏与其活性的关系
(线1和线2的纵坐标分别为a及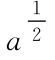 。)
。)
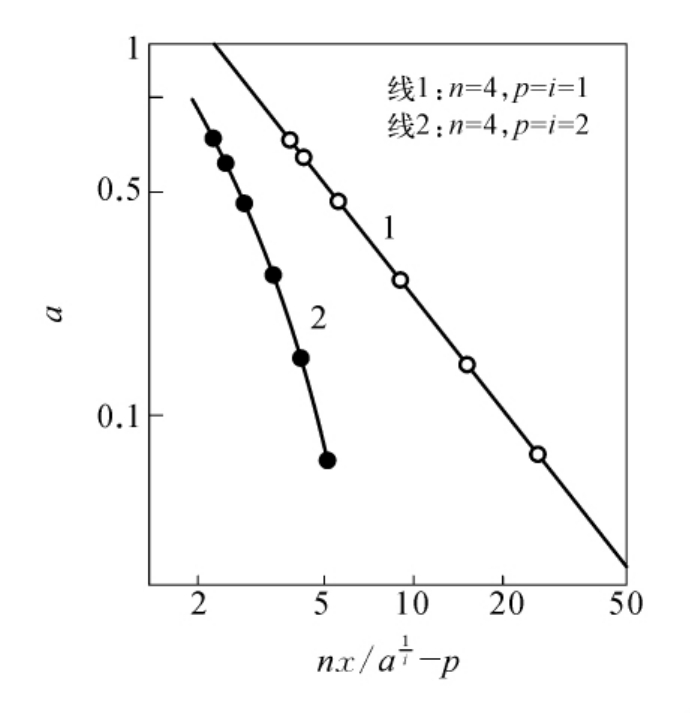
图6-19 核糖核酸酶组氨酸残基中的必需基团数
(用图6-18数据以lg(nx -p)作图,纵、横坐标均为对数标尺。)
-p)作图,纵、横坐标均为对数标尺。)
如果将式(6-5)两边均除以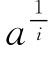 ,移项并取对数得
,移项并取对数得
![]()
在假定p=i=1和p=i=2时,分别以lg(nx/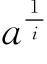 -)对la作图,结果如图619所示。pg -从图6-19可见,仅在p=i=1时可以得到直线关系,并以直线(线1)的斜率可以计算a值为0.21,亦即在光氧化过程中所破坏的组氨酸残基仅有1个为必需基团,其破坏速度较其他组氨酸残基约快5倍。这一结果和核糖核酸酶羧甲基化的报告是符合的。现在已经知道,在核糖核酸酶分子中的组氨酸残基中,位于活性中心的一个最易与溴代乙酸进行反应。应该指出,从图6-19计算所得的a=0.21,可能仅为其余3个组氨酸残基相对破坏速度的平均值。因此,以上结果不能排除在酶分子中另有一个破坏较慢的组氨酸残基的可能性,亦即以上结果可能与Findley等人的设想,即核糖核酸酶的必需基团中包含两个组氨酸咪唑基并不矛盾。
-)对la作图,结果如图619所示。pg -从图6-19可见,仅在p=i=1时可以得到直线关系,并以直线(线1)的斜率可以计算a值为0.21,亦即在光氧化过程中所破坏的组氨酸残基仅有1个为必需基团,其破坏速度较其他组氨酸残基约快5倍。这一结果和核糖核酸酶羧甲基化的报告是符合的。现在已经知道,在核糖核酸酶分子中的组氨酸残基中,位于活性中心的一个最易与溴代乙酸进行反应。应该指出,从图6-19计算所得的a=0.21,可能仅为其余3个组氨酸残基相对破坏速度的平均值。因此,以上结果不能排除在酶分子中另有一个破坏较慢的组氨酸残基的可能性,亦即以上结果可能与Findley等人的设想,即核糖核酸酶的必需基团中包含两个组氨酸咪唑基并不矛盾。
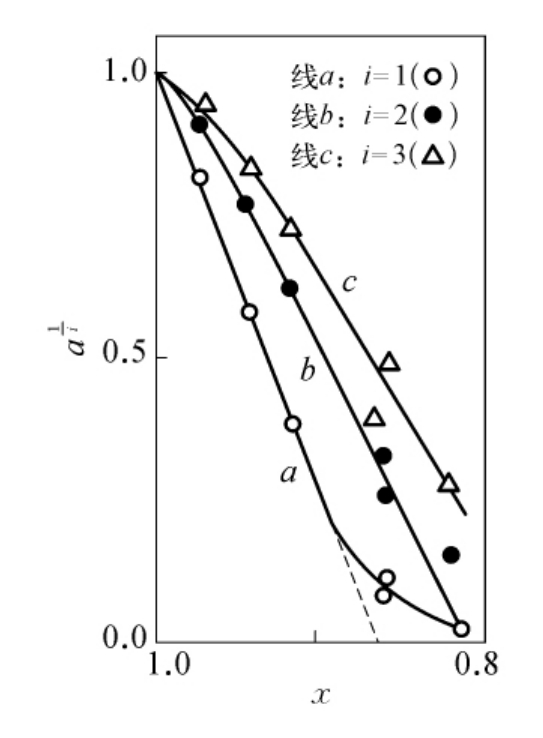
图6-20 转酮醇酶的精氨酸残基的修饰与活性之间的关系
(本图引自Kremer AB,et al.J.Biol.Chem.,1980。)
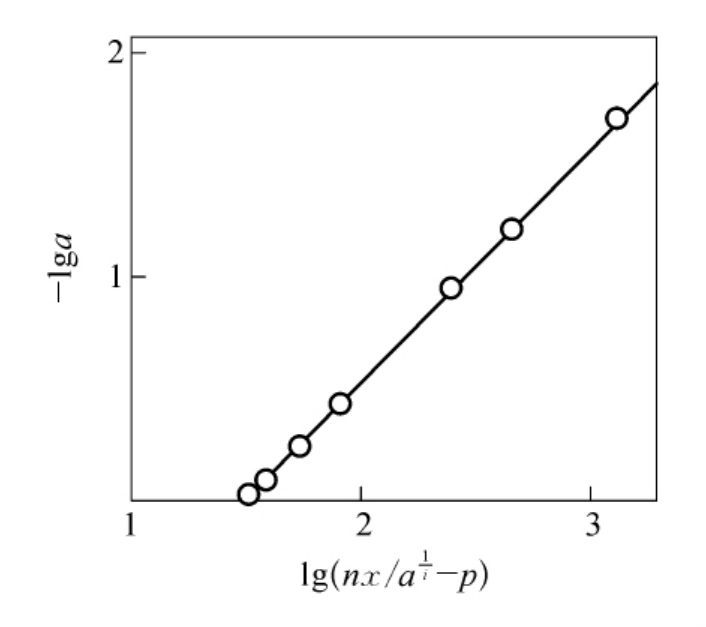
图6-21 转酮醇酶的精氨酸残基修饰时lg a对lg(nx/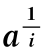 -p)作图
-p)作图
(本图引自Kremer AB,et al.J.Biol.Chem.,1980。)
上述三种情况下的定量处理方法使用比较广泛。从目前掌握的文献看,绝大部分使用的都为上述三种情况下的定量方法。作为一种严谨的科学方法,邹承鲁还考虑到已经出现的某些比较特殊的情况和可能存在的情况,因此他的定量处理方法中还包括了下面三种情况下数据的处理。由于目前使用得较少,因此只作简单的介绍。
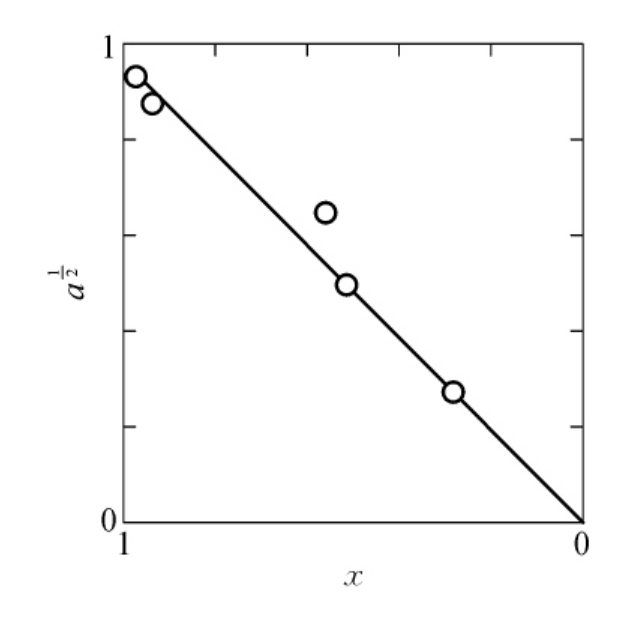
图6-22 胰蛋白酶色氨酸残基修饰时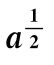 与x的关系
与x的关系
(本图引自Viswanntha T,et al.Biochim.Biophys.Acta.,1960。)
(4)必需基团已全部被修饰的酶分子尚有部分残余活性。
此时所测得的活性剩余分数ax与体系中完全未被修饰的酶分子的分数a之间有如下的关系
![]()
根据式(6-9)计算所得出的值代入前面所介绍的有关公式,以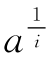 对x作图可求得i,p和s值。图6-22为胰蛋白酶的色氨酸残基的修饰与活性的关系。由作图得s=1,p=3,i=2,表明蛋白酶的4个色氨酸残基中,有1个快反应基团,3个慢反应基团中有两个是必需的。如果将式(6-9)代入式(6-2),可以得到
对x作图可求得i,p和s值。图6-22为胰蛋白酶的色氨酸残基的修饰与活性的关系。由作图得s=1,p=3,i=2,表明蛋白酶的4个色氨酸残基中,有1个快反应基团,3个慢反应基团中有两个是必需的。如果将式(6-9)代入式(6-2),可以得到
![]()
显然,这时实际测得的剩余活性ax与xi成正比。由ax对xi作图,不仅可以求得必需基团数,而且还可以由截距或者斜率求得残余活性aT,这特别适用于aT未知的情况。α-淀粉酶由己烯酮酰化就属于此种情形(见图6-23),它表明α-淀粉酶有两个氨基是必需的,其残余活性为aT=0.44。
(5)同类基团X中,保留其中之一,酶即保有全部活性。
这种情况与前面介绍的情况正好相反。用与第一种情况中相同的方法,可以得到活性丧失的分数(1-a)与必需基团被修饰的概率(1-xe)的i次方成正比:
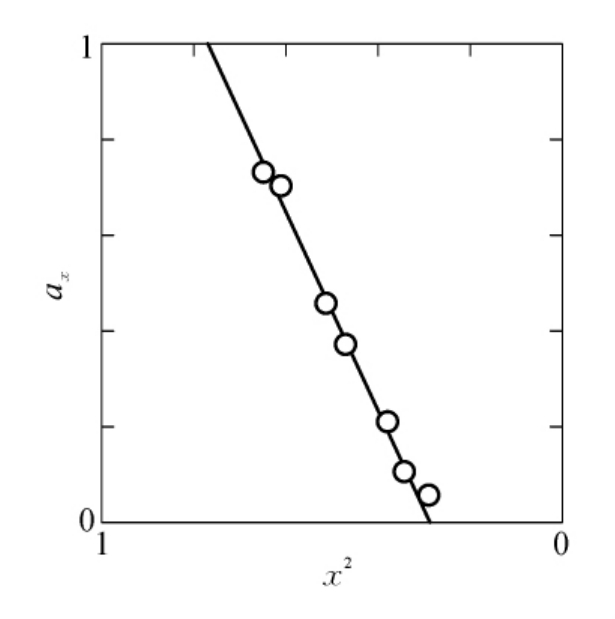
图6-23 ax对x2作图(i=2)
(本图引自Viswanntha T,et al.Biochim.Biophys.Acta.,1960。)
![]()
Ray和Koshkand曾指出,这种情形对于一些功能主要在维持蛋白质三级结构的必需基团适用。例如,可以想象某一蛋白质的三级结构主要靠两个硫—硫键维系,只要两者任留其一,这个蛋白质的三级结构即可维持不变。但是,至今在实验上还没有遇到过这种情况。
(6)试剂作用于两种不同侧链基团X和Y,两者均含有必需基团。
当在与某一类试剂作用的两类基团中均包含必需基团时,数学关系比较复杂。如基团X和Y的总数分别为nx和ny,活性剩余分数分别为x和y,与试剂迅速作用的非必需基团数分别为sx和sy,与必需基团作用速度约略相等的基团数为px和py,则根据式(6-3),同样推理得
![]()
式中,i及j分别为X和Y中的必需基团数。式(6-12)虽然比较复杂,但在实验中常能对s和p的数值先作约略的判断。如果基团开始破坏,活性立即下降,显然sx和sy或者皆等于零,或者至少两者之一等于零;如仅两者之一等于零,则至少在反应初期,活性下降仅与X和Y中之一发生关系,亦即可用前面所述的几种方法处理。如果X或Y中有一部分较其余基团反应缓慢,在实验过程中也较易发现。在s=0,n=p的情况下,式(6-12)可简化为
![]()
即使对于像式(6-13)这样简化了的关系式,如果i和j均为未知,可能的组合方式很多,用于处理实验数据也还不是十分简单。此时如果可以根据试剂消耗总量或基团X和Y改变的总量与活性下降的关系,先依照前面所述的几种方法,特别是式(6-4)关系求出必需基团总数(i+j)的数值,就可以简化根据式(6-13)求i及j的过程。四十几年前,邹承鲁考虑到了当时试剂专一性条件,提出对第6种情况的处理方法,曾经在当时为处理这种复杂的修饰情况起了重要的作用。现在由于在试剂的专一性选择范围和对某一些基团可以实行可逆保护等方面的研究取得了进展,遇到这第6种情况比较少了,在此不再举例说明。
十分有意思的是,蛋白质化学修饰的定量处理的邹氏作图法还可以应用到判断蛋白质折叠所必需的残基数。用此法判定兔肌酸激酶的半胱氨酸残基结果表明,每一个亚基有3个对折叠必需的(其中包括一个对催化必需的)半胱氨酸残基。其方法是将兔肌酸激酶在3mol/L盐酸胍溶液中充分去折叠,然后控制MNP(2-氯汞-4-硝基苯酚)与充分去折叠酶的反应分子比,得到一系列不同修饰程度的去折叠酶,然后分别稀释30倍复性3h后,测定酶活性,得到酶活性剩余分数a。用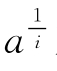 对m作图(见图624),从图624中可见,当i=3时为一直线,这表--明肌酸激酶分子中,每一个亚基上有3个半胱氨酸巯基对酶的折叠和催化活性是必需的。
对m作图(见图624),从图624中可见,当i=3时为一直线,这表--明肌酸激酶分子中,每一个亚基上有3个半胱氨酸巯基对酶的折叠和催化活性是必需的。
邹承鲁提出的这一方法,四十几年来在国际上已经被广泛地使用和引用。它已被收编入英、美、日等国的教科书和专著中。1979年出版的著名的Dixon和Webb酶学教科书中,曾以同样的篇幅分别介绍Ray-Koshland方法和邹承鲁方法。但是在以后出版的教科书和专著中,则主要介绍邹承鲁方法,这说明它是当前研究蛋白质侧链基团化学修饰和生物活性之间定量关系的主要方法,在教科书和引用文献中被称为邹氏方法、邹氏公式或邹氏作图法。1984年Brocklehurst提出,邹氏作图法可以作为判断酶特征的一种主要手段,并据此得出Chymopapain A即Chymopapain C的结构。邹承鲁领导的实验室曾在胰岛素和胰蛋白酶必需二硫键、木瓜蛋白酶的必需组氨酸和色氨酸残基、肌酸激酶的必需半胱氨酸硫基和必需色氨酸残基以及氨基酰化酶的必需半胱氨酸巯基的研究中成功地运用这一定量处理的方法。近年来又将邹氏作图法进一步推广到多亚基的别构蛋白和半位反应,同时对邹氏作图法进行了严格的数学证明,使人们进一步认识到这一方法的价值与可靠性。此外,因为应用这一方法时需要先假设一个参数的值,然后手工计算,反复试多次找出最好的线性拟合,才能确定必需基团的数目。为了克服上述缺点,邹氏作图法计算机模拟也应运而生。
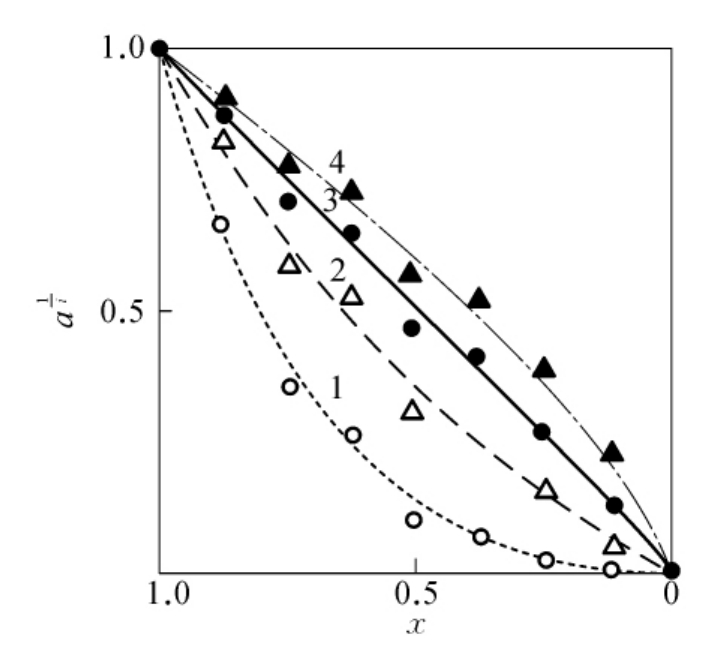
图6-24 再折叠后肌酸激酶活性剩余分数a和剩余巯基分数x之间的关系(图中数字为i值,复性体系中的酶浓度为1.6μmol/L)。
邹氏作图法确定的意义在于,它不仅为蛋白质化学修饰研究由定性描述转入定量研究提供了依据和计算方法,而且对目前日益发展的蛋白质工程来说,用这种简单而成熟的方法能够首先确定蛋白质的必需基团,这也正是蛋白质工程设计的必要手段之一。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















