二、丝裂原激活蛋白激酶
丝裂原激活蛋白激酶(mitogen activated protein kinase,MAPK)通路在正常细胞中参与细胞生长、发育、分裂及细胞间的功能同步等多种生理过程,然而目前有大量实验证明其可积极参与ECM代谢。目前已明确的有3条通路:①ERK通路(细胞外信号调节激酶):刺激因子→膜受体酪氨酸激酶→ras-GTP→raf激酶→MEK→ERK1/ERK2→核内→TCF(ELK/SAP1)→c-fos;②JNK通路(c-Jun NH2-末端激酶):刺激因子→Rac,Cdc42Hs→PAK→MEK/2B14→MKK4(SEK1)→JNK(SPAKs)→核内→ATF-2/ELK-1;③p38通路(p38MAP激酶):刺激因子→Rac→PAK→TAK/ASK/MLK→MKK3/MKK6→p38→核内→ATF-2/CH0P10/Sap1。这3条通路的激活有着共同的特点,即它们的激活都经过一个蛋白激酶的级联激活系统:刺激因子→MAPKKK→MAPKK→MAPK,其中MAP-KKK和MAPK都是Ser/Thr蛋白激酶,而MAPKK,则能既磷酸化Ser/Thr又能磷酸化Tyr(图12-2)。
这些激酶可被各种刺激包括许多细胞因子激活,如在对糖尿病肾病的病变肾小球及在高糖培液中的系膜细胞研究中有ERK-MAPK被激活,活性ERK能够进一步激活EIK-1,后者是一个三聚复合物因子,可增强c-fos和c-jun的表达,促进AP-1与DNA结合。已知TGF-β启动子中有多个与AP-1相似的结合位点,在受到佛波醇脂(PMA)/PKC刺激时起反应,可增强AP-1与TGF-β启动子结合,这表明高糖环境下的系膜细胞,其ERK通路在TGF-β的转录活性中起重要作用,从而促进Ⅰ型胶原、FN的合成。用ERK阻断剂PD98059可抑制由TGF-β诱导的Ⅰ型胶原、FN合成。除高糖因素外,参与糖尿病肾病发病机制的其他因素包括肾小球内高血压、氧化物刺激、非酶性糖化物及生长因子等也可能与此通路有关。同样在培养的系膜细胞中发现机械张力、血管紧张素Ⅱ、内皮素及进展性糖化合物终末产物等因素的刺激都能激活ERK。TGF-β则可同时激活ERK-MAPK和JNK-MAPK通路,促进Ⅰ型胶原的合成,用变异性ERK基因转染系膜细胞可抑制α1(Ⅰ)胶原启动子活性,并部分抑制P3TP-LUX结构的表达。
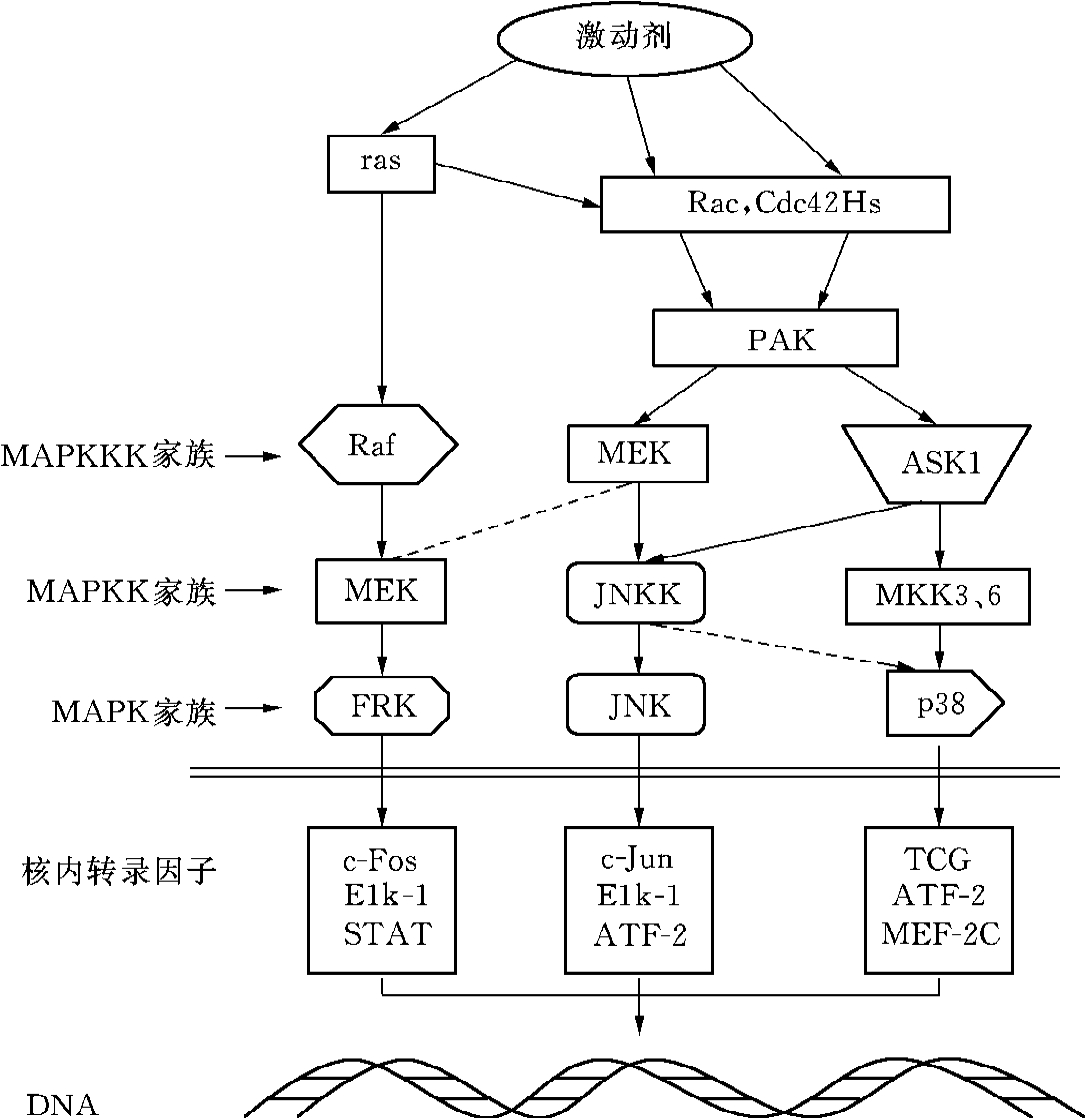
图12-2 MAPK通路中的蛋白激酶组成成分
p38-MAPK通路也可被上述因素或因子激活。在机械张力作用下,人系膜细胞p38-MAPK5min开始活化,30min升高至正常的11倍,33h仍维持在3倍。激活的p38可诱导多种细胞转录因子活化。如c-fos和c-jun,后者连接形成AP-1,再连接并激活带有TRE基因的启动子,引起靶基因表达。因TGF-β1和FN都含有TRE位点,所以p38就可通过这个机制诱导TGF-β1和FN的合成,而其特异性阻断剂SB203580可完全抑制因受机械张力诱导的TGF-β1和FN的合成。
肾上腺髓质素已被证明具有抑制系膜细胞增生和促进细胞凋亡作用。实验显示,它也能增强p38-MAPK分子的活性,并进而增加c-fos和jun-B mRNA的表达,使AP-1与DNA结合活性增强。而p38抑制剂SB203580和MEK抑制剂U0126均可显著减轻肾上腺髓质素对系膜细胞生长的抑制作用和促进凋亡作用,并抑制细胞核AP-1活性。也有实验证实血管紧张素Ⅱ在肾素转基因大鼠模型(Ren2)中引起肾小球的损伤及ECM积聚过程也存在MAPK通路的激活,并经其Ⅰ型受体介导。而应用Ⅰ型受体拮抗剂或p38阻断剂均能减轻血管紧张素Ⅱ引起的系膜基质的积聚扩张。上述结果说明p38-MAPK也是影响系膜细胞ECM代谢的重要信号转导分子。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















