疾病的发生一般系因各种不同的致病因子损伤靶器官,引起该器官和相关脏器、组织等的损伤,再经介导物质引起全身的系统性病变;同时机体立即启动相应的防导机制,拮抗因损伤产生的急性或慢性炎症和其他病理变化,若防导机制能够克服或制止病变过程进展,修复适宜时,则病变终止,健康恢复。但是,有时修复过程也可能失常,呈过度修复而产生的瘢痕,纤维化会影响受损器官的功能,是为疾病过程的另一种表现。当损伤过程非常剧烈时,防导机制无力阻挡,将会危及机体生命,如特发性间质性肺炎中的急性间质性肺炎(acute interstitial pneumonitis,AIP),其病程急,死亡率几乎达到90%;若损伤持续慢性存在,机体修复过度,可导致严重功能障碍,也常导致死亡,如寻常性间质性肺炎(usual interstitial pneumonitis,UIP)。
弥漫性肺疾病涵盖众多不同本质的疾病,致病因子各异,有些已了解清楚,如本书第十三、十四章论及的生物性致病因子引起的肺部感染性弥漫性疾病,而弥漫性肺疾病中大多数的诱发病因并不清楚或不甚清楚,可是这些存在着的尚未被彻底知晓的病因均将直接或间接引起肺部的炎症反应,造成肺组织损伤。换言之,炎症反应是肺损伤的第一步。
一、炎 症
(一)炎症的形成
由于肺组织结构的特殊性,炎症反应首先并主要表现为肺泡炎。肺泡炎也常是对各种致病因子的早期反应。在肺泡腔内,肺泡间隔中和细支气管周围有炎症细胞浸润,伴有肺毛细血管充血,水肿液渗出,肺泡腔内水肿液充填及肺泡间隔增厚等改变。炎症反应细胞性质的不同,则会有不同本质的疾病。例如在外源性过敏性肺泡炎、Churg-Strauss综合征、嗜酸性肉芽肿等病中,肺泡炎病变中可见到嗜酸性粒细胞,结节病的肺内病变中则以淋巴细胞为主,UIP和韦格纳肉芽肿病(Wegner′granulomatosis)中则可见到嗜中性粒细胞,淋巴细胞和浆细胞分别在非特异性间质性肺炎(nonspecific interstitial pneumonitis,NSIP)和胶元结缔组织病的肺病变中出现。
因肺泡炎病变中浸润的炎性细胞成分多少不同可在影像学检查中如在HRCT图像上呈现出不同的影像,可以是大片弥漫模糊或磨砂玻璃样的阴影,也可呈现为散在的斑片状浸润性阴影。同时支气管肺泡灌洗液中细胞分类也能反映出肺泡炎的主要细胞构成。当然,有些弥漫性肺病当临床发现时炎症已不占主要地位而是以修复,纤维化为突出表现,如UIP。此外,还有一些弥漫性肺病具有本身的特殊性病理改变,并非一般性炎症反应,如肺泡蛋白沉着症(pulmonary alveolar proteinosis,PAP),肺淋巴管平滑肌瘤病(lymphangioleiomyomatosis,LAM)等。
在炎症消散过程中,肺基质成分中胶原纤维增加,间质细胞成分出现。假如致伤因子引起的肺泡炎对肺组织构造损伤不够严重或经有效治疗的干预,修复完成后,肺组织结构能恢复正常,则为一良性过程。当损伤因子持续存在,或机体的炎症反应反复加重,呈慢性过程,则肺泡炎和间质细胞增殖,肺泡间隔增厚,肺纤维化并存,甚至肺组织正常结构被广泛破坏,以肺纤维化、蜂窝肺等病变成为疾病的结局。
(二)炎症细胞及其在炎症反应中的作用
炎症细胞是机体对入侵致病因子进行的防御机制的重要部分。当肺泡上皮细胞受到损伤,肺泡巨噬细胞被激活,或是血管内皮细胞遭到创伤,均会释放许多致炎因子(proimflamatory factor),使炎症细胞趋向肺内,形成肺泡炎。炎症细胞主要有以下几种,因之构成不同性质的炎症反应。继之,炎症细胞又产生并释放多种细胞因子和趋化因子,形成细胞因子级连锁反应(或称瀑布效应,cytokine cascade)使病变进展。
1.巨噬细胞:肺内巨噬细胞除肺泡腔内、气道、肺间质和胸膜腔、血管床内均有存在。它负责清除粉尘颗粒、吞噬、杀灭微生物并参与免疫反应,监视和抵抗肿瘤的形成,维持和修复正常的肺基质成分,调控肺的正常生理等多方面的工作,是肺内非实质细胞中数量最多的一种细胞,具有十分重要的生理功能,是机体非特异性防御功能中重要成员。因肺泡巨噬细胞(alveolar macrophage,AM)容易从支气管肺泡灌洗液中获得,故巨噬细胞的研究很多是来源于AM的研究资料。存在于其他地区的肺巨噬细胞与AM基本功能相同,但也有区别,如间质内巨噬细胞不依赖Fc受体的吞噬少于AM,对免疫反应的辅助功能比AM多,某些细胞因子的生成及氧自由基生成比AM少,Ⅱ类组织相容抗原(MHC)分子表达比AM多。肺巨噬细胞来源血液中的单核细胞。肺内有对单核细胞特异的趋化因子,如巨噬细胞炎性蛋白-1和-2(MIP-1,-2)和单核细胞趋化蛋白-1(MCP-1),吸引单核细胞由周围血中进入肺,进入肺后它们适应局部环境,成熟为组织巨噬细胞,在此过程中丢失髓过氧化物酶,体积变大,胞浆内细胞器数目增多,溶酶体活性增强,膜表面受体表达增多。肺间质内的巨噬细胞可以在间质内停留数周至数月,参与免疫和炎症反应,补充生理更新的或炎症时增补的AM。肺巨噬细胞可以在局部增殖。它们存在着不同的亚群,具有不同表型和功能。
(1)AM的分泌功能:静止状态的AM多不表现或极低水平的表现它的功能。当经刺激,尤其是配体和相关受体相互作用的刺激下,AM被激活。体积增大,胞饮小泡和伪足增多,膜表面皱褶明显,葡萄糖和氧代谢增强,膜表面分子增加,对传递信号的反应性增强。能产生呼吸爆发(respiratory burst),生成活性氧,经生成诱生型一氧化氮合酶(iNOS),生成NO及其他代谢产物。溶酶体酶、生物活性脂类、多肽生长因子、促炎细胞因子等的分泌均增加。
AM能分泌达100多种生物活性产物,和多核粒细胞不同,AM的多数生物活性产物为活化时新生成的,而多核粒细胞则为分泌固有储存于胞内的内容物。AM释放的生物活性产物列于表3-1中。
(2)AM的吞噬功能和受体:AM表面有多种受体,如对IgG有三种受体(CD64,CD32,CD16)和对IgA,IgE的受体。IgG免疫复合物通过C3b结合后与AM结合。AM并具有与补体有亲和力的CR1、CR3、CR4等受体。并有对C5a、fMLP、PAF、IL-1、TNF-α、IFN-γ、PMA、GM-CSF、组胺、β肾上腺素能激动剂、α-AT、表面活性蛋白等许多重要作用的受体。
表3-1 人肺巨噬细胞释放的生物活性产物

IFN-γ:interferon-γ;TGF-β:transforming growth factor-β,PDGF:platelet-derived growth factor;IGF:insulin-like growth factor
通过受体的作用,AM能识别出有终端甘露糖的感染原,被破坏的肺组织成分,无功能的表面活性物质、蛋白酶-抗蛋白酶复合物、免疫复合物、程序性死亡的白细胞,以及调理化的吸入性颗粒物等进行吞噬,并对无机颗粒可进行非特异性吞噬。若能将被吞入胞内的内容物降解,AM可恢复正常状态,否则AM将循正常途经被清除,但也可以携带着被吞噬内容物留在原处呈慢性活化状态。已知有些致病菌,如结核杆菌、HIV被吞噬后不易被杀死。呈慢性活化状态的AM对周围肺组织造成长时间,持续性的损伤。
由于AM除自身激活时释放活性产物造成损伤外,还可通过募集和激活其他炎症细胞,一方面起着防御作用,另一方面它在损伤中的重要地位是不容忽视的。特别是在多种弥漫性肺疾病的发病中,如特发性间质性肺炎(idiopathic interstitial pneumonia,IIP)中,AM的始动作用已引起注意。
2.中性粒细胞
(1)黏附与移行:中性粒细胞(PMN)是急性炎症反应中的主要炎症细胞,是机体抵抗感染性生物原性致病因子所必需的武器,它的杀菌能力最强。在弥漫性疾病中一些非感染性疾病的炎症反应(如UIP)也占重要地位。在炎症介质作用下,PMN由周围血的循环池进入肺毛细血管网的边缘池中流动。通过白细胞黏附分子与内皮细胞表面配体作用,使黏附再沿血管内膜滚动。继之,内皮细胞表面的细胞间黏附分子-1(inter-cellular adhesion molecule-1,ICAM-1)和E-选择素(E-selectin)表达增多,白细胞表面的β2-整合素(CD11/CD18)增多,并牢固黏附,滚动停止。然后,在趋化因子作用下,白细胞呈阿米巴运动,自内皮细胞连接处游出血管,抵达炎症靶部位。
(2)激活、吞噬和杀菌功能:PMN一旦抵达炎症部位,经细菌或细胞因子致敏(PRIMING),刺激即被激活。脂多糖、小剂量血小板活化因子、TNF-α、IL-1和粒细胞/巨噬细胞克隆刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)都是已知的PMN致敏剂,它们和PMN的受体相互作用并引起细胞内多种信号传递,PMN即处于活跃的活化状态。
在趋化因子作用下,PMN移动中遇到较小颗粒时,即将之包围,将颗粒吞入体内,形成吞噬溶酶体,同时产生活性氧,将细菌消灭。
PMN完全被激活则需经过致敏(PRIMING)和刺激。已知脂多糖(LPS)、小剂量血小板活化因子(PAF)、TNF-α、IL-1和粒细胞/巨噬细胞菌落刺激因子(GM-CSF)均为致敏剂。当到达炎症部位的PMN受到致敏剂与其受体的相互作用,引起细胞内多种信号传递,使之处于活化状态。
PMN杀菌功能可不依赖氧的作用,由胞内阳离子蛋白(细菌通透性增加蛋白、BPI、和防御素)和通过其他蛋白酶类完成;也可于被激活时通过辅酶Ⅱ(reduced form of nicotinamide-adenine dinucleotide phosphate,NADPH)氧化酶的作用下,产生活性氧及代谢产物,它们具有很强的杀菌能力。
在PMN发挥其杀菌,吞噬等防御作用时,也因产生活性氧、一氧化氮和蛋白酶等对肺组织造成损伤。
3.淋巴细胞:在慢性间质性肺疾病的炎性病灶中,时常能发现淋巴细胞的存在,在支气管肺泡灌洗液细胞中淋巴细胞的成分也有所增加。淋巴细胞的功能在炎症反应和修复过程中均起着十分重要的作用。其中辅助T淋巴细胞-1、2(Th-1、Th-2)功能失衡的理论在一些间质性肺病的发病中受到重视并正在进一步深入研究之中。
4.嗜酸细胞、嗜碱细胞、肥大细胞等在炎症过程中也均起着一定的作用,将在相应的疾病中加以阐述。
5.肺泡上皮细胞和血管内皮细胞均是肺组织的结构细胞,传统上均被视为呼吸系统进行正常生理活动的保证。实际上,肺泡上皮细胞和内皮细胞都参与了炎症过程,如Ⅱ型肺泡上皮细胞被损伤后也释放趋化因子MCP-1、IL-8、内皮细胞参与炎症的作用更为显著,它被激活后生成多种炎性介质,如白三烯B4、PAF、IL-8、MCP-1以及其他趋化因子,花生四烯酸代谢产物等。其中活化的内皮细胞和白细胞的黏附是白细胞活化并逸出血管的炎症反应的第一步。
(三)炎症的转归
修复过程几乎与损伤同时进行,正常的修复为炎症消散,保留肺组织基本结构与功能。当炎症持续存在,损伤因素继续进行,慢性炎症反应可表现为肉芽肿形成或肺组织机化和纤维化。
二、肺损伤
能造成肺组织损伤在慢性间质性肺疾病中主要有以下几个环节:
(一)蛋白酶类
肺内存在着蛋白酶和抗蛋白酶的平衡,正常肺的细胞外基质为一动态构造,不断有衰老组分被清除,新生健康组分补充进来。清除衰老组分即为蛋白酶的生理功能,抗蛋白酶将这一作用适度限制,以保证正常的内稳条件(homeostasis)。在炎症状态下,炎症细胞释放过量蛋白酶,超过抗蛋白酶的内稳屏障即造成损伤。机体本身也产生抗蛋白酶,肺局部抗蛋白酶水平也增高,通过支气管肺泡灌洗液的测定,可以反映出蛋白酶和抗蛋白酶失衡的病理生理改变。
1.蛋白酶 已知肺内蛋白酶有中性粒细胞弹性蛋白酶(neutrophile elastase,NE)、组织蛋白酶(cathepsin,CAP)、蛋白酶-3(proteinase-3)等。近年来对肺内基质金属蛋白酶(matrix metalloproteases,MMPs)的研究增多。MMPs包括胶原酶(collagenase)。PMN、巨噬细胞、成纤维细胞、嗜酸粒细胞均可释放胶原酶,活化后可以降解Ⅰ、Ⅱ、Ⅲ型胶原;明胶酶(gelatinase)可降解Ⅳ、Ⅴ、Ⅶ、Ⅷ、Ⅺ型胶原,巨噬细胞弹性蛋白酶和基质溶素(stromelysin)等。MMPs的活性特异地被金属蛋白酶的组织抑制剂-1、2(tissue inhibitor of metalloproteinase-1、2,TIMP-1、2)所抑制。
2.抗蛋白酶 由血浆弥散入肺者有α1-抗胰蛋白酶(alpha1-antitrypsin,alpha1 ACT)和alpha1抗糜蛋白酶(alpha1–antichymotrypsin,alpha1ACT)。在肺内局部生成的有分泌性白细胞蛋白酶抑制剂(elastase specific inhibitor,ESI)又称Elafin,金属蛋白酶的组织抑制剂(TIMP)和alpha-2巨球蛋白(alpha2-macroglobulin,alpha2-M)等。
在间质性肺疾病中对蛋白酶和非蛋白酶的研究不如对肺气肿等疾患那样多,但已有研究者注意到在有些间质病患者BAL中蛋白酶的含量增高,并在探索它们在此类疾病发病中的作用,寻找可能的干预手段及其意义。
(二)活性氧代谢产物和肺损伤
活性氧包括氧自由基和活性高的非自由基氧代谢产物。即O2获取一个不配对电子为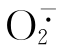 ,活性增强。
,活性增强。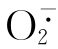 经歧化生成H2O2亦有高活性,当
经歧化生成H2O2亦有高活性,当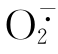 和H2O2生成
和H2O2生成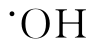 是活性最高的氧代谢物。
是活性最高的氧代谢物。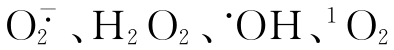 是活性氧的基本成员,具有强的杀菌作用,同时也具有很强的损伤力。活性氧造成的损伤因其生成速度,浓度,部位的不同而表现各异。机体内也存在多种抗氧化机制,对肺损伤的作用,则由活性氧和抗氧化二者间的失衡程度而定。
是活性氧的基本成员,具有强的杀菌作用,同时也具有很强的损伤力。活性氧造成的损伤因其生成速度,浓度,部位的不同而表现各异。机体内也存在多种抗氧化机制,对肺损伤的作用,则由活性氧和抗氧化二者间的失衡程度而定。
1.肺内活性氧的来源 前文已提到炎症时,巨噬细胞NADPH氧化酶产生O2,某些致伤因子如药物博莱酶素通过与DNA和Fe2+形成复合物,将O2还原为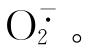 当肺内活性氧生成过多时,造成脂质过氧化,蛋白质氧化,肽链断裂与交联,和DNA分子断裂,肺组织损伤。
当肺内活性氧生成过多时,造成脂质过氧化,蛋白质氧化,肽链断裂与交联,和DNA分子断裂,肺组织损伤。
2.抗氧化机制 主要依靠抗氧化酶,如超氧化物歧化酶(SOD)、过氧化氢酶(catalase CAT)、谷胱甘肽过氧化物酶(GSHPX)等,非酶类抗氧化剂,如维生素E、维生素C、表面活性物质、铜蓝蛋白、转铁蛋白以及牛磺酸等。
抗氧化酶相对或绝对不足可能在某些间质病发病中起作用,已有作者尝试用N-乙酰半胱氨酸(N-acetyl cysteine,NACE)改善GSH与活性氧的失衡,以治疗特发性肺间质纤维化。
(三)NO的损伤作用
机体体内的NO是由L-精氨酸的胍基氮和分子氧在NO合酶(NOS)催化,经辅因子(NADHP,heme等)作用而形成。现已知NOS分三种类型,Ⅰ、Ⅲ类属原生型(cNOS),Ⅱ类为诱生型(iNOS),在细胞因子或LPS刺激下,巨噬细胞、PMN、血管内皮细胞、血管平滑肌细胞等均可诱生iNOS,生成较多的NO。已有较多的资料说明NO参与呼吸系统的防御,损伤和炎症反应,但实验结果显示NO的作用比较复杂,如因其强有力的松弛肺血管平滑肌的作用,已应用于临床治疗某些肺动脉高压疾病,但也发现在支气管哮喘,肺间质纤维化患者的呼气中NO含量增高,而考虑作为反映炎症程度的标识。由于NO一旦生成,迅速被氧化为亚硝酸或硝酸,进一步代谢为亚硝氨和亚硝基硫醇,后者又成为NO或NO+的供体。同时NO在体内能和SOD竞争与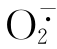 结合产生过氧亚硝酸基阴离子ONNO-,ONNO-可使结构蛋白硝基化,破坏蛋白纤维,也可通过产生活性很强的
结合产生过氧亚硝酸基阴离子ONNO-,ONNO-可使结构蛋白硝基化,破坏蛋白纤维,也可通过产生活性很强的 引起膜脂质过氧化,损伤肺组织。但在间质性肺疾病的发病过程中,NO参与炎症反应,损伤肺实质的资料还很贫乏,有待深入研究,积累。
引起膜脂质过氧化,损伤肺组织。但在间质性肺疾病的发病过程中,NO参与炎症反应,损伤肺实质的资料还很贫乏,有待深入研究,积累。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















