6.7.3 酶化学修饰的动力学机制
酶化学修饰反应的动力学分析取决于反应体系的条件。如果修饰试剂可认为以伪一级反应条件,即修饰试剂的浓度大大高于酶的浓度,则其数学处理是非常简单的。
6.7.3.1 不可逆反应
如果我们考虑一种最简单的反应,即酶E与修饰试剂I生成无活性的酶-修饰试剂复合物EI
![]()
反应速度v为:
![]()
如果[I]》[E],可简化为:
![]()
方程式可写为:
![]()
式中,[E]为t时刻酶的浓度。
对方程积分,时间从0到t时刻,得到酶活性分数的自然对数和时间之间的线性关系:
![]()
因此,以酶活性剩余分数的常用对数对时间作图可以得到一条斜率为-0.43kobs的直线。根据方程,可以由不同浓度[I]下得到的一系列kobs确定k1。如果修饰反应的级数不是1,其线性的偏差是可以预计到的,例如
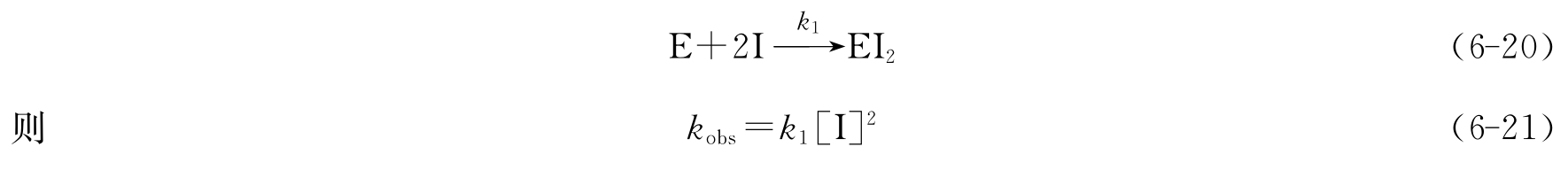
在这种特殊情况下,只有kobs对[I]2作图才能得到一条直线。
修饰反应的动力学级数通常也可以由式(6-21)的对数形式得到:
![]()
式中,n为反应的动力学级数或使1mol酶活性单位失活所需最小的I的物质的量。式(6-22)自从Levy等人首次推导出来,已被广泛应用,尽管如Jabalquinto和Carlson指出的那样,这个关系式并不总是合适的。必须指出的是,这个关系式只对于式(6-14)那样的不可逆机制才适用,对于式(6-23)~式(6-27)那样的可逆机制或在失活前先形成一个可解离复合物的机制是不适用的。这些机制可以通过下面介绍的方法,对数据进行适当的处理而鉴别出来。二级反应速度常数k1也可以通过实现在[E]≈[I]的条件下得到(例如田维熙等人进行的DTNB使鸡肝脂肪酸合成酶失活作用的研究),但这种情况下k1必须通过适当的两次作图才能从斜率得到。
6.7.3.2 可逆反应
对于如下机制:
![]()
可逆地生成无活性的EI复合物。若[I]《[E],则
![]()
假设反应初始的EI浓度为0,反应方程式在平衡条件下可简化地积分,并化简成
![]()
式中,[E0]为E的初始浓度;[E]为任意t时刻的浓度;[Ee]为平衡时的浓度。由于达到平衡是一级反应过程,由ln[E]-[E0]作图,可得到表观速度常数——正反应和逆反应速度常数的总体效果
![]()
因此,kobs对[I]作图得到斜率为k1、外推纵坐标截距为k-1的直线。
6.7.3.3 形成中间体复合物
这种机制是指酶和抑制剂在形成EI复合物之前可形成可解离的复合物
![]()
对于这个机制,表观失活速度为:
![]()
假定平衡常数k2》k-1成立,可得:
![]()
写成倒数形式
![]()
式中,Kdiss=k-1/k1,因此,对于式(6-14)、式(6-23)和式(6-27)所描述的机制可以分别给出kobs对[I]的函数:对于式(6-23)是一斜率为k1并且通过原点的直线;对于式(6-27)是一斜率为k1,外推截距为k-1的直线;最后一种形式最好用倒数方程式(6-30)表示,斜率=Kdiss/k2,截距=1/k2。
通过以kobs对[I]作图,可将3种机制区分开来。应该强调的是,要完全区分这些机制,I的浓度范围应该足够大。例如,反应为式(6-27)的机制,尽管在失活反应过程中有中间体产生,当[I]《k-1/k1时,式(6-29)就变成
![]()
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














