6.7.4 酶活性修饰过程中底物反应动力学
早在1965年,邹承鲁就对单底物酶不可逆抑制动力学进行了系统的研究,提出了底物和抑制剂竞争的概念不仅适合于可逆抑制动力学,而且也可应用于不可逆抑制动力学,并且建立了用定量的判断来区别不可逆抑制剂类型的方法。根据他所推导出来的在有抑制剂存在的条件下底物反应的动力学方程,由一次实验即可得到酶活性不可逆抑制剂的表观动力学常数。近年来,应用这一动力学方法,在酶抑制动力学和酶激活动力学等方面的研究都取得了令人满意的结果。后来,这一理论又被推广到多底物酶反应系统,使之不仅适用于单底物反应,而且也适用于双底物反应的抑制动力学研究,以及酶分子的伸展、再卷曲过程中底物反应动力学的研究。本节重点介绍单底物酶反应,配合型和非配合型两种底物反应动力学。
6.7.4.1 单底物酶反应,非配合型抑制剂
配位型抑制剂在文献中也被称为配合型抑制剂(complexing inhibitors)。对于酶活性可逆和不可逆修饰两种情况,反应机制式(6-32)都同样适用:
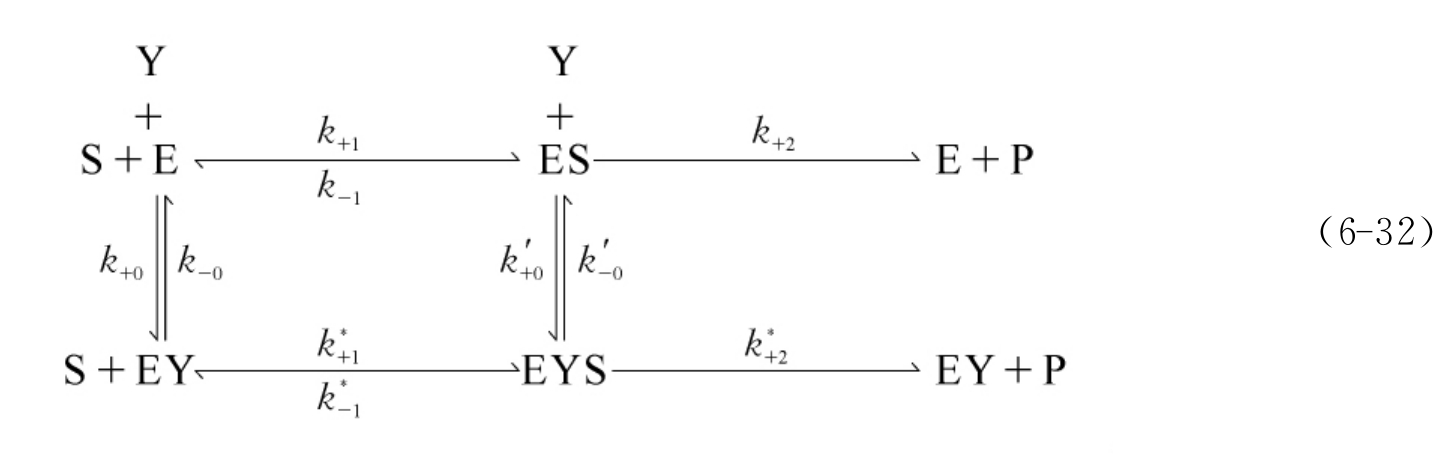
式中,E、S、Y、ES、EY、ESY分别代表酶、底物、抑制剂(或激活剂)及其相应的复合物。在通常的条件下,容易满足[S]》[E0]和[Y]《[E0],且一般来说修饰反应的速度都要远远慢于催化反应中稳态建立的速度,因此下列关系总是成立的

该式可以写成
![]()
式中,A和B分别表示酶同修饰试剂结合的正向和逆向反应表观速度常数。在此条件下可以导出在修饰剂存在下底物反应的动力学方程
![]()
式中,[P]t为t时刻的产物浓度;v和v′分别代表酶与修饰试剂结合前后的反应常数。显然,v>v′时为抑制过程,v<v′时为激活过程。
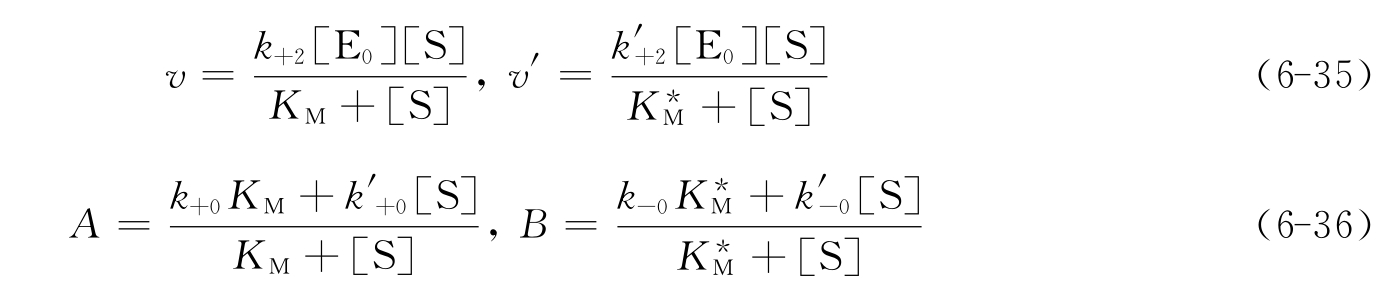
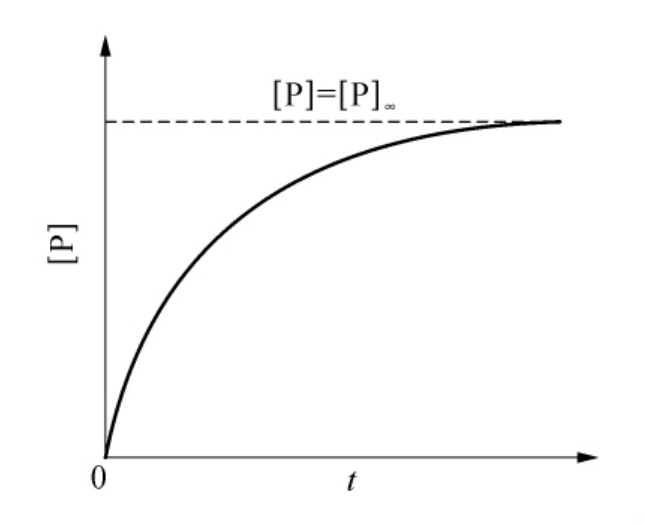
图6-25 底物和不可逆抑制剂同时存在的条件下产物生成的时间过程
(渐近线表示形成产物的最终浓度)
如果EYS无活性,即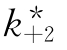 =0(B=0),可以简化为(见图6-25):
=0(B=0),可以简化为(见图6-25):
![]()
当t→∞时,产物浓度[P]为:
![]()
式(6-37)、式(6-38)两式相减并取对数得
lg([P]∞-[P])=lg[P]∞-0.43A[Y]t
因为[Y]最大反应速度vmax和KM均为已知,以lg([P]∞-[P])对t作图,由斜率和截距分别求得A和v的值(见图6-26)。由以1/[P]∞对1/[S]作图的斜率和截距可求得微观速率常数k+0和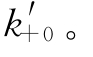
有时酶分子与不可逆抑制剂结合后不完全失活,即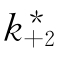 ≠0,此时式(6-34)可化为
≠0,此时式(6-34)可化为
![]()
在这种情况下,[Y]的增加并不改变反应系统终态活性水平,它只是缩短了抑制过程的弛豫时间(见图6-27)。当时间t足够大时,e-A[Y]t=0,[P]t的渐近线方程为[P]s=v′t+(vv′)/A[Y],由ln([P]s-[P]t)对t作图的斜率求得表观速度常数A,再由A/v对1/[S]作图的斜率和截距可求得微观速度常数k+0和k′+0。
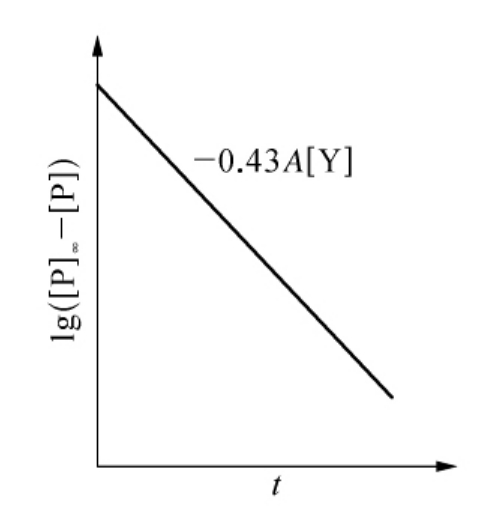
图6-26 由半对数作图求表观速度常数A
(斜率=-0.43A[Y])
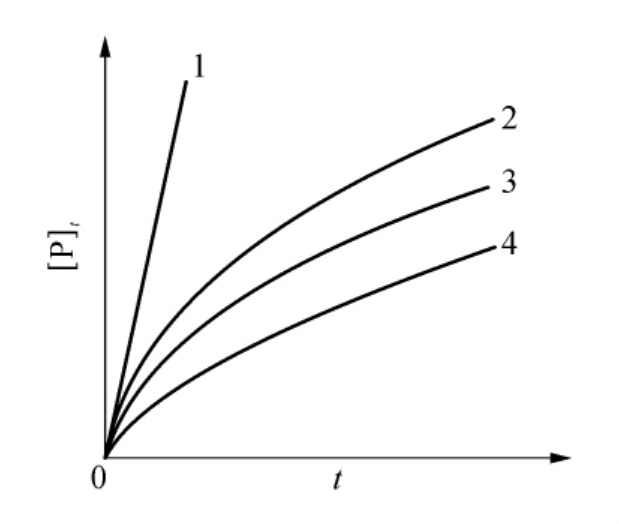
图6-27 酶与抑制剂不可逆结合后仍有部分剩余活性
曲线1为无抑制剂存在的底物反应;曲线2、3、4代表在抑制剂浓度下(1→4浓度增大)的底物反应
对于慢可逆抑制作用(B≠0),虽然酶和抑制剂结合后无活性(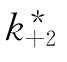 =0),但是由于抑制过程达到终态时还有部分未与抑制剂结合的天然酶存在,因而表现出有部分剩余活性。这时式(6-34)可化为
=0),但是由于抑制过程达到终态时还有部分未与抑制剂结合的天然酶存在,因而表现出有部分剩余活性。这时式(6-34)可化为
![]()
从式(6-40)可以看出,[Y]的增加既缩短了抑制过程的弛豫时间,也降低了反应系统终态的活性水平Bv/(A[Y]+B)(见图6-28)。应用前面的类似作图法可求得A和B以及k+0,k′+0和k′-0。
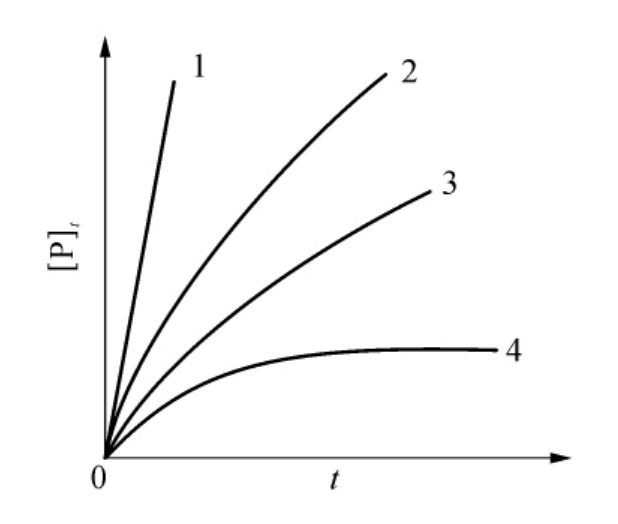
图6-28 底物与慢可逆抑制剂同时存在时的底物反应
正如前面所指出的,当v<v′时,式(6-34)代表激活过程。有些本身就具有活性的天然酶(v≠0),当与激活剂结合产生进一步的激活过程就属于这种情况。由式(6-34)可知,反应系统达到稳态时的活性水平是v和v′的加权平均值。它的弛豫时间τ可由渐近线方程[P]s=(A[Y]v′+Bv)t/(A[Y]+B)-(v′-v)A[Y]/(A[Y]+B)2和直线方程[P]=vt的交点求得,τ=1/(A[Y]+B)(见图6-29)。
由1/τ对[Y]作图可以求得A和B。v可在激活之前直接由实验测定,因而v′可由渐近线方程的斜率计算得到。分别以A/v和B/v对1/[S]作图,可以求得k+0,k′+0,k-0和k′-0。
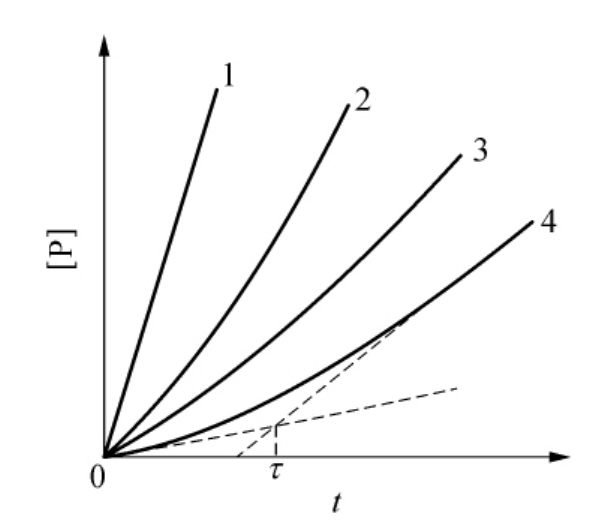
图6-29 酶激活过程的产物生成过程
曲线1为完全激活的酶的底物反应;曲线2、3、4代表不同激活剂浓度下(2→4浓度减小)的底物反应。
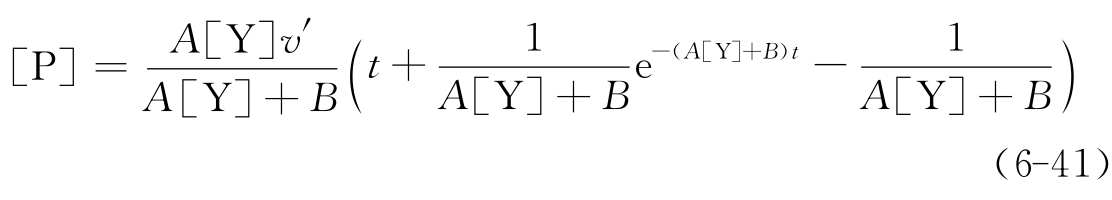
如果酶分子在激活前完全无活性(v=0),例如酶原的激活,也就是说,只有EYS才有活性,式(6-34)可简化为)
激活过程达到终态时的渐近线方程为
![]()
该渐近线在横轴上的截距,即弛豫时间τ=1/(A[Y]+B)。改变[Y],以1/v对[Y]作图,可求得表观速度常数A和B,进而可求得它们所对应的表观速度常数。对于上述两种情况的可逆激活过程,[Y]增加,缩短过程的弛豫时间,而增加终态时的活性水平(见图6-29)。若激活过程不可逆(B=0),[Y]的增加只缩短过程的弛豫时间,不改变终态时的活性水平。
6.7.4.2 单底物酶反应,配合型抑制剂
作为不可逆抑制剂,亲和标记试剂已被广泛地应用于研究酶的活性部位。它与酶分子不可逆作用之前,先与酶分子形成可逆的配合物。这类修饰试剂作为化疗药物有重要的应用前景,事实上有很多激活剂在不可逆激活之前也先与酶分子形成可逆的配合物,如乙酰胆碱酯酶的激活。这类修饰试剂成为配合型修饰试剂,它们在与酶作用过程中的底物反应动力学较之非配合型复杂些。
对于配合型不可逆抑制剂,考虑它在结构上是底物或过渡态中间物的类似物,很可能结合在底物的结合部位上,以致三元复合物EYS不能形成,并且它与酶分子可逆的结合步骤远快于不可逆的修饰过程,因而有
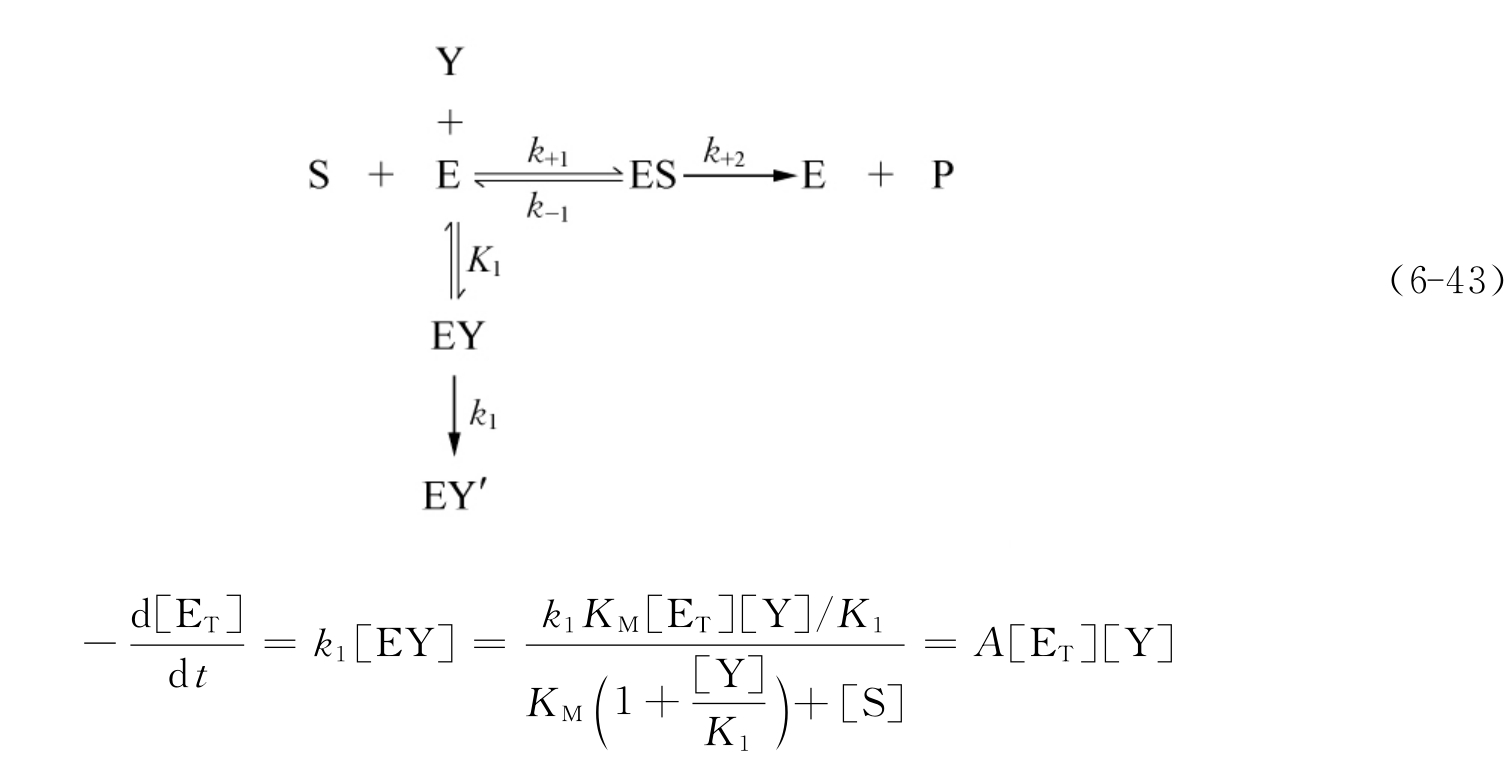
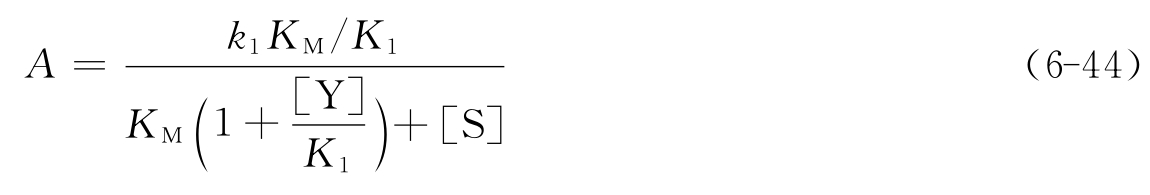
配合型不可逆抑制剂存在时的底物反应动力学方程为
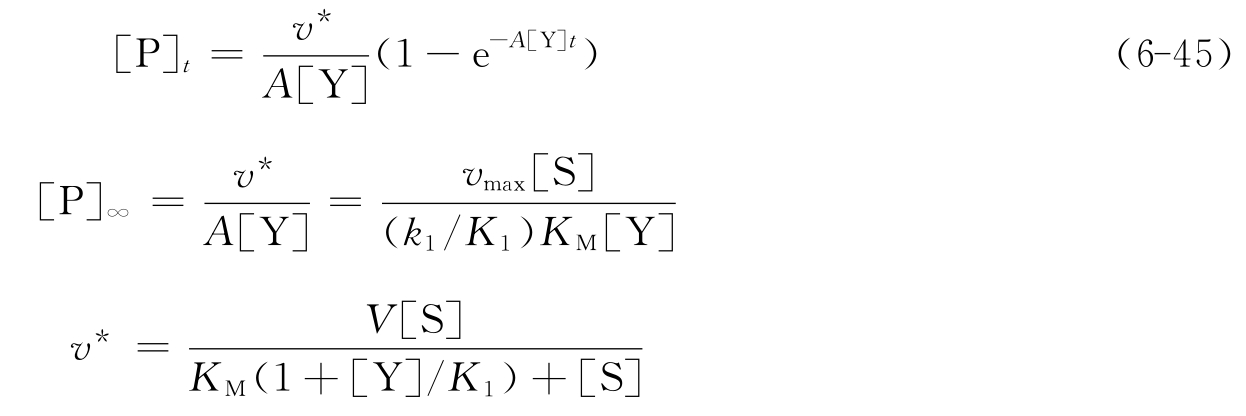
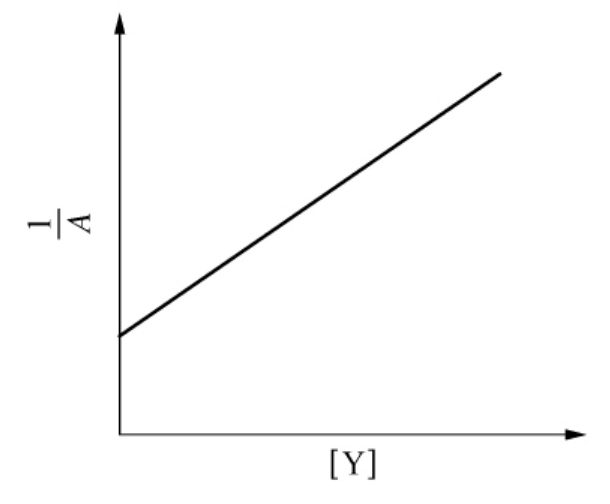
图6-30 配合型抑制反应1/A对[Y]作图
式(6-45)在形式上与式(6-37)完全相同,所不同的只是A、v*、[P]∞的表达形式。k1/K1代替了非配合型不可逆竞争性抑制剂的k+0,比较式(6-45)和式(6-38)可知,对配合型抑制剂来说,1/A和[Y]成正比,而非配合型的抑制剂的表现A与[Y]无关。这也正是用作图法区分这两类抑制剂的理论依据,其中的k1和K1值可由1/A对[Y]作图,由斜率和截距求得(见图6-30)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















