2 针对鲆鲽类腹水病的迟钝爱德华氏菌减(弱)毒活疫苗的研制工作
2.1 迟钝爱德华氏菌减毒活疫苗的研制工作
本岗位于“十一五”期间根据已完成的EIB202全基因组测序信息,筛选出与迟钝爱德华氏菌致病性相关的40个基因,采用无标记缺失突变技术对以上40个基因进行了敲除,以EIB202为出发菌株,在内源性抗性质粒消除的基础上,基于aroC营养缺陷型后,成功构建了毒力相关功能基因的双缺失菌40余株。在此基础上,首先以模式动物斑马鱼进行了部分突变株的安全性及免疫保护率的初步评价,经过筛选得到了一株免疫保护力较高的突变株WED,该菌株对斑马鱼进行注射或浸泡免疫,保护率均达到80%以上。根据以斑马鱼为模式动物的疫苗株初筛工作结果,以WED疫苗候选株对大菱鲆进行浸泡和注射免疫,该菌株在大菱鲆各脏器中的增殖能力远低于野生菌株,证明该菌株具有良好的安全性。无论采取注射免疫还是浸泡免疫方式,该疫苗候选株和ΔaroC对野生菌株EIB202的免疫保护率均在70%以上。这些工作为“十二五”本课题组进行鲆鲽类腹水病疫苗的转基因生物安全评价以及疫苗新兽药注册证的申报和获得奠定良好基础。2011年3月份WED疫苗株获得了转基因生物安全评价中间试验农业部批件。
针对WED疫苗株,2011年度本岗位主要进行转基因生物安全评价中间试验。试验地点为体系试验站烟台开发区天源水产有限公司,试验时间为6月至11月。主要试验结论如下:
(1)本研究中的迟钝爱德华氏菌减毒活疫苗WED是经反向疫苗学策略通过组合基因缺失筛选所获得相对免疫保护力较好的一个疫苗株。以大菱鲆为试验模型,该疫苗株以106 CFU/mL和105CFU/g体重的剂量分别用浸泡和腹腔注射免疫可以达到80%以上的免疫保护率。
(2)迟钝爱德华氏菌减毒活疫苗WED在大剂量和单剂量连续接种的实验中,靶动物和非靶动物没有出现任何临床症状;对免疫前后的靶动物进行组织病理学分析表明,靶动物体内器官组织也未见异常病变;同时,免疫靶动物和非免疫靶动物在混合养殖的情况下,非免疫靶动物未出现任何异常的临床症状,具有很好的安全性。
(3)迟钝爱德华氏菌减毒活疫苗WED在实验室反复传代情况下,其氨基酸营养缺陷型的生长特性保持稳定,pEIB202和T3SS基因eseBCD缺失的基因型稳定;该载体疫苗在靶动物(大菱鲆)体内连续传代以后,对鱼体影响逐级减弱至无,并未出现毒力回复或返强的征候。
(4)迟钝爱德华氏菌减毒活疫苗WED在养殖水体和靶动物体内的稳定存留时间分别不超过6天和10天,这种短的存留时间很好地降低了其在自然水体和动物体内传播的潜在风险,使该疫苗具有很好的生物安全性。
综上所述,中间试验阶段结果表明,缺失pEIB202质粒、aroC基因和T3SS eseBCD基因簇的迟钝爱德华氏菌减毒活疫苗WED具有良好的对鱼体和对水体环境以及对操作人员的转基因生物安全性。基于以上试验结果,本课题组于2011年度10月底向国家农业部转基因生物安全办公室提交了在山东省的环境释放(大田)试验申请。
在WED疫苗株的效力试验方面,2011年度进一步用大菱鲆和模式鱼种斑马鱼进行了其发挥效力机制方面的工作。试验首先用ELISA测定了WED免疫大菱鲆后1~4个月后其特异性抗体IgM的产生情况。结果表明,1~4个月能产生特异性IgM,但是抗体滴度非常低,几乎可以忽略不计(图2),但是1~4个月WED对大菱鲆的相对免疫保护率(RPS)达到85%~92%以上,这些结果表明WED可能在大菱鲆中激起以疫细胞免疫为主的免疫保护作用。
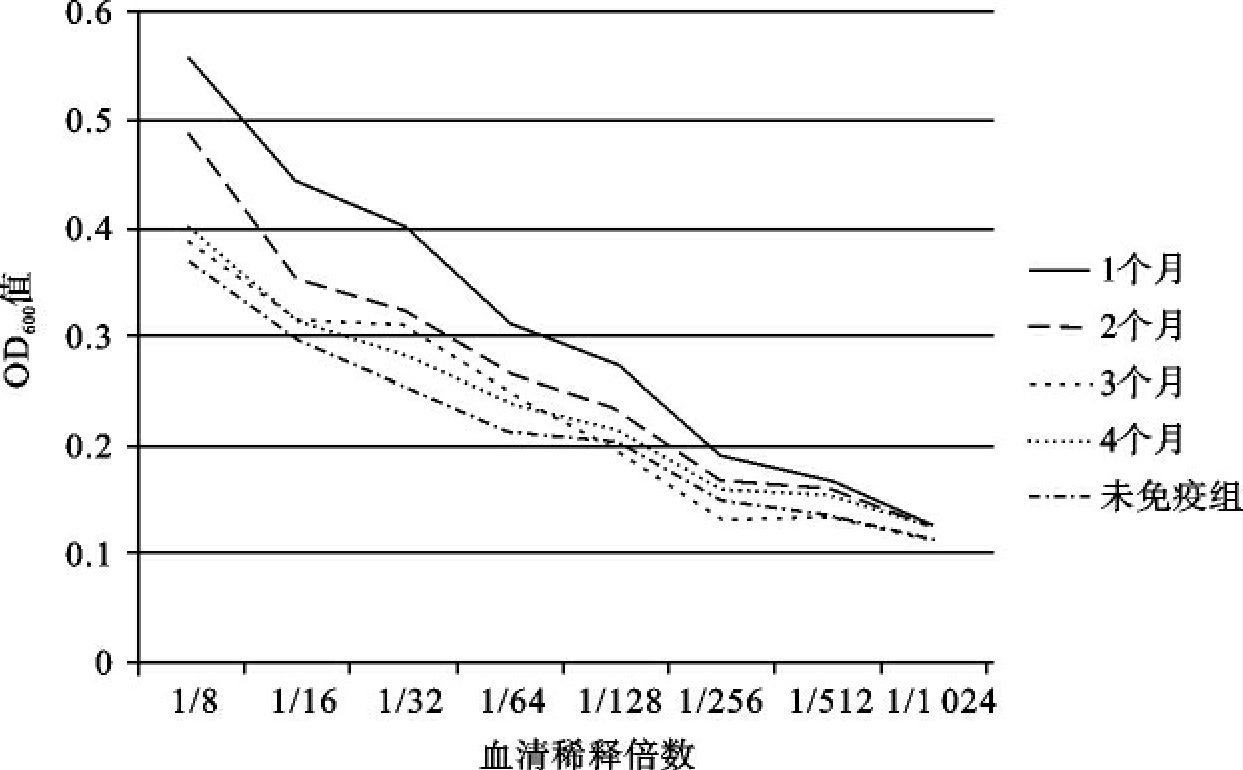
图2 WED免疫大菱鲆后不同时间特异性IgM抗体滴度
为了初步验证我们的假设,我们先选用模式鱼种———斑马鱼进行免疫后肝脾中免疫基因表达的研究,采用的方法是深度RNA-Seq和qRT-PCR的方法,结果表明,WED减毒活疫苗免疫后,在斑马鱼中获得免疫后1个月81%的相对免疫保护率,该结果与在大菱鲆中的免疫保护效率相当,表明斑马鱼可以作为模型来研究WED以及迟钝爱德华氏菌的感染、定植和免疫保护作用。基于454平台技术的深度RNA-seq结果显示,WED免疫斑马鱼后在肝中显著上调的基因个数为2253,显著下调的基因个数为2393(图3)。在其中主要激起急性期反应(acute phase responses),激起补体途径(complement pathway),各种TLR信号转导通路(toll-like receptor signal pathway)以及MAPK信号转导和级联通路。更为重要的是WED免疫斑马鱼后显著激活MHC-Ⅰ抗原递呈和处理途径并且抑制MHC-Ⅱ抗原递呈和处理途径,从而抑制体液免疫并上调机体的细胞免疫途径,起到对胞内寄生菌迟钝爱德华氏菌的杀伤和清除作用(图4)。后续工作中将进一步用大菱鲆验证在斑马鱼中所取得的免疫基因表达谱。

图3 WED免疫斑马鱼后肝脏基因深度RNA-Seq显著上调和下调基因个数TLR
2.2 迟钝爱德华氏菌天然弱毒活疫苗的研制工作
2008年本实验室从山东烟台罹患爱德华氏菌病的大菱鲆肝脏、脾脏、肾脏分离获得了一系列迟钝爱德华氏菌株,命名为EIB101~EIB312。其中EIB311和EIB312为天然弱毒株,分别命名为EIBAV1和EIBAV2。对于其中EIBAV1菌株,采用腹腔免疫方式,可以使大菱鲆较好地抵抗EIB202毒株的攻击,产生接近90%以上的免疫保护率。基因测序表明该菌不含有EIB202中所存在的pEIB202质粒,并且其毒力基本缺失。更为重要的是,该菌株对大菱鲆的毒性非常低,LD50达到107.5 cfu/g体重,相比之下,EIB202强毒株的LD50达到102.2 cfu/g体重,因此,EIBAV1与EIB202的毒力相差100 000以上,为天然的弱毒菌株,并且具有弱毒活疫苗的特征。
为了进一步考察该菌株是否能够成为大菱鲆腹水病的迟钝爱德华氏菌弱毒活疫苗株,2011年度在实验室试验的基础上,完善了临床前的试验数据,并且委托浙江易邦生物技术有限公司进行了5批疫苗产品的GMP生产线的中试试生产。形成了“大菱鲆腹水病迟钝爱德华氏菌弱毒活疫苗制造及检验试行规程”以及“大菱鲆腹水病迟钝爱德华氏菌弱毒活疫苗使用规程”。在整理实验数据的同时与烟台开发区天源水产有限公司签订了临床试验协议,并于11月底向农业部兽药评审中心进行申请临床试验。

图4 qRT-PCR验证和比较肝脾中免疫特异基因的表达
(岗位专家 张元兴)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














