3.2.2 溶液中的酸碱电离平衡
1.一元弱酸、弱碱的电离平衡
一元弱酸、弱碱在水中电离是水溶液中一类十分重要的平衡,称为水溶液中的酸碱电离平衡,也称酸碱平衡。酸碱平衡服从化学平衡的基本规律,可用一个相应的平衡常数来表示酸碱电离平衡的特征。这个平衡常数叫电离常数,用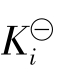 表示(弱酸也可用
表示(弱酸也可用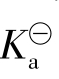 表示,弱碱用
表示,弱碱用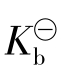 表示)。
表示)。

上二式中[]表示各平衡组分的相对平衡浓度。即相应组分的平衡浓度与标准浓度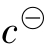 之比。例如
之比。例如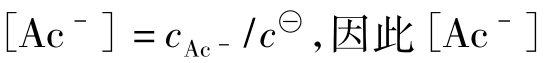 是无量纲的数,这样就能保证
是无量纲的数,这样就能保证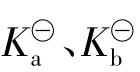 都是常数而无量纲。对任何指定的弱酸弱碱而言,或是对于任何一指定的酸碱平衡而言,在指定温度下,其
都是常数而无量纲。对任何指定的弱酸弱碱而言,或是对于任何一指定的酸碱平衡而言,在指定温度下,其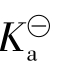 或
或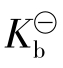 都是定值,并不随任何平衡组分的浓度(无论是起始浓度还是平衡浓度)而改变。
都是定值,并不随任何平衡组分的浓度(无论是起始浓度还是平衡浓度)而改变。
![]()
电离常数的大小反映了该电解质电离程度的大小。电离程度大小也可用电离度α来表示,即但是任何指定的弱酸或弱碱的电离度都是随其初始浓度不同而变化的,起始浓度越大,其电离度α越小。这是α与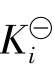 不同之处。但对同一酸碱电离平衡而言,其K
不同之处。但对同一酸碱电离平衡而言,其K
i与α之间是相关的,可以互相换算。
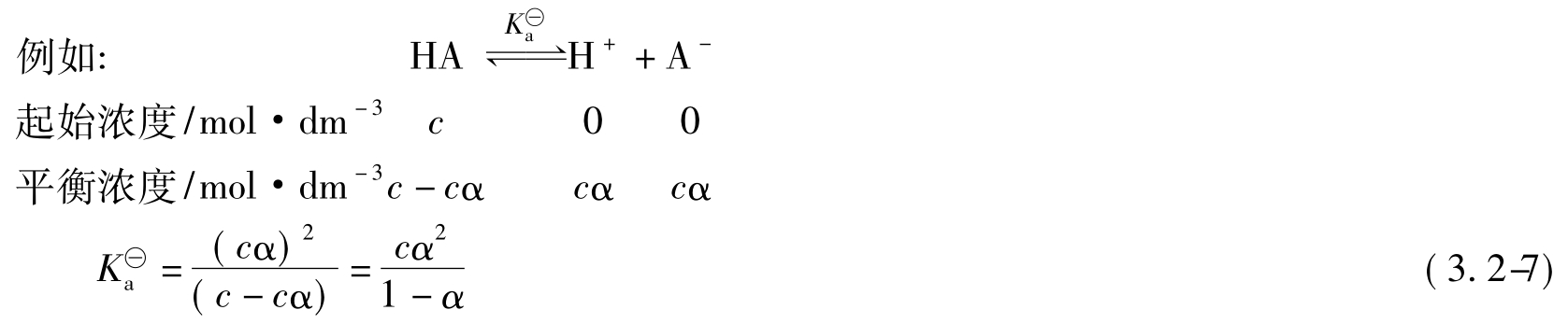
由于α很小,可作近似计算:1-α=1

式中:c为一元弱酸的起始浓度;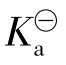 为电离常数;α为电离度。
为电离常数;α为电离度。
上式亦称为稀释定律表达式,应注意到溶液浓度越大,电离度越小,但溶液中电离出来的离子浓度却越大,这是因为
![]()
2.多元弱酸的电离平衡
多元弱酸,像H2S、H2CO3等在水中的电离是分步进行的,称为分级电离。每一级电离都形成独立的电离平衡,具有自己的电离常数。只有当各步分级电离都达到平衡时,多元弱酸或弱碱的多级电离才能达到平衡。反之,当多元弱酸弱碱体系达到整体酸碱平衡时,其任一分级电离必然都已达到平衡了。而当整个体系达到平衡后,体系中每项平衡组分的平衡浓度都只有一个唯一的值。如果体系中同时有几个平衡涉及到同一组分,那么该组分的平衡浓度必须同时满足所有这些平衡。根据这两点基本原则,就可以按已知条件,通过分级平衡或总体平衡常数计算各平衡组分的平衡浓度。以H2S为例,分以下二级电离。

二级电离:HS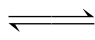 -H++S2-
-H++S2-
![]()
通常一级电离比二级电离容易得多,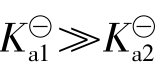 ,因此H2S溶液中H+离子主要是由一级电离产生,H+离子浓度近似等于
,因此H2S溶液中H+离子主要是由一级电离产生,H+离子浓度近似等于
![]()
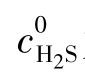
为H2S的起始浓度。
由于二级电离常数很小,远小于一级电离常数,因二级电离而引起的[H+]与[HS-]的变化可忽略不计,即使考虑了二级平衡,仍然可以认为平衡体系[H+]=[HS-]。
依据H2S的第二级电离平衡,可以求出平衡体系中[S2-]=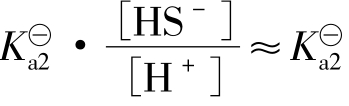 ,因此在H2S的水溶液中,由H2S自然电离产生的游离酸根S2-离子的平衡浓度,近似等于H2S的第二级电离常数
,因此在H2S的水溶液中,由H2S自然电离产生的游离酸根S2-离子的平衡浓度,近似等于H2S的第二级电离常数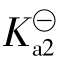 ,是个定值,但很小。对于二元弱酸的电离平衡不作更深一步要求。
,是个定值,但很小。对于二元弱酸的电离平衡不作更深一步要求。
3.水的离子积和溶液的pH值
纯水是一种很弱的电解质,存在着以下电离平衡
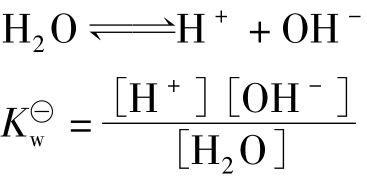
1L纯水中有55.55molH2O,由于水的电离很弱,达电离平衡时,[H2O]仍近似等于55.55mol·L-1,为一常数。在常数表达式中可将其并入常数项中,故可写成
![]()
实验测得在22℃时,水中[H+]=[OH-]=10-7mol·L-1
![]()
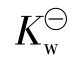
称为水的离子积常数。只要是水溶液,无论呈中性、酸性或碱性,也不管溶质是什么,浓度
是多少,溶液中
![]()
弱酸或弱碱溶液的酸碱性可用其H+(或OH-)离子浓度来表示。在实际应用中,为了计算方便,常用H+离子浓度的负对数pH,或OH-离子浓度的负对数pOH来表示:
pH=-lg[H+]
pOH=-lg[OH-]=14-pH
pH=7,即[H+]=10-7=[OH-],溶液呈中性
pH<7,即[H+]>10-7>[OH-],溶液呈酸性
pH>7,即[H+]<10-7<[OH-],溶液呈碱性
4.同离子效应和缓冲溶液
在弱电解质溶液中,加入具有相同离子的强电解质,使弱电解质的电离度降低的现象,称为同离子效应。如醋酸HAc溶液中加入NaAc盐,结果使HAc的电离度降低,溶液中H+浓度减少。这与化学平衡中加入生成物,使平衡向逆方向移动的道理是一样的。
由弱酸及其盐(如HAc-NaAc)、或弱碱及其盐(如NH3·H2O-NH4Cl)组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。组成缓冲液的弱酸(或弱碱)与其盐组成了一个缓冲对。缓冲溶液的pH值计算公式如下:
弱酸及其盐组成的缓冲溶液(酸性缓冲液)为

式中:c酸、c盐为组成缓冲溶液的弱酸及弱酸盐的起始浓度;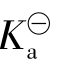 为弱酸的电离常数。由弱碱及其盐组成的缓冲溶液(碱性缓冲液)同样有:
为弱酸的电离常数。由弱碱及其盐组成的缓冲溶液(碱性缓冲液)同样有:
![]()

式中: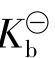 为组成缓冲对的弱碱的电离常数;c碱/c盐是缓冲液的组分配比。若c酸/c盐或c碱/c盐等于1时,则缓冲溶液的pH(或pOH)等于相应的弱酸或弱碱的
为组成缓冲对的弱碱的电离常数;c碱/c盐是缓冲液的组分配比。若c酸/c盐或c碱/c盐等于1时,则缓冲溶液的pH(或pOH)等于相应的弱酸或弱碱的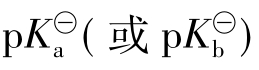 。必须指出,缓冲溶液的缓冲能力是有限的。若加入大量强酸或强碱后,缓冲体系中某一组分被消耗完了,则缓冲溶液将失去其缓冲能力,溶液的pH将会发生较大的变化。而如果只是将缓冲溶液稀释,由于c酸/c盐或c碱/c盐比值不变,则缓冲溶液稀释后pH值保持不变。
。必须指出,缓冲溶液的缓冲能力是有限的。若加入大量强酸或强碱后,缓冲体系中某一组分被消耗完了,则缓冲溶液将失去其缓冲能力,溶液的pH将会发生较大的变化。而如果只是将缓冲溶液稀释,由于c酸/c盐或c碱/c盐比值不变,则缓冲溶液稀释后pH值保持不变。
【例3.2-2】在0.1mol·L-1的HAc溶液中加入固体NaAc,使NaAc浓度为0.1mol·L-1,并设溶液的体积不变,试比较加入NaAc前后溶液的H+离子浓度和HAc的电离度的变化。已知HAc的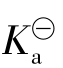 为1.8×10-5。
为1.8×10-5。
解:(1)设加入NaAc以前,溶液中的H+离子浓度为cH+=xmol·L-1([H+]=x),则
![]()
起始浓度/mol·L-10.100平衡浓度/mol·L-10.1-xxx
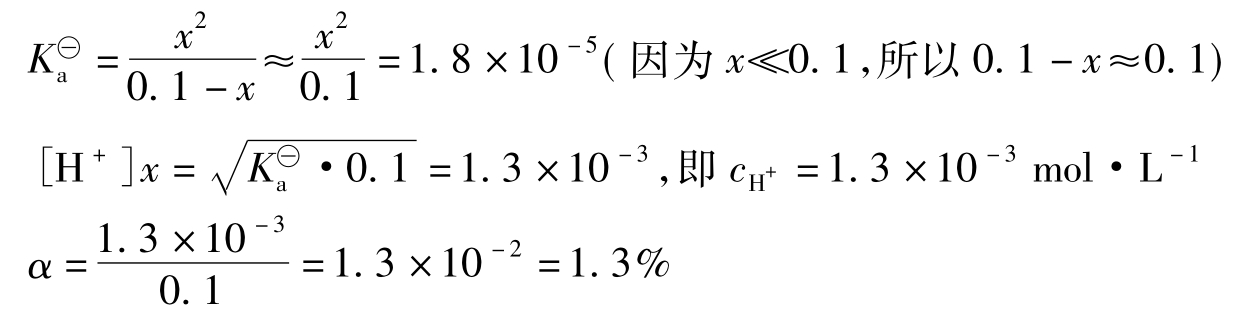
(2)设加入NaAc后,溶液中H+离子浓度为cH+=ymol·L-1([H+]'=y),则
![]()
起始浓度/mol·L-10.100.1
平衡浓度/mol·L-10.1-yy0.1+y
由于y与0.1相比是很小的值,可忽略不计。
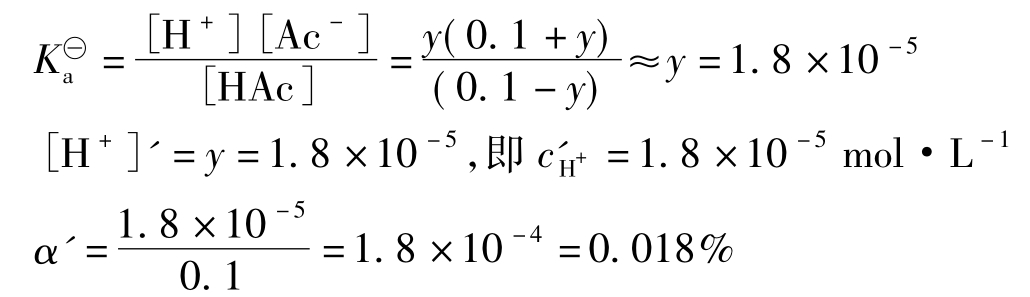
加入NaAc前后相比
![]()
表明加入NaAc后,Ac-的同离子效应抑制了HAc的电离,使HAc的电离度降低了,从1.3%降低到0.018%,因而HAc溶液中[H+]亦降低了,从1.3×10-3mol·L-1降低到1.8×10-5 mol·L-1。
若向上述两种溶液(纯HAc溶液,及HAc+NaAc溶液)中分别加入相同量(少量)的强酸或强碱,再计算溶液中[H+](或pH)值的变化,即可看出纯HAc溶液不具缓冲能力,pH将明显变化。而(HAc+NaAc)溶液,则具有缓冲能力,其pH值基本不变。(读者可参考教科书中例题,自行运算检验。)
【例3.2-3】向浓度为0.10mol·dm-3的HAc溶液中加入固体NaAc,使NaAc的浓度为0.10mol·dm-3,设NaAc加入后溶液的总体积不变,求该溶液中H+离子浓度及pH值。
解:按题意,该溶液为HAc-NaAc缓冲液,其中醋酸与醋酸钠的浓度分别为cHAc=0.10mol·dm-3,cNaAc=0.10mol·dm-3。
故按式3.2-13可计算
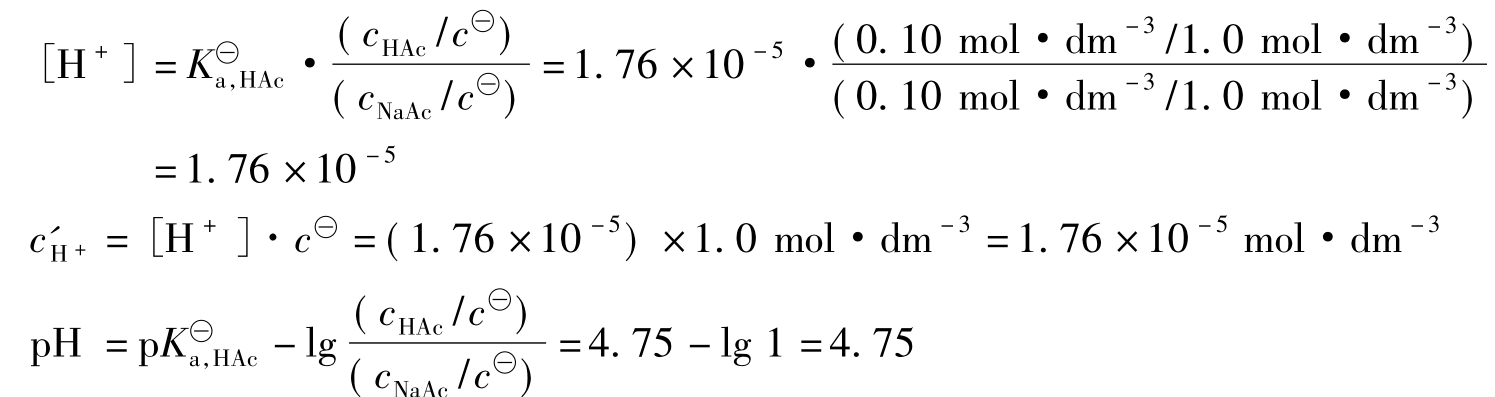
答:该缓冲溶液中H+离子浓度为1.76×10-5mol·dm-3,pH=4.75。这个结果与例3.2-2所得结果是相同的。
配制缓冲溶液时,首先要根据需要选择合适的缓冲对。方法是,若要求维持酸性环境就应选择弱酸或弱酸盐缓冲对;若要维持碱性pH环境,则应选择弱碱与弱碱盐配缓冲溶液。然后再按照需要控制pH范围。根据弱酸(或弱碱)的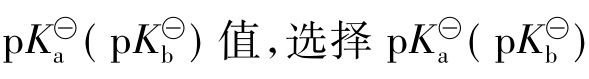 在所需pH值±1范围内的弱酸(或弱碱)及其盐组成共轭对,并可进一步按公式3.2-13、3.2-14计算其组分的配比。
在所需pH值±1范围内的弱酸(或弱碱)及其盐组成共轭对,并可进一步按公式3.2-13、3.2-14计算其组分的配比。
【例3.2-4】试配制一种缓冲液,能维持pH=10.25左右。
解:配制缓冲液首先应确定缓冲液的组分,按题意要求,应配制一种碱性缓冲液,首先要选择合适的弱碱。根据pH=(14-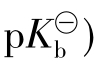 ±1的范围,求得弱碱的
±1的范围,求得弱碱的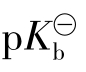 应在(14.0-10.25)±1的范围内,查表2-2可知NH3-NH4Cl体系符合要求。为方便起见,假定欲配制的缓冲液体积为1dm3,所用的NH3·H2O配成浓度为1.0mol·dm-3,加入NH4Cl固体后总体积的变化很小,可忽略不计。
应在(14.0-10.25)±1的范围内,查表2-2可知NH3-NH4Cl体系符合要求。为方便起见,假定欲配制的缓冲液体积为1dm3,所用的NH3·H2O配成浓度为1.0mol·dm-3,加入NH4Cl固体后总体积的变化很小,可忽略不计。
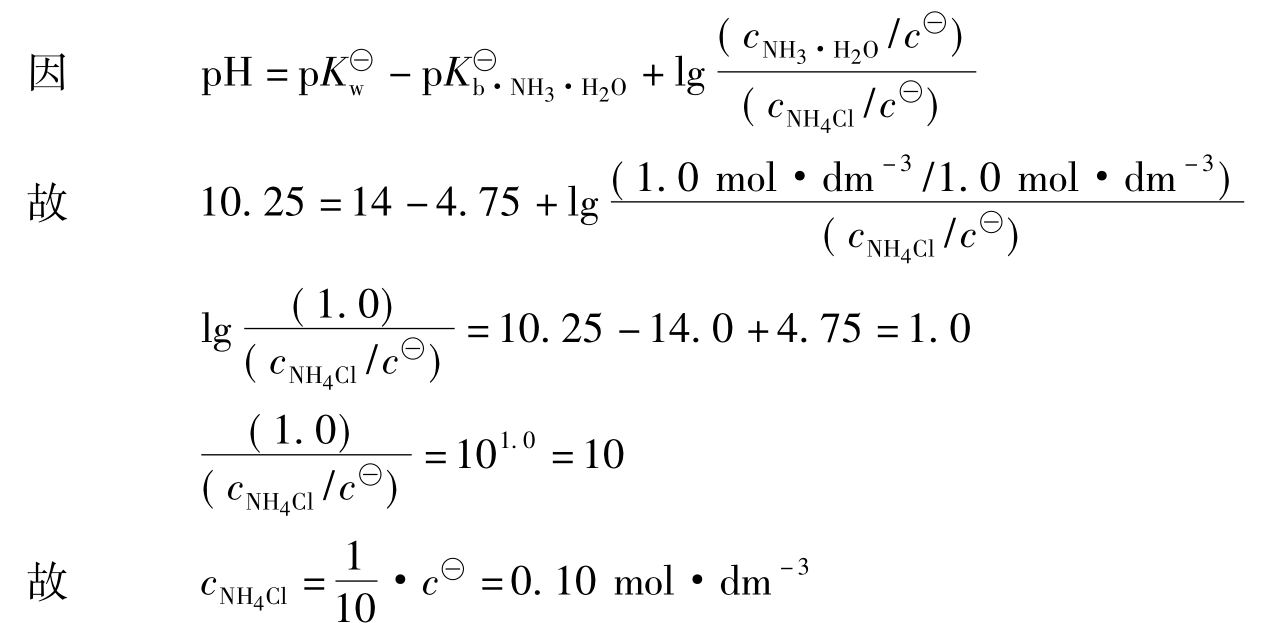
答:将0.1mol的NH4Cl固体,加入到1dm3浓度为1.0mol·dm-3的氨水中,组成的缓冲液能维持pH=10.25。
5.盐类的水解平衡
弱酸盐或弱碱盐与水作用,生成弱酸或弱碱,这种反应称为盐类的水解。
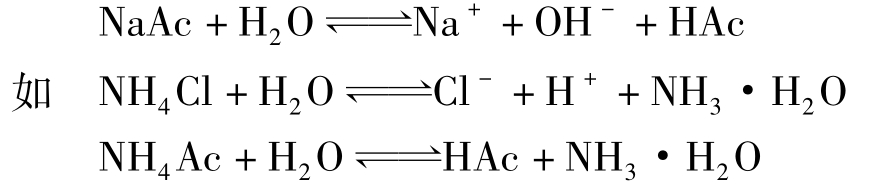
盐类的水解反应,实质是盐的离子与H2O作用,生成了难电离的弱酸或弱碱,引起水的电离平衡的移动,导致溶液pH值改变。弱酸强碱盐水解呈碱性;弱碱强酸盐水解呈酸性;弱酸弱碱盐水解结果呈现酸性或碱性则要视弱酸和弱碱的相对强弱而定。而强酸强碱盐则基本不发生水解。
盐类水解反应是酸碱中和反应的逆过程,反应的终点即达到平衡。这就是水解平衡。可用一般平衡规则来处理水解平衡,进行计算。以一元弱酸强碱盐NaAc为例,其水解平衡
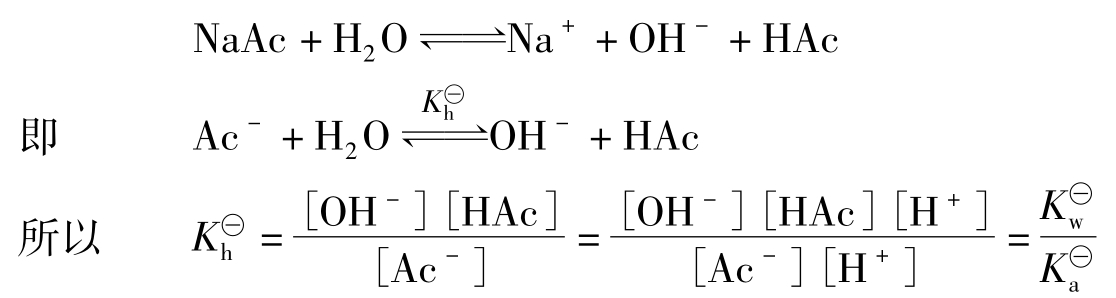
式中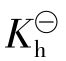 即为NaAc(或Ac-)的水解平衡常数,简称水解常数。它可由相应的弱酸电离常数
即为NaAc(或Ac-)的水解平衡常数,简称水解常数。它可由相应的弱酸电离常数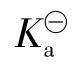
与水的离子积常数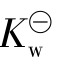 求出。同样对于像NH4Cl(或
求出。同样对于像NH4Cl(或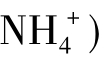 这样强酸弱碱盐而言,可以有
这样强酸弱碱盐而言,可以有
![]()
从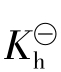 的表达式可以看出,组成盐的弱酸(或弱碱)的酸性(或碱性)愈弱,即
的表达式可以看出,组成盐的弱酸(或弱碱)的酸性(或碱性)愈弱,即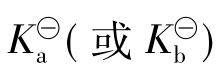 越小,则由它们组成的盐的
越小,则由它们组成的盐的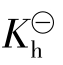 越大,即该盐越易水解。
越大,即该盐越易水解。
多元弱酸弱碱盐的水解是分级进行的。例如Na2CO3的水解:

由于多元弱酸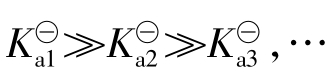 ,所以相应地
,所以相应地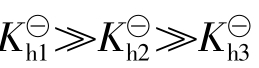 ,…。因此在判断盐类水解的结果(如溶液的酸碱性)时,实际上主要依据一级水解的结果,以后各级水解的影响通常可忽略不计。盐类水解程度也可用水解度(h%)来表示。
,…。因此在判断盐类水解的结果(如溶液的酸碱性)时,实际上主要依据一级水解的结果,以后各级水解的影响通常可忽略不计。盐类水解程度也可用水解度(h%)来表示。
![]()
水解度与水解常数的关系和电离度与电离常数的关系相似:
![]()
在盐溶液中加入相应的强酸(或强碱),即增加溶液中的H+(或OH-)离子浓度,可以抑制强酸弱碱盐(或强碱弱酸盐)的水解。这可用平衡移动的观点加以解释。
6.酸碱质子理论
按酸碱质子理论,凡能给出质子的物质是酸(质子酸),能接受质子的物质是碱(质子碱)。
酸失去质子变成碱,碱得到质子就变成酸。这对酸和碱具有共轭关系,称为共轭酸碱对。
例如: 酸碱+H+
酸碱+H+

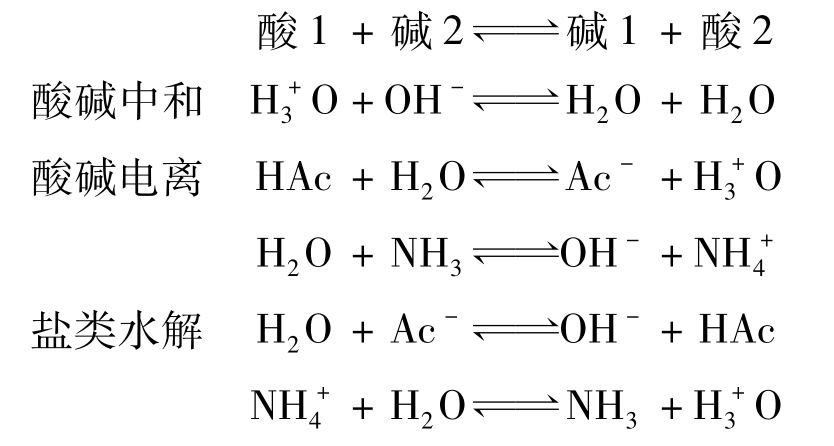
据此,水溶液中各类涉及质子的反应与平衡,实质都是质子传递的过程,是争夺质子的平衡:
【例3.2-5】下列物质在水溶液中,哪些是既可作酸又可作碱的?
H2CO3、HCl、NaCO3、CO2、NaOH、NaHCO3、H2O
解:上述物质中,H2CO3、HCl在水溶液中只能放出H+,而不能接受H+,故只能作酸,而不能作碱。
而NaCO3、NaOH和CO2在水溶液中只能接受H+,而不能放出H+,故只能作碱而不能作酸。
NaHCO3与H2O是既可作酸又可作碱的:

【例3.2-6】下列各组溶液中,哪些具有缓冲作用?
(1)0.10mol·L-1的HAc与0.10mol·L-1的NaOH溶液等体积混合。
(2)0.10mol·L-1的HAc与0.05mol·L-1的NaOH溶液等体积混合。
(3)0.10mol·L-1的HAc与0.20mol·L-1的NaOH溶液等体积混合。
解:上述三种溶液中两种组分相互作用的结果是:
(1)生成0.05mol·L-1的NaAc;
(2)生成0.025mol·L-1的HAc与0.025mol·L-1的NaAc;
(3)生成0.05mol·L-1的NaAc与0.05mol·L-1的NaOH。
显然(1)为纯NaAc;(2)为HAc+NaAc溶液;(3)为NaAc+NaOH溶液,只有(2)溶液组成缓冲对,具有缓冲作用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














