4.3.1.1 一元弱酸的解离平衡
1.解离常数 在一元弱酸HA的水溶液中存在着下列质子转移反应:
这类反应一般都能很快达到平衡,称其为解离平衡(或电离平衡)。根据平衡原理,标况下HA的解离平衡常数表达式应为
弱酸的解离常数可以借助pH计先测得溶液的pH,然后通过计算来确定。已知弱酸的解离常数Ka,就可以计算出一定浓度的弱酸溶液的平衡组成。实际上,在弱酸溶液中同时存在着弱酸和水的两种解离平衡:
一元弱酸(碱)
由平衡常数式可得
将其代入式(4.7)中得
当cHA·Kw≥20Kw时,可忽略Kw(水解离所产生的H+是可以忽略的)。
这是计算一元弱酸水溶液酸度的近似式。
当c0Ka≥20Kw,且c0/Ka≥500时,可认为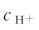 与c0相比可忽略,由式(4.9)可得最简式
与c0相比可忽略,由式(4.9)可得最简式
例4.1 计算25℃时,0.10mol·L-1HAc溶液中的H、Ac-、HAc、OH-浓度及溶液的pH。
解:查附表Ka=1.8×10-5,H3O+通常可简写为H+,则解离反应为:
2.解离度和稀释定律 在弱酸(或弱碱)的解离平衡组成计算中,常用到解离度的概念,以αHA表示之。解离度αHA是这样定义的:已解离的弱电解质分子数占其分子总数的百分数。在定容反应中,已解离的弱酸(或弱碱)的浓度与原始浓度之比等于其解离度。弱酸的解离度可表示为:
一元弱酸解离度的大小可以表示酸的相对强弱。在温度、浓度相同的条件下解离度大的酸,Ka大,其pH小,是较强的酸;解离度小的酸,Ka小,其pH大,为较弱的酸。以HA(aq)的解离平衡为例,α与Ka的定量关系如下:
式(4.14)表明了一元弱酸溶液的浓度、解离度和解离常数间的关系,随着溶液浓度的降低,解离度增大,这种规律叫做稀释定律。它表明:在一定温度下,Ka保持不变,溶液在一定浓度范围内被稀释时,α增大。由于α随浓度而变,而Ka不随浓度而变,因此,Ka能更本质地反映弱电解质的解离特性。
4.3.1.2 一元弱碱溶液的解离平衡A
一元弱碱的解离平衡组成的计算与一元弱酸的解离平衡组成的计算没有本质上的差别。在弱碱B的溶液中:
Ka称为一元弱碱的解离常数。
与一元弱酸类似,对于一元弱碱来说:
例4.2 已知25℃下,0.20mol·L-1的氨水的pH为11.27。计算溶液中OH-的浓度、解离度α和氨的解离常数Kb。
4.3.1.3 多元弱酸的解离平衡
一元弱酸、弱碱的解离过程是一步完成的,多元弱酸、弱碱的解离过程是分步进行的。前文介绍的一元弱酸、弱碱的解离平衡原理,完全适用于多元弱酸、弱碱的解离平衡。这里以碳酸为例来讨论多元弱酸的解离平衡,其分步解离平衡为:
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















