4.2 离子晶格与晶格能
在离子晶体中,晶格的结点上交替地排列着阳离子和阴离子。例如,NaCl晶体晶格的结点上交替地排列着Na+和Cl-,如图4.2所示。图4.2(a)是NaCl晶体的晶胞,图4.2(b)为表示NaCl晶体结构常用的示意图。Na+和Cl-都可分别近似地看成电场为球形对称的点电荷。阳、阴离子通过静电作用力结合而形成了离子键。离子晶体中离子键的强度可用晶体的晶格能来衡量。
晶格能是在0K、1个标准压力下,将1mol离子晶体转化成相互无限远离的气态离子时所需的能量。从静电吸引理论可得出晶格能的理论计算公式。
根据库仑定律,两个相距为r的阳离子、阴离子之间的吸引能为
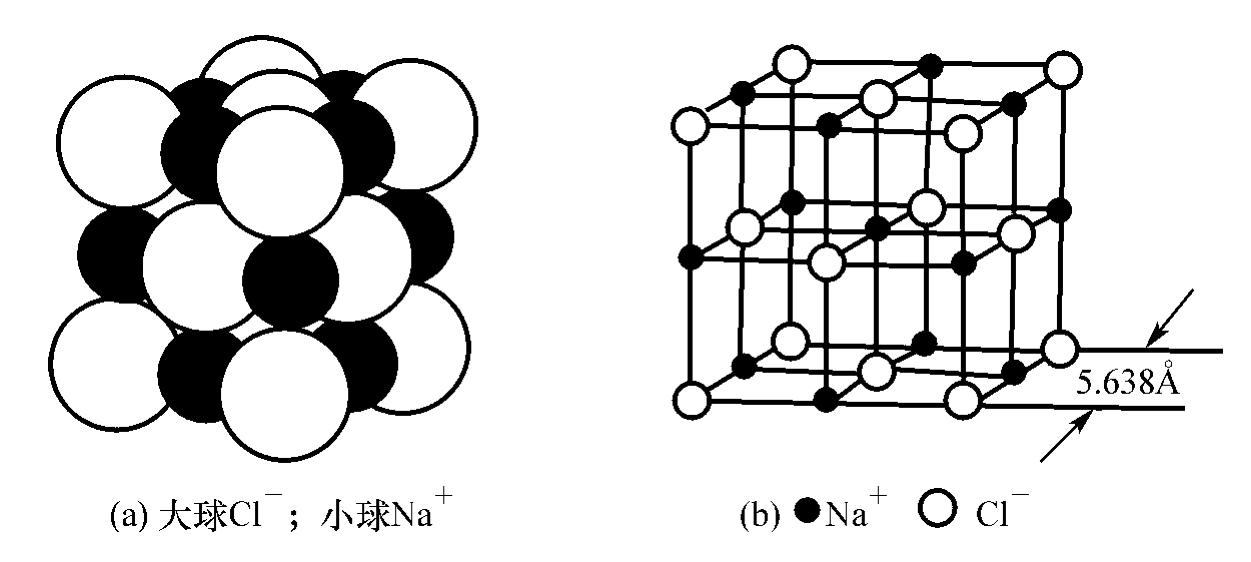
图4.2 NaCl晶体的结构
![]()
式中: Z1 e和Z2 e分别表示阳离子和阴离子所带的电荷。因此,吸引能量随着阳、阴离子间距离的减少而增大,其相应的变化情况如图4.3中下方虚线曲线所示。但是,当阳、阴离子逐渐接近时,它们的核外电子云之间的泡利不相容斥力也逐步明显,图4.3中上方的点画线表示出排斥能量随阳、阴离子间距离减小而迅速增加。排斥能可以用下式近似地表示
![]()
即排斥能与r的n次方成反比。式中B和n均为常数。n为玻恩指数,其数值大小与离子的电子层结构有关,列于表4.3中。
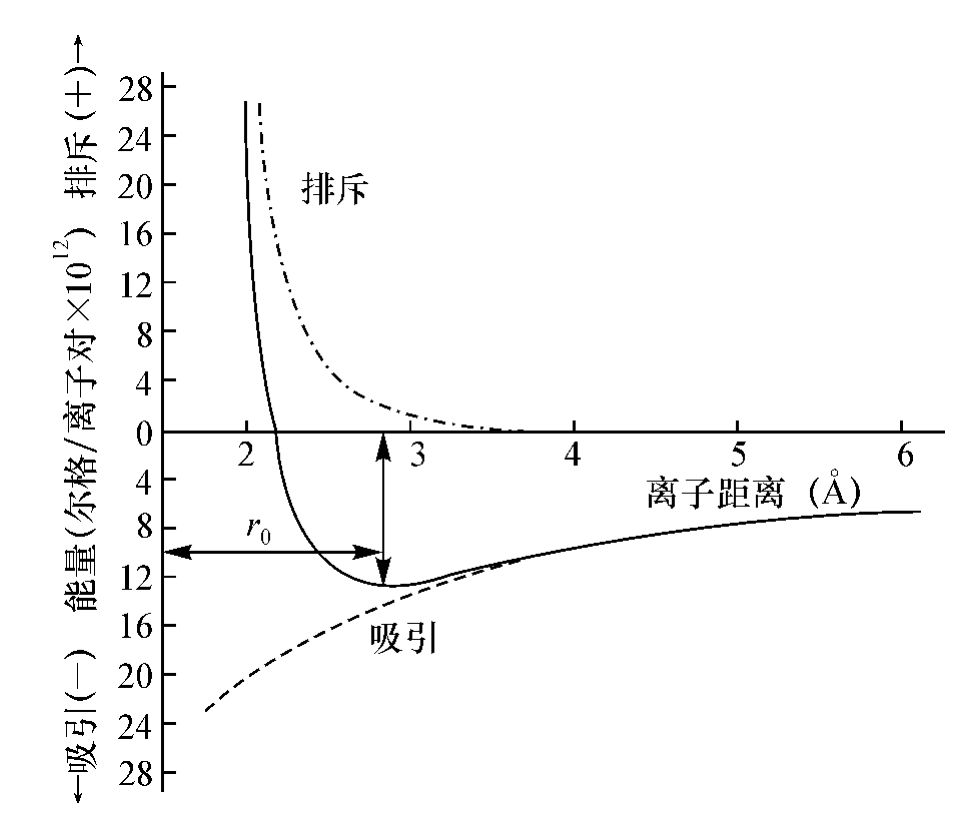
图4.3 NaCl中阳阴离子相互作用的能量和离子间距离的关系
表4.3 玻恩指数(n)数值大小
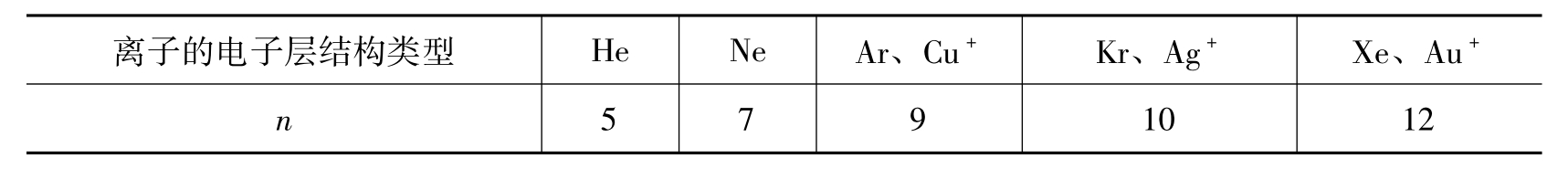
当阳、阴离子属于不同类型时,n则取其平均值,如NaCl的n为8。
综上所述,一对阳、阴离子间的势能为:
![]()
由于阳、阴离子间的吸引能量和排斥能量随离子间距而变化,在一定条件下,矛盾的双方能达到暂时的、相对的统一和平衡。
从图4.3中可以看到,阳、阴离子吸引和排斥的综合能量曲线(实线)上有一能量最低点,对应于此点的r,就是离子晶体中阳、阴离子间的平衡距离r0。NaCl的r0= 2.819。在此条件下,阳离子和阴离子之间的吸引力和排斥力达到了平衡,晶体相对地最稳定。此时
![]()
![]()
将B代入,即可得出一对正负离子在平衡距离r0时所具有的势能为
![]()
对于1克式量的一般二元型离子晶体的总势能则为
![]()
而晶格能为
![]()
式中: N0是阿伏伽德罗常数; A为马德伦常数,它与离子晶体的结构类型有关。一些常见二元型离子晶体的马德伦常数列于表4.4。
晶格能计算公式可用实验证实,现阶段国内外主要是根据热力学原理,利用反应热、汽化热等实测数据和赫斯(Hess)定律求出。例如下述MgO晶格能的求法:

![]()
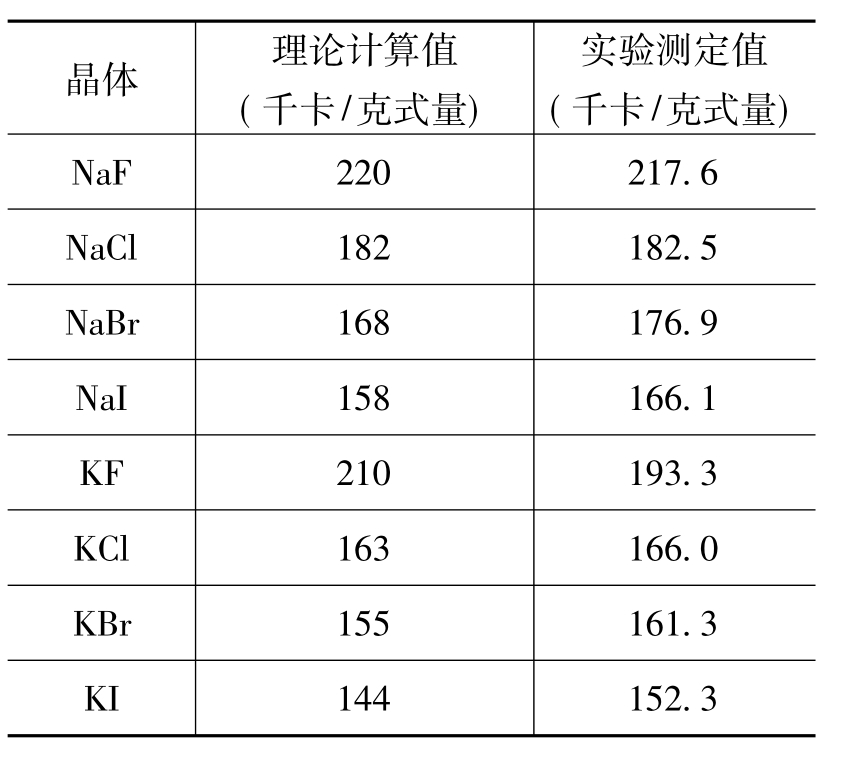
这个方法称为波恩-哈伯循环。表4.5是一些卤化物离子晶格能,是根据晶格能理论计算值和实验测定值的比较得来的。总的来说,理论和实际还是比较符合的。
表4.4 二元型离子晶体的马德伦常数
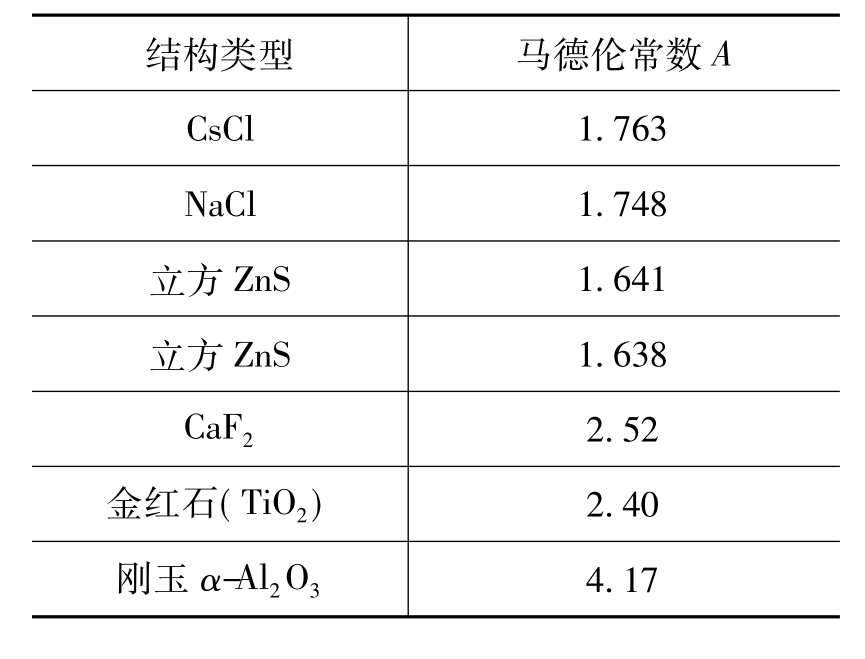
表4.5 理论计算和实验测定的晶格能比较
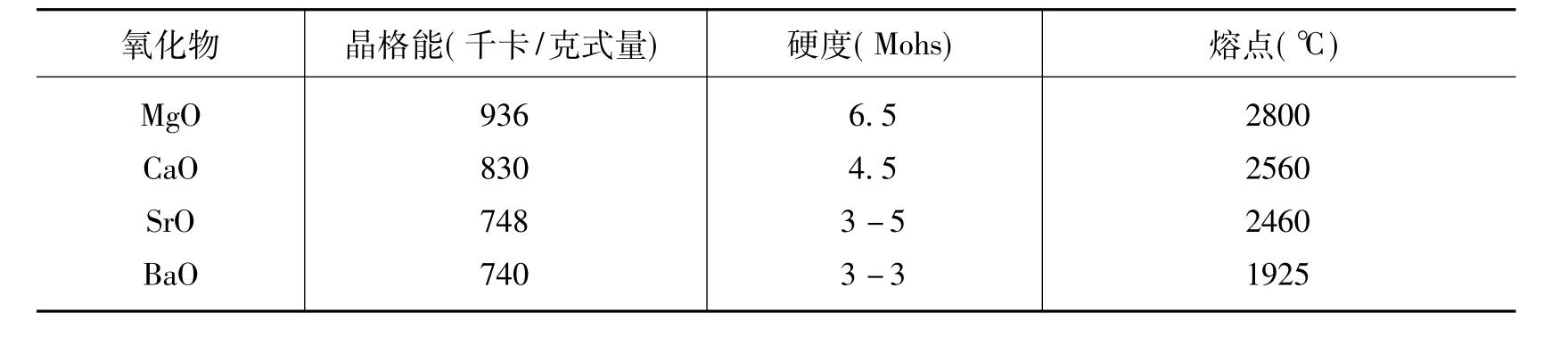
离子晶体的晶格能愈大,则其硬度和熔点愈大,表4.6中给出的数据可以说明上述关系。但是,只有在结构类型相同和没有变形的情况下,熔化温度才能随晶格能的增大而升高。
表4.6 离子晶格能与硬度和熔点的关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















