目前,内耳毛细胞再生方面的研究主要应用病毒载体在动物体内进行尝试,但因病毒载体的局限性,使毛细胞再生无法应用于临床。纳米微粒作为一种新型基因载体,以其无免疫原性,低毒、装载容量大、制备容易且结构稳定、利于改造和修饰等优势,更有利于毛细胞再生的进一步研究及临床应用。
目前,纳米微粒基因载体的内耳导入途径主要是鼓阶打孔和圆窗膜注射,通过直接注射和微渗透泵将其导入外淋巴液。这两种方式虽能证实有效,但都是侵袭性操作,破坏耳蜗鼓阶,存在诱发炎症、外淋巴漏、损坏听力的危险。由于圆窗膜具有半透膜的特性:分泌和吸收功能,而纳米微粒基因载体又具有靶向性和通透性,作为一种新技术,有望实现圆窗膜跨膜导入。
经病毒介导的转基因方法可使目的基因在内耳组织中得以表达,这可能在内耳组织的发育、存活、对耳毒性药物的拮抗、修复及再生等方面起重要作用。在耳科学研究中,目前主要用三种病毒作为载体,即腺病毒、腺病毒相关病毒和慢病毒。腺病毒载体的优点为可以制成高浓度及可以携带较大的基因;但是该病毒的缺点为宿主免疫反应过强,而且大部分人群都先感染过该病毒,体内已产生大量抗体。所以腺病毒作为载体治疗耳聋的前景是不太乐观的。美国密歇根州立大学的Raphael课题组曾把该病毒携带的Math1基因注入豚鼠内耳中阶中,发现有新生毛细胞产生。但是从上述病毒特点来说,该研究不可能用于临床。因为病毒注入中阶如引起宿主强烈的免疫反应,将导致大量感觉细胞及神经细胞死亡,不良反应很大;并且手术方法也是不可取的,临床上是不可能打开内耳中阶的。因此,耳科研究者应该把精力和财力放在更有发展前途的基因载体上。而纳米基因载体具备前面所描述的优势,因此具有广阔的发展前景。
甲壳素(chitin)是地球上含量仅次于纤维素的天然聚合物,壳聚糖(chitosan)作为甲壳素的部分脱乙酰化产物,是一种由β-(1,4)糖苷键连接的D-葡聚糖胺与含量不等的N-乙酰葡聚糖无序排列的线性聚糖,它是自然界来源第二大丰富的亲水性多糖,具有生物可降解性、生物相容性、生物黏附性和促渗透作用,且几乎无不良反应,其理化特性和生物学性质使它非常适合作为药物载体。实验证明,在盐溶液或醋酸溶液中壳聚糖易于与DNA结合形成纳米结构,并且有效防止DNA的降解,因此壳聚糖是一种较好的基因载体。但壳聚糖水溶性较差,转染率较低,通过对壳聚糖进行改良修饰,可以改善其基因转染效率。季铵化壳聚糖/羧甲基-β-环糊精钠(QCS/CM-β-CD)是壳聚糖的水溶性衍生物,其阳离子化程度高,与黏膜的黏附性更强,同时能更好地增强黏膜通透性。此外,由于它是水溶性的壳聚糖,可以增强药物的吸收率。如果能用壳聚糖衍生物即QCS/CM-β-CD纳米载体携带Math1基因进行内耳基因治疗,也许能够很好地促进毛细胞再生并且克服病毒载体的缺陷。
为寻找内耳基因治疗的理想载体系统,以及进一步评价其在内耳基因治疗中的应用潜力,将季铵化壳聚糖与环糊精的优点集于一身,解放军耳鼻咽喉研究所与国家纳米中心成功地发明和制备了一种高效低毒的季铵化壳聚糖/羧甲基-β-环糊精钠(QCS/CM-β-CD)纳米载体(图28-8),进行了壳聚糖衍生物纳米基因载体介导Math1基因转染HEK293细胞的研究,通过观察纳米载体介导内耳基因治疗中较关键的Math1基因对HEK293细胞的转染效率及细胞毒性,以便进一步将其用于动物在体及临床前期研究。

图28-8 壳聚糖衍生物纳米粒的制备过程( )季铵化壳聚糖,(
)季铵化壳聚糖,( )羟甲基-β-环糊精
)羟甲基-β-环糊精
季铵化壳聚糖/羟甲基-β-环糊精-pRK5-Math1-EGFP纳米粒呈球形,散在分布,大小较均匀,平均粒径为250nm(图28-9)。
使用共聚焦荧光显微镜检测显示季铵化壳聚糖/羟甲基-β-环糊精-pRK5-Math1-EGFP纳米转染复合物能成功介导Math1-EGFP基因转染HEK293细胞,并表达绿色荧光蛋白。在季铵化壳聚糖/羟甲基-β-环糊精质量比为4∶1,pRK5-Math1-EGFP质粒含量7μg,pH为7.0时,计算不同N/P比组平均细胞转染率分别为:N/P为1∶1(7.4%)、2∶1 (15.6%)、4∶1(47.2%)、8∶1(34.3%)(书末彩图28-10B/C)。空白对照组未观察到呈绿色荧光的细胞。LipofectamineTM2000-pRK5-Math1-EGFP转染复合物能成功介导Math1- EGFP基因转染HEK293细胞,并表达绿色荧光蛋白,平均转染效率为50.8%,如书末彩图28-10A,空白对照组未观察到呈绿色荧光的细胞。pRK5-Math1-EGFP质粒几乎不能介导Math1-EGFP基因的转染,平均转染效率仅为2.1%,如书末彩图28-10D。

图28-9 壳聚糖衍生物-pRK5-Math1-EGFP纳米粒透射电镜所见
[季铵化壳聚糖:羟甲基-β-环糊精为4∶1,季铵化壳聚糖(230kDa)]
RT-PCR反应能够进一步在RNA水平上验证经过不同载体携带目的基因是否真正转染HEK293细胞,图28-11为不同非病毒载体携带Math1-EGFP基因转染HEK293细胞后的RT-PCR的电泳结果,1~4分别表示经LipofectamineTM 2000-pRK5-Math1-EGFP转染复合物、单纯pRK5-Math1-EGFP质粒、季铵化壳聚糖/羟甲基-β-环糊精-pRK5-Math1-EGFP纳米转染复合物和未经转染的HEK293细胞的Math1基因的条带及相应的Actin条带。表明季铵化壳聚糖/羟甲基-β-环糊精-pRK5-Math1-EGFP纳米转染复合物能够成功转染HEK293细胞,并有Math1cDNA的表达。
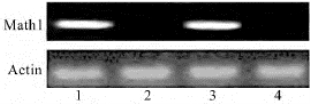
图28-11 RT-PCR反应检测不同载体介导Math1基因转染HEK293细胞后mRNA表达情况
1.LipofectamineTM2000组;2.裸质粒组;3.季铵化壳聚糖/羟甲基-β-环糊精纳米粒组(N/P为4∶1);4.空白对照组
3 -(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,商品名:噻唑蓝(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide,MTT)检测季铵化壳聚糖/羟甲基-β-环糊精-pRK5-Math1-EGFP纳米转染复合物、LipofectamineTM 2000-pRK5-Math1-EGFP转染复合物、pRK5-Math1-EGFP质粒转染HEK293细胞后的细胞活力,细胞毒性。在N/P为4∶1时,经季铵化壳聚糖/羟甲基-β-环糊精-pRK5-Math1-EGFP纳米转染复合物转染的HEK293细胞存活率为75.5%,明显高于商品化的LipofectamineTM 2000 (52.1%),而空白对照组为100%,裸质粒转染组为94.5%。
上述研究结果表明,壳聚糖衍生物纳米载体能成功携带pRK5-Math1-EGFP质粒转染HEK293细胞;RT-PCR法验证了壳聚糖衍生物-pRK5-Math1-EGFP纳米转染复合物能够成功转染HEK293细胞,并有Math1cDNA的表达;细胞转染试验优化了其最佳转染N/P比为4∶1,此时最高转染率为45.2%,与LipofectamineTM2000接近;细胞毒性试验表明季铵化壳聚糖/羟甲基-β-环糊精-pRK5-Math1-EGFP纳米复合物为75.5%,明显低于LipofectamineTM2000-pRK5-Math1-EGFP复合物。季铵化壳聚糖/羟甲基-β-环糊精-pRK5-Math1-EGFP纳米粒为一种安全且高效的非病毒基因载体,是耳蜗毛细胞再生基因治疗的进一步研究中的关键性步骤,并将最终应用于临床听力损失的治疗。
近10年来,内耳基因治疗的实验虽取得了一些成果,但仍然处于起始阶段,寻找安全、高效、免疫原性低、表达稳定、易于生产的新型载体是治疗内耳疾病的关键。尽管纳米粒基因载体是目前国内外研究热点,并且已经取得了令人欣喜的进展。然而,如何提高内耳基因治疗的转染效率、延长在体内的作用时间尚需进一步研究。不过可以肯定,作为纳米技术和基因治疗相结合的产物,纳米粒子是极具发展潜力的。随着纳米制剂不断的发展,纳米颗粒作为载体转染基因将会在内耳疾病基因治疗中发挥更重要的作用。
(任丽丽 杨仕明)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















