1.操作步骤 ①麻醉:最常用的麻醉剂为戊巴比妥钠,狗和猫一般用30mg/kg静脉或腹腔内麻醉,大鼠用45mg/kg腹腔内麻醉,兴奋型狗的麻醉剂量可增至35~40mg/kg,最好采用静脉滴注,以便于掌握剂量。在实验过程中,为维持一定的麻醉深度可加用一定的维持量。戊巴比妥钠麻醉维持时间为2~4h,若手术或实验时间短,可用硫喷妥钠。大鼠还常用乌拉坦1 000~1 500 mg/kg腹腔内麻醉,麻醉深而平稳,24h还不能完全恢复。②固定动物:将动物仰卧固定在手术台上,注意四肢束缚不可过紧,以免影响血液循环,用线绳通过门齿将颈部拉直以便手术操作。③手术视野剪毛。④气管插管:行颈部正中纵形皮肤切口,分离出一小段气管,表面行倒T字切口,插入大小合适的气管套管,用线固定。⑤动脉插管:一般选用颈动脉或股动脉进行插管。颈动脉插管时,沿胸锁乳突肌内缘将筋膜分开,即可见颈总动脉迷走神经混合干,将动脉和神经分开,分离甲状腺动脉以下的颈总动脉一段(2~4cm),下穿两根线,用一根线结扎血管远心端,用动脉夹夹住血管近心端,然后在血管上剪一小口,插入动脉导管,并用另一根线固定。股动脉插管时,在腹股沟处用手触及股动脉搏动,在其表面做股动脉走向的皮肤切口,分离皮下组织,暴露股动脉、股静脉,分离股动脉,按上述方法插入动脉导管。如需静脉给药或补液,可同时行颈外静脉或股静脉插管。若给药次数不多,也可采用舌静脉给药,即将舌拉出,用5号针头把药液直接注入舌静脉。⑥血压记录:将动脉导管与压力换能器相连(图7-3),信号经放大后记录于生理记录仪或计算机上。可记录收缩压、舒张压、平均动脉压等,也可记录血压波形。
2.注意事项与评价 ①手术要仔细、柔和,勿损伤小血管,出血时要迅速止血。分离大鼠股静脉时,更要细心柔和,否则静脉塌陷难以插管。狗的皮肤易出血,可用烧灼法止血。②呼吸对血压影响很大,人工呼吸时注意呼吸量和频率,狗和猫的呼吸频率为20~24/min,大鼠为70~80/min。注意呼吸道是否被分泌物堵塞,一旦发现要即时清除。③压力换能器应预先定标。动脉导管预先充满0.05%肝素生理盐水,以防血液凝固,如实验过程中发生导管内凝血或脉压差过小,可经三通管用少量0.05%肝素生理盐水冲洗。静脉导管内充满生理盐水即可。动脉导管和压力换能器之间整个系统的空气必须排尽,微小气泡的存在将影响血压波形的真实性。④麻醉深浅可影响实验结果,故应保持麻醉深度平稳。麻醉对心血管功能和药物反应有不同程度影响,这是本法的最大不足。⑤本法用于急性实验。
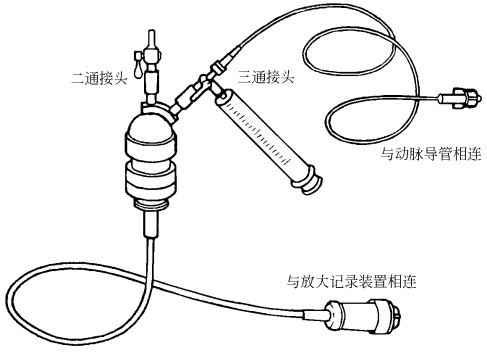
图7-3 麻醉动物压力换能器
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















