琼胶是从石花菜和其他红藻中提取出的干的、无定型、类似骨胶、不含氮的物质,在微生物培养基中常用作凝固剂。它是线性含硫酸基的半乳聚糖,不溶于冷水,溶于热水,其稀中性溶液(1%~2%)冷却后生成凝胶,35℃~50℃凝固,90℃~100℃融化。琼胶包括琼脂糖和琼脂胶两种组分,不同来源的琼胶物理性质有很大的差异,但他们具有共同的化学结构,皆以β-1,4-和α-1,3-连接的D-半乳糖基和3,6-内醚 -L-半乳糖及其衍生物为主要重复二糖单位。琼胶寡糖的结构如图4-9所示。
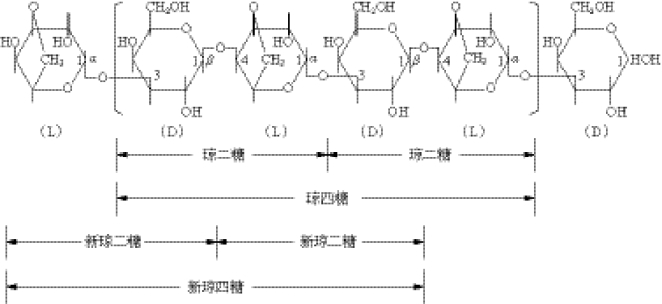
图4-9 琼胶的化学结构及其寡糖的组成方式
琼胶寡糖具有很多生理活性,如诱导细胞凋亡、免疫调节活性、抗敏活性和抗炎活性。琼胶寡糖可作为功能性食品和药品的原料或添加剂,近年来在日用化工领域又发现琼胶寡糖的一些新用途,日本利用琼胶寡糖作为添加剂生产的化妆品对皮肤具有很好的保湿效果,对头发有很好的调理效果。TaKaRa Agaoligo TM即为酸解琼胶所得到的琼胶寡糖混合物的商品,它是由琼二糖、琼四糖、琼六糖和琼八糖组成的,具有抗氧化的作用,能够预防与氧化有关的一些疾病,如慢性肾功能障碍、溃疡性结肠炎、关节炎和风湿性关节炎、白内障、青光眼,甚至是由于基因损伤引起的肿瘤。
分解琼胶的细菌主要存在于海洋环境中。在潮汐带,已经证明每克淤泥中含有的琼胶降解菌可达107个,占淤泥中所有好气细菌的2%~4%。自从1902年Gran第一次从海水中分离得到琼胶的分解细菌Pseudomonas galatica以来,人们已经分离到多种琼胶分解菌,包括噬纤维菌属(Cytophage)、弧菌属(Vibrio)、 链霉菌属(Streptomyces)、别单胞菌属(Alteromonas)、交替假单胞菌属(Pseudoalteromonas)、假单胞菌属(Pseudomonas)和交替球菌属(Alterococcus),这些微生物大多来源于海洋。此外也有少量微生物来源于河流、温泉、土壤和污水。这些降解菌可分为两类:一类菌软化琼胶,在菌落周围出现凹陷;另一类菌则剧烈地液化琼胶。降解琼胶的酶还可以从一些软体动物中分离得到,海兔属的Aplysia dactylomela、鲍属的Haliotis coccinea、滨螺属的Littorina striata、冠海詹属的Diadema antillarum中均可分离出琼胶酶。
降解琼胶的琼胶酶根据其作用方式可分为两类:
(1)α-琼胶酶。
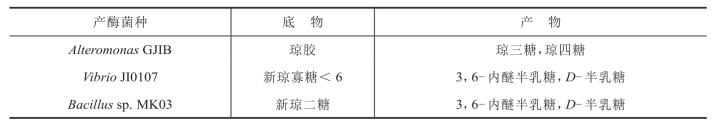
琼胶的α-1,3糖苷键被裂解,生成以β-D-半乳糖为非还原性末端和以3,6-内醚 -α-L-半乳糖为还原性末端的琼寡糖(agarooligosaccharides)系列(表4-8)。
表4-8 几种α-琼胶酶的酶解方式
(2)β-琼胶酶。
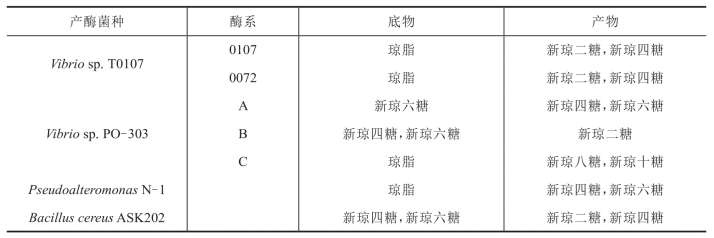
琼胶的β-1,4糖苷键被裂解,生成以β-D-半乳糖为还原性末端和以3,6-内醚 -α-L-半乳糖为非还原性末端的新琼寡糖(neoagarooligosaccharides)系列(表4-9)。
表4-9 几种β-琼胶酶的酶解方式

续表
Young等从一种革兰氏阴性海洋细菌中分离出琼胶酶,经硫酸铵沉淀、DEAE纤维素柱层析等进行提纯,通过纸层析法证明酶解产物含有琼四糖和琼六糖,即琼胶的β(1→3)键被裂解,而生成以β -D-半乳糖为非还原性末端基和以3,6-内醚 -α-L-半乳糖为还原性末端的寡糖,因而,该水解酶为α-琼胶酶,这是α-琼胶酶首次得到提纯。Yaphe从海洋细菌大西洋假单胞菌(P.atlantica)中分离出β-琼胶酶,随后又从同种细菌细胞壁的靠细胞质区域分离出新琼二糖水解酶和β -新琼四糖水解酶,他们认为琼胶的酶解,是细菌的胞外酶β-琼胶酶首先将琼胶从β -糖苷键处裂解,生成聚合度为4和3的寡糖;新琼六糖继而被水解成聚合度为2的寡糖,再通过β -新琼四糖水解酶、新琼二糖水解酶的作用分解成3,6-内醚 -L-半乳糖和D-半乳糖单糖。β -琼胶酶是细菌的胞外酶,而新琼四糖水解酶和新琼二糖水解酶则存在于细菌细胞壁区域的原生细胞膜上或其外边,为胞内酶。此外,迄今已有多种琼胶酶的基因得到了克隆和测序。Belas(1989)第一次提出了源于Streptomyces coelicolor和Alteromonas atlantica产生的β-琼胶酶存在着氨基酸序列相同的区域,并对源于Pseudomonas atlantica琼胶酶的基因agrA进行了序列分析。Sugano (1993)对来源于Vibrio的一种独特的基因agaA进行了克隆和定序。Sugano (1994)又对同种菌的一种新的β-琼胶酶的基因agaB进行了序列分析。Ha (1997)对源于Pseudomonas sp.w7的β-琼胶酶进行了表达和克隆,并在大肠杆菌上进行了重组。Kang(2003)克隆了源于Pseudomonas sp.SK38的β-琼胶酶基因pagA,并将其在大肠杆菌中进行了表达;此结构基因长为1011bp,包含了337个氨基酸和一个18个氨基酸的信号肽;推导出的氨基酸序列与源于Pseudoalteromonas atalntica和Alteromonas sp. 的β-琼胶酶分别有57%和58%的同源性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















