◇董一名
北京理工大学 生命学院,北京 100081
摘 要:湿地是地球上生产力最高的生态系统之一。湿地微生物在湿地中具有提高湿地的初级生产力、净化环境污染等不可替代的重要生态功能。全面了解湿地微生物的多样性及其分布特征,能够为探明湿地中微生物的多样性以及它与湿地生态系统的关系,为解释湿地较高的生产力水平提供理论依据。本文采用传统分离培养方法对我国湿地微生物群落结构及其影响因素进行了相关研究,通过对云南多个典型湿地的土壤样品进行研究和分析,证实了地理位置、气候条件、土壤理化性质等环境因素对湿地微生物群落组成具有一定影响。
关键词:湿地;云南;微生物;群落;密度
1.引言
湿地是位于陆生和水生生态系统之间的过渡性地带。它广泛分布于世界各地,是生物多样性的摇篮。它拥有强大的生态净化作用,是地球上一种独特的、多功能的生态系统,在生态平衡中扮演着极其重要的角色,有着“地球之肾”的美名。湿地中附着生长的微生物种类繁多,好氧、厌氧、兼氧型均可在其中很好地存活,并且栽种不同植物的湿地中的微生物数量并不相同。各种微生物在湿地滤料的承载层中以不同的方式存在于填料或植物根系。不同微环境中的微生物对有机物的降解方式也不相同,其中包括:同化作用、异化作用、氨化作用、硝化和反硝化作用。微生物是对污染物进行吸附和降解的主要生物群体和承担者,微生物在湿地基质中对其他动物和植物共生体的相互关系往往起着核心作用。
2.研究方法
2.1 采样地介绍
2.1.1 滇池湿地
滇池是滇文化的发祥地,可以说整个云南文化基本都是围绕滇池而延展的。滇池湿地的恢复与建设是滇池治理与保护的重要环节,是滇池湖滨“四退三还”生态建设项目。随着滇池水环境污染得到有效遏制,湿地公园作为环滇池重要的景观带,吸引着更多的游客观光旅游,也成为市民休闲娱乐的好去处。
昆明滇池国际城市湿地公园位于滇池北岸西亮塘片区,紧临宝象河,公园用地规模为2 360.11亩,其中湿地公园水质净化区占地300亩,湿地公园游赏区占地95 011亩,湿地公园生态保育区占地1 110亩。该区域属湖滨生态带的建设区域,是湖泊生态系统的重要组成部分,官渡区委、区政府提出把昆明滇池国际城市湿地公园建设成为国家级公园的目标,按照“保护和发展相结合”的原则,以“最佳景观、最佳生态”为宗旨,最大限度地发挥湿地的生态服务功能和社会经济价值。
2.1.2 洱海湿地
洱海是白族的摇篮和发祥地,也是云南古代文明的发源地之一。白语叫洱海为“杲(gao)”,汉语直译就是“海”。汉语对洱海的称谓,最早见于《汉书·地理志》,称之为“叶榆泽”。以后不同朝代,不同时期的古籍史书载称昆弥川、西洱河、西二河、洱河、叶榆水、弥海、西洱海等。今名洱海始自明朝中叶。
洱海,从地质上论,是一个比较典型的内陆断陷盆地,是喜马拉雅山构造运动的产物。洱海盆地在构造上处于印度板块与欧亚板块结合带的北东段。洱海断陷盆地的形成、发展是地质板块剧烈运动的产物。新生代喜马拉雅山构造运动强烈活动,洱海北西—南东断裂带两侧引起褶皱突起,形成高山或山丘台地,其西高东低,沿断裂带断陷聚水形成山间湖泊。其从孕育、发展至今历经了六千万年的沧桑。
洱海位于大理州中部,纵贯大理、洱源两市县境内(2004年1月后洱源县江尾、双廊两镇被划归大理市,洱海已全部在大理市境内)。当水位为1 966米时(85高程,下同)时,湖面积为252.191平方千米,湖容量为27.94亿立方米,湖周长为129.14千米,岛屿面积为0.748平方千米,兴利库容为7.37亿立方米。
2.1.3 和顺湿地
和顺湿地俗称陷河。陷河,其实就是具有生物多样性特征的湿地,因人行其中极易泥足深陷,当地人就给它取了这个形象的名字。和顺湿地方圆数百亩,位于古镇的核心区域,与和顺小巷的古建筑群毗邻,古镇湿地水乳交融。
根据《国际湿地公约》的定义,湿地是衡量一个地方自然生态环境是否优良的绝对标准。正因为如此,作为全国古镇中唯一真正意义上的湿地古镇,和顺自然环境的优良不言而喻。
20世纪60年代,这里的人们曾有过“填湿还田”的荒唐举动,这块湿地险遭毁灭的厄运。如今人们已经有了保护的意识和行动。湿地开始变得植被丰茂、水体澄澈、水禽翻飞,重现出勃勃生机,恢复了它在和顺游子心中曾经的美丽容颜。
2.1.4 北海湿地
腾冲北海湿地位于云南省保山市腾冲县打苴乡,于1994年被国家环保局首批列入《中国湿地保护名录》,距城12.5千米。腾冲北海湿地四面环山,属亚热带火山熔岩堰塞湖,为全国33处重点保护湿地之一,也是云南省唯一的国家湿地保护区。保护区的面积为16.29平万千米,北海面积为0.46平方千米,其中水面面积为0.14平方千米,海排面积为0.32平方千米。
北海湿地属天然的常年性漂浮状苔草沼泽地,水面覆盖着巨大的草排,即浮状苔草,草排最厚可达2米,全国罕见。北海湿地特殊的环境孕育了多种珍贵鸟禽和奇异花草,它还是多种候鸟的生息之地。
在北海湿地,但见明净的水面波光粼粼,大片的草地一直蔓延到山脚下。这大片的草地其实是漂浮在水面上的,由各种水草的根须经过千万年的生死纠结而成。
腾冲北海湿地具有极高的生态旅游观光价值与科考价值。腾冲北海湿地保护区现由县旅游局、环保局、打苴乡政府合资成立北海湿地生态旅游发展有限公司,对保护区进行生态旅游保护性开发,现已初步完成北海湿地保护区一期工程,建成了相应的旅游服务配套设施,景区的硬件设施已基本完成,水、电、路实现三通(景区旅游专线12.5千米为国家三级柏油路面)。
2.2 采样过程
2.2.1 开阔河流的采样
在对开阔河流进行采样时,应包括下列几个基本点:
(1)用水地点的采样;
(2)污水流入河流后,应在充分混合的地点以及流入前的地点采样;
(3)支流合流后,对充分混合的地点及混合前的主流与支流的地点采样;
(4)主流分流后地点的选择。
(5)根据其他需要设定的采样地点。
各采样点原则上应在河流横向及垂向的不同位置采集样品。采样时间一般选择在采样前至少连续两天晴天,水质较稳定的时间(特殊需要除外)。采样时间是在考虑人类活动、工厂企业的工作时间及污染物到达时间的基础上确定的。另外,在潮汐区,应考虑潮的情况,确定把水质最坏的时刻包括在采样时间内。
2.2.2 封闭管道的采样
在封闭管道中采样,也会遇到与在开阔河流中采样所出现的类似问题。采样器探头或采样管应被妥善地放在进水的下游,采样管不能靠近管壁。在湍流部位,例如在“T”形管、弯头、阀门的后部,可充分混合,其一般被作为最佳采样点,但是对于等动力采样(等速采样)除外。
采集自来水或抽水设备中的水样时,应先放水数分钟,使积留在水管中的杂质及陈旧水排出,然后再取样。在采集水样前,应先用水样洗涤采样器容器、盛样瓶及塞子2~3次(油类除外)。
2.2.3 水库和湖泊的采样
对于水库和湖泊的采样,采样地点的不同和温度的分层现象可引起水质的很大差异。在调查水质状况时,应考虑到成层期与循环期的水质明显不同。了解循环期水质,可采集表层水样;了解成层期水质,应按深度分层采样。
在调查水域的污染状况时,需进行综合分析判断,抓住基本点,以取得代表性水样,如废水流入前、流入后充分混合的地点,用水地点,流出地点等,有些可参照开阔河流的采样情况,但不能等同而论。
在可以直接汲水的场合,可用适当的容器采样,如水桶。从桥上等地方采样时,可将系着绳子的聚乙烯桶或带有坠子的采样瓶投于水中汲水。要注意不能混入漂浮于水面上的物质。
在采集一定深度的水样时,可用直立式或有机玻璃采水器。在这类装置下沉的过程中,水就从采样器中流过。当到达预定深度时,容器能够闭合而汲取水样。在水流动缓慢的情况下,采用上述方法时,最好在采样器下系上重量适宜的坠子,当水深流急时要系上相应重量的铅鱼,并配备绞车。
采样过程中应注意:
(1)采样时不可搅动水底部的沉积物。
(2)采样时应保证采样点的位置准确。必要时使用GPS定位。
(3)认真填写采样记录表,字迹应端正清晰。
(4)保证采样按时、准确、安全。
(5)采样结束前,应核对采样方案、记录和水样,如有错误和遗漏,应立即补采或重新采样。
(6)如采样现场的水体很不均匀,无法采到有代表性样品,则应详细记录不均匀的情况和实际采样情况,供使用数据者参考。
(7)测定油类的水样,应在水面至水面下300毫米处采集柱状水样,并单独采样,全部用于测定。采样瓶不能用采集的水样冲洗。
(8)测溶解氧、生化需氧量和有机污染物等项目时的水样,必须注满容器,不留空间,并用水封口。
(9)如果水样中含沉降性固体,如泥沙等,应将之分离除去。分离方法为:将所采水样摇匀后倒入筒型玻璃容器,静置30分钟,将已不含沉降性固体但含有悬浮性固体的水样移入乘样容器并加入保存剂。测定总悬浮物和油类的水样除外。
(10)测定湖库水的COD、高锰酸盐指数、叶绿素a、总氮、总磷时的水样,静置30分钟后,用吸管一次或几次移取水样,吸管进水尖嘴应插至水样表层50毫米以下位置,再加保存剂保存。
(11)测定油类、BOD5、溶解氧、硫化物、余氯、粪大肠菌群、悬浮物、放射性等项目要单独采样。
2.2.4 土壤采样
采样点可采表层样或土壤剖面。一般监测采集表层土,采样深度为0~20厘米,对于有特殊要求的监测(土壤背景、环评、污染事故等),必要时选择部分采样点采集剖面样品。剖面的规格一般为长1.5米,宽0.8米,深1.2米。挖掘土壤剖面时要使观察面向阳,表土和底土分两侧放置。
一般每个剖面采集A、B、C三层土样。地下水位较高时,剖面挖至地下水出露时为止;山地丘陵土层较薄时,剖面挖至风化层。对B层发育不完整(不发育)的山地土壤,只采A、C两层;对干旱地区剖面发育不完善的土壤,在表层5~20厘米、心土层50厘米、底土层100厘米左右采样。
水稻土按照A耕作层、P犁底层、C母质层(或G潜育层、W潴育层)分层采样(图26),对P层太薄的剖面,只采A、C两层(或A、G层或A、W层)。
对A层特别深厚,沉积层不甚发育,1米内见不到母质的土类剖面,按A层5~20厘米、A/B层60~90厘米、B层100~200厘米采集土样。对于草甸土和潮土一般在A层5~20厘米、C1层(或B层)50厘米、C2层100~120厘米处采样。
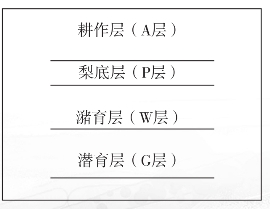
图26
采样次序自下而上,先采剖面的底层样品,再采中层样品,最后采上层样品。测量重金属的样品时尽量用竹片或竹刀去除与金属采样器接触的部分土壤,再用其取样。剖面每层样品采集1千克左右,装入样品袋,样品袋一般由棉布缝制而成,潮湿样品可内衬塑料袋(供无机化合物测定)或将样品置于玻璃瓶内(供有机化合物测定)。
1.农业土壤混合样
一般农田土壤环境监测采集耕作层土样,种植一般农作物采0~20厘米,种植果林类农作物采0~60厘米。为了保证样品具有代表性,可减低监测费用,采取采集混合样的方案。每个土壤单元设3~7个采样区,单个采样区可以是自然分割的一个田块,也可以由多个田块所构成,其范围以200米×200米左右为宜。每个采样区的样品为农田土壤混合样。混合样的采集主要有四种方法:
(1)对角线法:适用于污灌农田土壤,对角线分5等份,以等分点为采样分点。
(2)梅花点法:适用于面积较小,地势平坦,土壤组成和受污染程度相对比较均匀的地块,设5个左右分点(图27)。
(3)棋盘式法:适宜面积中等、地势平坦、土壤不够均匀的地块,设10个左右分点,对于受污泥、垃圾等固体废物污染的土壤,分点应在20个以上;
(4)蛇形法:适宜于面积较大、土壤不够均匀且地势不平坦的地块,设15个左右分点,多用于农业污染型土壤(图27)。各分点混匀后用四分法取1千克土样装入样品袋,将多余部分弃去。

图27
2.城市土壤采样
城市土壤是城市生态的重要组成部分,虽然城市土壤不用于农业生产,但其环境质量对城市生态系统的影响极大。城区内大部分土壤被道路和建筑物覆盖,只有小部分土壤栽植草木,本文中的城市土壤主要是指后者。由于复杂性其分两层采样,上层(0~30厘米)可能是回填土或受人为影响大的部分,另一层(30~60厘米)为人为影响相对较小的部分。对两层分别取样监测。
城市土壤监测点以网距2 000米的网格布点为主,以功能区布点为辅,每个网格设一个采样点。对用于专项研究和调查的采样点可适当加密。
3.采样要求
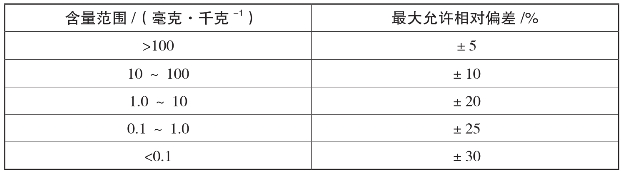
对每种样本进行平行测样,利用平行样本的误差性修正试验参数,土壤监测平行双样的最大允许相对偏差见表7。
表7
3.结果与讨论
3.1 微生物类群
部分测试结果(菌落总数测试片)如图28、图29所示。
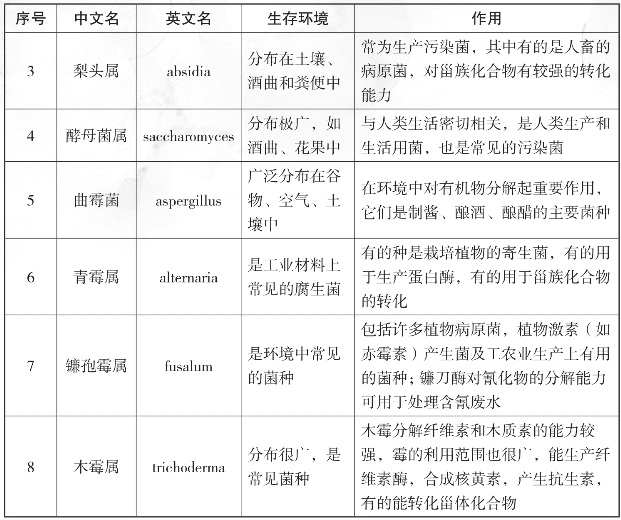
湿地中的微生物极其丰富,不同的类群具有不同的功能,受到各种因素的影响,微生物的数量和种类在人工湿地的不同区域分布不相同,表8列出了湿地系统中部分微生物的种类、生存环境和作用。有植物系统的微生物数量显著高于无植物系统。植物根区与非根区的微生物种类和数量存在较大差异,湿地基质表面和植物根区的功能性微生物种类和数量相对较多。植物根区是微生物最活跃的区域,根、根茎及根须提供了结构不同的表,并形成了根分泌物和气体(N2、O2、CO2)浓度梯度,刺激了好氧和厌氧的矿化过程,因此组成了多样化的微生物群落。在湿地系统中,氨化细菌、硝化和反硝化细菌数量明显比对照系统高。由于草茎和根的输氧作用,硝化菌的数量增多,硝化强度增大,而在远离植物根部的区域形成缺氧、厌氧环境,这导致较多的反硝化菌数量和较强的反硝化强度。微生物数量和种类在人工湿地的垂直分布上也呈现一定的规律,即随着基质层的加深逐渐减少。研究结果表明,好氧和厌氧微生物的空间分布存在差别,垂直流湿地0~10厘米的基质层中好氧微生物的数量高出30~55厘米的层面1~2个数量级,而兼性厌氧菌如反硝化细菌几乎存在于基质各层中,在干土中达到107个/克以上。
表8
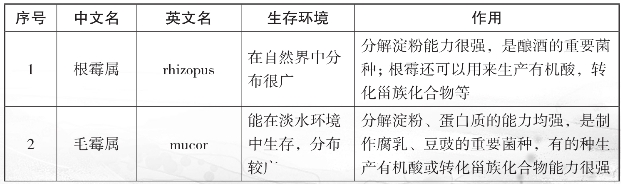
图28

图29
续表
3.2 影响微生物生态分布的因素
3.2.1 营养物质
营养物质和能量是生物新陈代谢的基础,微生物的营养要素包括无机营养物质和有机营养物质,而人工湿地中微生物的营养来源完全取决于废水的组成。一般情况下,矿物元素不至于缺乏,但有些废水碳源相对缺乏,而有时在脱氮过程中碳源又显得不足,有机碳浓度低会降低反硝化速率。国外科学家对人工湿地微生物还原硫酸盐的研究表明,向废水中加入蔗糖和NH4Cl后,微生物能去除矿排水中90%以上的硫酸盐,并生成硫化物,但在对照试验中(没有加蔗糖或NH4Cl)硫酸盐没有被还原。溶解性氮浓度决定了硫酸盐还原的速率和程度,是反应的限速因子。固氮菌是硫酸盐还原系统微生物群落的重要组成部分之一。对人工湿地中微生物胞外酶的研究表明,其产量和活性受碳源数量和质量的调控,一些酶被诱导,而另一些酶被抑制。国外科学家(Shackle等)研究发现,加入不同浓度的纤维素和葡萄糖对磷酸酶活性的影响不明显,对硫酸酯酶的活性有抑制作用,而使葡萄糖苷酶的活性逐渐增加。
3.2.2 温度
温度变化不仅影响湿地系统中微生物的代谢速率,而且还影响其他重要的环境因子,如营养循环和初级生产等,这些因子往往会影响微生物群落的结构和功能。硝化/反硝化作用受温度的影响随季节的改变而变化,当温度小于5℃或大于40℃时,硝化菌的活性降低;在夏季几乎能达到完全反硝化,当季节温度小于15℃时,反硝化作用明显受到限制。大量研究显示,湿地系统中微生物的种类和数量随季节的改变而变化,一般情况下,其在夏秋季数量最多,在冬季最少。国外科学家(Chong等)对处理乙二醇类的人工湿地中的微生物研究表明,湿地中好氧性细菌、真菌和放线菌的数量要显著高于厌氧性细菌的数量;好氧性微生物的数量在春、夏季最多,在冬季最少。
3.2.3 溶解氧
由于湿地系统中溶解氧的状况不同,其可分别为好氧、微好氧、兼性厌氧和厌氧微生物提供相应的生境。人工湿地系统中通常为厌氧环境,溶解氧浓度随水力波动会有些变化。在根区附近存在好氧环境,但根区提供的氧还不足以创造高氧化条件。在潜流式系统中,好氧过程主要发生在近根部和根表面,厌氧过程如反硝化、硫酸盐还原和产甲烷主要发生在缺氧区。在垂直流系统中,由于供氧充分,氮主要以硝态氮为主,而在潜流式系统中氧化态氮会被立即还原,从而阻碍亚硝酸盐和硝酸盐的积累。当水中DO小于1毫克/升时硝化作用减小,DO大于0.2毫克/升时反硝化作用受到抑制。而且,好氧条件可以提高微生物对磷的吸收能力。
3.2.4 氧化还原电位
湿地系统中介质的氧化还原性质是影响碳氮磷生物地质循环的重要因素。通常用氧化还原电位(ORP)来表征土壤等介质的氧化还原性质。国外科学家(Kadlect和Knight)把人工湿地根据断面分为3个区,即表层的弱还原区、中层的中等还原区和底层的强还原区。国外科学家(Koottatep等)的研究显示,在表面流系统中,水层溶解氧浓度为1.5~2.5毫克/升,被认为是弱还原区。介质层溶解氧浓度逐渐降低,0~20厘米和20~50厘米的介质层分别为中等还原区和强还原区。由于相对较高的溶解氧浓度和氧化还原电位,湿地水层微生物的氨化、硝化-反硝化作用显著,是氮去除最活跃的区域;介质层由于溶解氧和氧化还原电位较低,氮的去除效率相对较低。国外科学家(Wiebner等)对人工湿地长期运行的研究结果显示,随着氧化还原电位的升高,氨氮浓度降低。由于存在不同的氧化还原电位,人工湿地是一个能够产生多种代谢途径的生态系统,对于难降解的有机污染物,如高氯代有机化合物,微生物能够通过还原脱卤作用,将其降解为低氯代化合物,在好氧条件下低氯代产物可以被进一步生物降解。
3.2.5 pH
湿地环境的pH也影响着微生物的代谢。以氮循环为例,当pH值在6.5~8.5时其有利于好氧和厌氧微生物对含氮有机物的氨化作用的发生;pH值大于8.0时,氨氮主要以氨的形式挥发去除;pH值小于6.0时硝化细菌的活性显著下降;pH值小于5.0时硝化作用基本可以被忽略。反硝化产生的气体是湿地处理所关注的一个问题。反硝化产生的N2O和NO是温室气体,通常在酸性条件下产生,当pH值小于6.0时产生的N2O明显增多,占到气体产物的50%。国外科学家(Verhoeven等)建议,湿地系统的pH值应保持在6.0以上,这样反硝化产生的气体就以N2为主而不是以N2O或NO为主。
3.2.6 水生植物对微生物的影响
水生植物对微生物的影响主要表现在以下几个方面:①水生植物组织为光合作用的藻类、细菌和原生动物群落的形成提供了附着物。②在根区形成有氧区域,为好氧微生物群落提供了适宜的生长环境,而根区以外则适于兼氧、厌氧微生物群落的生存;进行反硝化和有机物的厌氧降解,使不同的微生物各得其所,发挥相辅相成的作用。③根系分泌物为附着微生物提供碳源和营养物质。植物可将输入到根部的大部分碳水化合物释放到根际,形成根际沉积。根际沉积物,包括分泌物、黏胶质和细胞脱落物等,对于植物的碳素平衡、根际微生物的生长代谢至关重要。植物还会向根区释放其他化学物质。在早期的研究中,德国的科学家(Seidel博士)证明,灯芯草可从根部释放抗生素,当污水经过灯芯草植被后,一系列细菌如大肠杆菌、沙门氏菌属和肠球菌明显消失。然而,目前的研究结果还很难解释根系分泌物对微生物同时存在的促进(为微生物提供基质)以及抑制(杀菌)作用,因此还需要对其他机理以及原生动物的作用做进一步的研究。④植物种类影响微生物的数量和种类。研究表明,种植不同植物的湿地系统根区的微生物数量不同,其湿地净化效果也不同。
4.结论与建议
微生物在人工湿地的污水处理过程中发挥着巨大的作用。湿地中的微生物主要分布在上层,并且随着植物根系向下扩展,植物的根际效应使根际周围的微生物数量、多样性及活性均高于基质微生物,因此虽然有研究认为植物吸收在湿地污水处理中的作用不显著,但作为微生物的附着面,它仍是人工湿地中不可缺少的重要组分之一。人工湿地中微生物分布受植物的影响,因此可以根据植物根系的长度来设计人工湿地的深度,确定污水处理的最佳空间位于湿地上层。
污水中的有机物、氮、磷等是微生物的食物与能量的主要来源,因此培养水体中污染物的含量对生物膜的发育程度有重要影响。对于人工湿地,特别在建成初期,在一定范围内,提高进水中的污染负荷可促进湿地基质微生物的良好发育,从而促进湿地本身的成熟,提高系统处理效力。
设计湿地时,在经济允许的范围内,应该考虑运用多基质的人工湿地。另外,温度也是影响微生物分布的重要因素,所以应该更加关注湿地在夏秋季的运行管理,尽量提高污水的处理效率。总之,随着影响人工湿地微生物空间分布、多样性及活性研究的进一步深入,这些研究结果将进一步完善湿地的设计,提高净化效率,从而使其在污水处理系统中的应用更加广泛。
参考文献
[1]Guodong Ji,Tieheng Sun,Qixing Zhou etal.Constructed subsurface flow wetland for treatingheavy oil produced water of the Liaohe oil field in China[J]. Ecological Engineering,2002,18(4):489-495.
[2]籍国东,倪晋仁.人工湿地废水生态处理系统的作用机制[J].环境污染治理技术与设备,2004,5(6):71-75.
[3]CominFA,RomeroJA.Nitrogen removal and cycling in restored wetlands used as filters of nutrients for agricultural runoff[J].WatSciTech,1997,35(5):255-261.
[4]梁威,吴振斌,周巧红,等.复合垂直流构建湿地基质微生物类群及酶活性空间分布[J].云南环境科学,2002,3(21);5-8.
[5]Shutes.The design of wetland systems for the treatment of urban runoff[J]. WatSciTech,1997,35(5):19-25.
[6]GschllT,SteinmannC.Constructed wetlands for effluent polishing of lagoons[J].WatRes,1998,33(2):505-511.
[7]SchonbornA.Long term performance of the sand-plant-filter Schattweid(Switzerland)[J].WatSciTech,1997,35(5):307-314.
[8]VrhovsekD,KukanjaV.The use of constructed wetland for landfill eachate treatment[J].WatSciTech,1997,35(5):301-306.
[9]周凤霞,陈健宏.淡水微型生物图谱[M].北京:科学出版社,1999.
[10]OttováV,BalcarováJ,Vymazal J.Microbial characteristics of constructed wetlands[J].Wat.Sci.Tceh.,1997,35(5):117-123.
[11]Machate T,Noll H,Behrens H,etal.Degradation of phenanthrene and hydraulic characteristics in a constructed wetland[J].Wat.Res.,1997,31(3):554-560.
[12]中国科学院南京基质研究所微生物室.基质微生物研究方法[M].北京:科学出版社,1985.
[13]Abbas AI-Omarl,Manar Fayyad.Treatment of domestic wastewater by subsurface flow constructed wetlands in Jordan[J].Desalination,2003,155:27-39.
[14]蒋玲燕,殷峻,闻岳,等.修复受污染水体的潜流人工湿地微生物多样性研究[J].环境污染与防治,2006,28(10):734-737.
[15]Mars R.The role of the submergent macrophyte triglochin Huegdii in domestic greywater treatment[J].Ecological Engineering,1999,12:57-66.
[16]靖元孝,杨丹菁.风车草(Cyperus alternifolius)人工湿地系统氮去除及氮转化细菌研究[J].生态科学,2004,23(1):89-91.
[17]吴振斌,周巧红,贺锋,等.构建湿地中试系统基质剖面微生物活性的研究[J].中国环境科学,2003,23(4):422-426.
[18]丁浩,凌云,徐亚同,等.梦清园芦苇湿地根际微生物特征研究[J].四川环境,2007,26(2):6-10.
[19]赵先丽,周广胜,周莉,等.盘锦芦苇湿地土壤微生物初步研究[J].气象与环境学报,2007,23(1):30-33.
[20]Donnelly AP,Herbert RA.Bacterial interactions in the rhizophere of seagrass communities in shallow coastal lagoons[J].J.Appl.Microbiol.Symp.Suppl.,1999,85:151-160.
[21]梁威,吴振斌,詹发萃,等.人工湿地植物根区微生物与净化效果的季节变化[J].湖泊科学,2004,16(4):312-317.
[22]李科德,胡正嘉.芦苇床系统净化污水的机理[J].中国环境科学,1995,15(2):140-144.
[23]郭如美,刘汉湖,周立刚,等.潜流式人工湿地微生物群落结构及脱氮效果的研究[J].江苏环境科技,2006,19(5):14-16.
[24]Zhu T,Sikora F J.Ammonium and nitrate removal in vegetated and unvegetated gravel bed microcosm wetlands[J].Wat.Sci.Teeh,1995,32(3):219-228.
[25]Lloyd JR,Klessa DA,Parry DL,et al.Stimulation of microbialsulphate reduction in a constructed wetland:microbiological and geochemical analysis[J]. Wat.Res.,2004,38(7):1822-1830.
[26]Shackle VJ,Freeman C.Carbon supply and the regulation ofenzymatic activity in constructed wetlands[J].Soil Biol.Biochem.,2000,32:1935-1940.
[27]Chong S,Garelick H,Revitt DM,et al.The microbiology associated with glycol removal in constructed wetlands[J].Wat.Sci.Tech.,1999,40(3):99-107.
[28]梁威,胡洪营.人工湿地净化污水过程中的生物作用[J].中国给水排水,2003,19(10):28-31.
[29]Koottatep T,Polprasert C.Role of plant uptake on nitrogen removalin constructed wetlands located in the tropics[J].Wat.Sci.Tech.,1997,36(12):1-8.
[30]Wiebner A,Kappelmeyer U,Kuschk P,et al.Influence of the redox condition dynamics on the removal efficiency of a laboratory-scale constructedwetland[J].Wat.Res.,2005,39(1):248-256.
[31]张鸿,吴振斌.两种人工湿地中氮磷净化率与细菌分布关系的初步研究[J].华中师范大学学报,1999,33(4):575-578.
[32]Verhoeven JTA,Meuleman AFM.Wetlands foe wastewater treatment:opportunities and limitations[J].Eco.Eng.,1999,12(1-2):5-12.
[33]吴振斌,梁威,成水平.湿地植物根区土壤酶活性与污水净化效果及其相关分析[J].环境科学学报,2001,21(5):622-624.
[34]H Brix,C A Arias,M del Bubba.Media selection for sustainable phosphorous removal insubsurface flow constructed wetlands[J].Wat Sci Tech,2001,44(11-12):47-54.
[35]朱丽霞,张家恩,等.根系分泌物与根际微生物相互作用研究综述[J].生态环境,2003,12(1):102-105.
[36]Seidel C C,Sukias J P S,Upsdell M P.Relationships between loading rates and pollution removal during maturation of gravel-bed constructedwetlands[J]. Joumal of Environmental Quality,1998,27:448-458.
[37]刘存歧,王伟伟,李贺鹏,陆健健.湿地生态系统中土壤酶的研究进展[J].河北大学学报,2005,25(4):443-447.
[38]Ibekwe AM,Grieve CM,Lyon SR.Characterization of microbial communities and composition in constructed dairy wetland wastewater effluent[J]. Appl.Environ.Microbiol.,2003,69(9):5060-5069.
[39]Roberts GS,Lewis G.In situ analysis of Nitrosomonas spp.inwastewater treatment wetland biofilms[J].Wat.Res.,2001,35(11):2731-2739.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















