◇唐 博
北京理工大学 生命学院,北京 100081
摘 要:本文拟通过对宁夏不同类型湿地土壤中的养分物质(如氮、磷等)、土壤酶活性(如磷酸酶等)、微生物种类以及数量等土壤标志性物质的分析,来研究不同类型的湿地的净化能力的高低,并以此找出未来人工湿地建设的方向。通过实验分析,可知土壤酶活性与土壤养分呈显著性正相关,土壤酶活性与土壤微生物数量也呈现一定的正相关性,并且根据湿地对污染物的处理结果,最终可以得出湿地净化能力为:河流湿地>城市湿地>沙漠湿地。
关键词:净化作用;土壤酶活性;土壤微生物;宁夏湿地
前 言
我国是一个水资源缺乏的国家,同时水质污染和水资源浪费现象也十分严重。据统计,我国年排废水量400亿吨以上,大部分未经任何处理直接被排入江、河、湖泊,使水质受到严重污染,甚至完全丧失利用的价值,加重了水资源的短缺。因此,合理开发利用和有效保护水资源及污水净化再利用,具有现实意义和长远意义。
人工湿地是20世纪70年代才蓬勃兴起的一种处理污水的方式。湿地基质中的土壤酶同生活着的微生物一起推动着物质转化。在土壤酶中,磷酸酶和脲酶在物质转化过程中起着非常重要的作用。磷酸酶能酶促有机磷化物的水解;脲酶是线性酰胺的C-N键(非肽)的水解酶。它们在人工湿地净化污水过程中起着极其重要的作用。虽然关于人工湿地净化污水的机制研究已经有不少报道,但其主要集中于湿地植物的气体代谢、微生物学、植物生理生态、水力动力学等方面。对人工湿地土壤酶学方面的研究在国内外尚不多见。但现有研究已经发现,在人工湿地净化污水的过程中,湿地酶起到了极其重要的作用。如国外科研人员(Boschker)研究了荷兰Gooimeer湖滨岸区沉积物中土壤酶活性的水平分布,该区域从芦苇外滩到芦苇带沉积物中存在一个有机物含量的梯度。研究发现在芦苇床内外土壤酶的分布存在明显的差异。成水平等于1995年11月到1996年3月对香蒲系统人工湿地及其对照系统的磷酸酶、纤维素酶和蛋白酶的活性进行了调查,结果发现香蒲型人工湿地中的磷酸酶、纤维素酶、蛋白酶的活性在数值上的差异不显著。吴振斌等研究了复合垂直流构建湿地的土壤酶活性,发现不同月份、不同深度的湿地的土壤酶活性不相同,不同湿地类型的土壤酶活性也不相同;脲酶的活性与湿地系统凯氏氮的去除率之间存在显著的相关性。国外科研人员(Shackle等)研究发现通过对人工湿地系统中碳源数量和质量的调控,可以调节湿地土壤酶的活性,从而达到最佳的污水净化效果。
宁夏地处西北内陆干旱地区,水资源极度匮乏,属于重度缺水区。随着宁夏经济的持续快速的发展,水资源的供需矛盾日渐突出。更令人担忧的是,原本就很有限的水资源遭到日益严重的污染。工业废水、生活污水有大约一半未经任何处理就被直接排放进河水与湖水中,这造成了严重的污染。宁夏的湿地众多,通过改造湿地类型,改变土壤酶、微生物种类,可以帮助湿地增加自我净化能力,以抵御日益严重的污染的威胁。
国内外对湿地壤酶与微生物的报道很多,但是对于湿地土壤酶与微生物的净化能力的文章不多,对不同类型湿地土壤酶与微生物的净化能力的比较研究更是凤毛麟角。本研究拟通过对宁夏不同类型湿地土壤中磷酸酶、脲酶和过氧化氢酶活性的测定和对微生物数量的测定与对污水中氮、磷去除率相关性的分析,研究将土壤酶活性和微生物数量作为评价净化效果和指导未来建设人工湿地种类的标准的可能性。
1.绪论
1.1 湿地的分类以及湿地对生态环境的作用
根据《湿地公约》的定义,湿地系指天然或人工、长久或暂时性沼泽地、湿原、泥炭地或水域地带,带有或静止或流动,或为淡水、半咸水、咸水水体者,包括低潮时水深不超过6米的海域。
湿地是人类最重要的环境资本之一,也是自然界富有生物多样性和较高生产力的生态系统,湿地的水陆过渡性使环境要素在湿地中的耦合和交汇作用复杂化,它对自然环境的反馈作用是多方面的。湿地的生态功能主要体现在物质循环、生物多样性维护、调节河川径流和气候等方面。
(1)保护生物和遗传多样性。湿地蕴藏着丰富的动植物资源,湿地植被具有种类多,生物多样性丰富的特点,许多自然湿地为水生动物、水生植物、多种珍稀濒危野生动物,特别是水禽提供了必需的栖息、迁徙、越冬和繁殖场所,在保存物种和保护物种多样性方面发挥着重要作用,对维持野生物种种群的存续、筛选和改良具有商品价值的物种,均具有重要意义。如果没有保存完好的自然湿地,许多野生动物将无法完成其生命周期,湿地生物多样性将失去栖身之地。同时,自然湿地为许多物种保存了基因特性,使得许多野生生物能在不受干扰的情况下生存和繁衍。因此,湿地当之无愧地被称为生物超市和物种基因库。
(2)调蓄径流洪水,补充地下水。湿地在控制洪水,调节河川径流、补给地下水和维持区域水平衡等方面的功能十分显著,是其他生态系统所不能替代的,湿地是陆地上的天然蓄水库,湿地还可以为地下蓄水层补充水源。
(3)调节区域气候和固定二氧化碳。由于在湿地环境中微生物的活动弱,土壤吸收和释放二氧化碳十分缓慢,故形成了富含有机质的湿地土壤和泥炭层,它起到了固定碳的作用。湿地的水分蒸发和植被叶面的水分蒸腾,使得湿地和大气之间不断进行能量和物质交换,对周边地区的气候调节具有明显的作用。
(4)降解污染和净化水质。许多自然湿地生长的湿地植物、微生物通过物理过滤、生物吸收和化学合成与分解等把人类排入湖泊、河流等有毒有害物质降解和转化为无毒无害甚至有益的物质,湿地在降解污染和净化水质上的强大功能使其被誉为“地球之肾”。
(5)防浪固岸。湿地中生长着多种多样的植物,这些湿地植被可以抵御海浪、台风和风暴的冲击,防止海岸被侵蚀,同时它们的根系可以固定、稳定堤岸和海岸,保护沿海的工农业生产。
1.2 湿地对生态环境的净化作用
随着城市化进程的加快,城市中的人口、产业等不断增加,城市向周边地区的扩展速度加快,但是仍旧不能满足城市生态系统的需求,环境污染、热岛效应、水资源缺乏等问题严重影响城市居民的生存,威胁到人类自身的健康发展。研究表明湿地通过对生态系统中的基质、水生植物、微生物的吸附、过滤、沉淀、降解、氧化还原等物理化学作用以及生物转化污染物作用来实现对污染的处理,达到净化水质、消除污染、恢复生态结构的效果。湿地中的有机物的去除主要是依靠水生植物的根茎与微生物的作用,富营养水中的氮、磷等的去除主要是依靠微生物产生的酶的降解作用。资料显示,湿地COD去除率为66.7%~94.6%,BOD5去除率为58.6%~97.0%,SS去除率为20.0%~60.0%,氨氮去除率为50.0%~77.8%,总磷去除率为37.5%~88.9%,湿地能显著改善水体质量。
湿地净化废水的机理十分复杂,人们迄今还未完全弄清楚。污水中的不溶性有机物通过湿地的沉淀、过滤可以很快从废水中被截留下来,被微小生物加以利用。可溶性有机物则可通过生物膜的吸附及微生物的代谢过程被去除。湿地于自然生态系统中主要通过物理、化学及生化反应这三重作用来净化污水。物理作用,即当污水进入湿地时,经过基质层及密集的植物茎叶和根系,使污水中的悬浮物固体得到过滤,截留住污水中的悬浮物,并使之沉积在基质中。这一过程也被称为物理沉积。所谓化学反应,是指由于植物、土壤、无机胶体复合体、土壤微生物区系及酶的多样性,人工湿地污水中的污染物可以通过各种化学反应如化学沉淀、吸附、离子交换、氧化还原等过程被去除。这些化学反应主要取决于所选择的基质类型,例如,含CaCO3较多的石灰石有助于磷的去除;含有机物丰富的土壤有助于吸附各种污染物。在生化反应方面,生长在湿地中的挺水植物具有对氧的运输、释放、扩散作用,能将空气中的氧气转运到根部,再经过植物根部扩散,于是在植物根须周围的微环境中就会有大量好氧微生物将有机物分解,从而提高了对生物难降解有机物的去除效果。另一方面,在根须较少达到的地方将形成兼氧区和厌氧区,这有利于硝化、反硝化反应和微生物对磷的过量积累作用,从而达到除磷、氮的效果。
1.3 土壤酶与微生物对生态环境的净化作用
土壤酶是土壤中生物化学反应的催化剂,它能加速基质中有机质的化学反应,从而促进湿地净化功能的发挥。土壤酶同微生物一起推动着物质转化,各种酶在基质中的积累是基质微生物、基质动物和植物根系生命活动的结果。它们参与了许多重要的生物化学过程,如腐殖质的合成和分解,有机化合物、高等植物和微生物残体的水解等。在土壤酶中,磷酸酶、脲酶和蛋白酶在物质转化过程中起着非常重要的作用。磷酸酶能酶促有机磷化物的水解;蛋白酶能酶解蛋白质和肽类等大分子氮化物;脲酶是一种酰胺酶,能酶促有机质分子中肽键的水解。
磷酸酶的活性与污水总磷、COD、BOD5的去除率正相关;脲酶与总氮的去除率正相关;蛋白酶与总磷、COD、BOD5总氮的去除率没有相关性。土壤中脲酶的活性与基质的微生物数量、有机物质含量、总氮和速效氮含量正相关;过氧化氢酶几乎存在于所有生物体内,在某些细菌里的数量约为细胞干重的1%,它能促进过氧化氢对各种化合物的氧化。湿地的过氧化氢酶的活性与湿地呼吸强度和湿地微生物活动有关。
湿地中的微生物主要包括细菌、真菌和放线菌等。其中,细菌是湿地微生物中数量最多的一个类群,1克基质中所含的细菌数可达几亿乃至几十亿,占基质微生物总数量的70%~90%,其干重约占基质有机质的1%。细菌里又常包括好氧菌、厌氧菌、兼性厌氧菌、硝化细菌、反硝化细菌、硫细菌和磷细菌等种类。
细菌在污水净化过程中起着巨大作用,它能使复杂的含氮有机物转化成可供植物和微生物利用的无机氮化合物。真菌是参与基质中有机质分解过程的主要成员之一,具有强大的酶系统,能促进纤维素、木质素、果胶等的分解,并能将蛋白质最终分解而释放出氨。放线菌在基质中的分布也很广泛(1克基质中有几万到几十万),仅次于细菌。放线菌是分解基质中有机化合物的积极参与者,能比真菌更强烈地分解氨基酸等蛋白物质,还能形成抗生物质维持湿地生物群落的动态平衡。原生动物摄食一些微生物和碎屑,这起到了调节微生物群落的动态平衡和清洁水体的作用。它们共同协作,构成了互利共生的有机系统,共同完成污水净化的任务。
研究发现湿地中的微生物与其净化功能之间存在显著关系,微生物的数量越多则污染物的去除率越高,其中污水中BOD5的去除率与湿地细菌总数显著相关,氨氮的去除率与硝化细菌和反硝化细菌的数量密切相关,污水中总大肠杆菌的去除率与湿地原生动物和放线菌的数量也存在显著相关性。这也从一个方面说明湿地微生物在污染物降解中起到了重要作用。
土壤微生物能够分泌酶,所以土壤微生物与酶的活性之间具有明显的联系。土壤酶的活性在土壤剖面中的分布与微生物的分布相一致,土壤微生物的数量增加,尤其是能够分泌相应酶的微生物总数增加时,许多土壤酶的活性便增强。据报道,脲酶、蛋白酶、蔗糖酶、磷酸酶等的活性与土壤微生物数量的分布相关。
2.材料与方法
2.1 研究区域概况
中国约有湿地6 300万公顷,占世界湿地面积的11.9%,居世界第四位,亚洲第一位。宁夏湿地资源主要集中在黄河流域和其支流清水河、葫芦河流域。黄河是流经宁夏最主要的河流,由于两千多年的开发和利用,其在宁夏平原形成了丰富的湿地资源。
本次科考考察了三种不同的湿地,腾格里湿地——沙漠湿地,黄沙古渡湿地——河流湿地,鸣翠湖湿地——城市湿地。三种不同的湿地对应着三种不同的小气候,也生长着不同类型的植物,因此指示出不同湿地的土壤酶的活性、微生物种类有所不同。
腾格里沙漠湿地位于中卫市区西北部,腾格里沙漠的南部边缘,东南距中卫市区8千米,西南缘与国家首批5A级旅游区沙坡头相连,西北缘与沙漠草原通湖,与水稍子相接,东边紧靠五葡路,南边是一马平川的沃野,距母亲河——黄河仅5千米之遥。“腾格里”是蒙语“天一样大”的意思,形容这片沙漠大得与天相连。腾格里沙漠除了沙峰连绵起伏、峰高谷深外,还以湖盆众多而著名。其湖盆大多集中在这一带,尤以腾格里湖为最。由于倚沙靠水的特殊地理构造,这里形成了沙漠、湿地、湖泊、鱼塘、戈壁等交织并存的奇特景观,也孕育了动物和植物的多样性。在湿地内,有灌木丛、草甸、草原、草原沙生植物、荒漠和沼泽植被六种植被形态,其中沼泽植被群种有芦苇、菖蒲、苔草等多种,群落覆盖度达60%~90%。动物中鸟类的种类最为丰富,共有136种,其中黑鹳、大天鹅、金雕分别属于国家级保护动物,苍鹭、大白鹭、北朱雀等38种属于中日候鸟保护协定保护品种。这地地下水源充足,植物众多,鱼类相当丰富,共有几十种,其中以鲤鱼、草鱼、鲫鱼、鲢鱼、鲶鱼为多。因此,腾格里湿地形成了一种特殊的湿地类型——沙漠湿地。
黄沙古渡湿地位于银川市兴庆区月牙湖乡,依黄河东岸,距市区约30千米。湿地汇集了黄河、大漠、湿地、湖泊、田园为一体的自然景观,面积为3 586.7公顷。其中核心区面积为866.7公顷,缓冲区面积为1 453.3公顷,试验区面积为1 266.7公顷。月牙湖湿地由湖泊、浅滩、灌丛、草甸、沙丘构成,主要包括月牙湖及周边的河滩湿地,黄河在此流速变缓,形成了1.3万亩滩涂湿地,生长着茂密的芦苇等自然植物,栖息着40余种野生鸟类。滩涂内有一形似月牙的湖泊,俗称月牙湖,也是当地月牙湖乡名称的由来。这里生长着茂密的天然芦苇、蒲草。人们在此修建了鸟类观测台。这里栖息着河鸥、大雁、山鸭、山燕、沙燕、灰鹤、白鹤、沙鸡等40余种珍禽候鸟。沙丘种植了花棒、沙蒿、杨柴等种子3 000多亩,栽种花棒、沙柳、新疆杨、沙枣树、刺槐等树苗500余万棵,成为被保护得最好的一片沙漠植物群。
鸣翠湖湿地距银川市区9千米,距黄河3千米,是一个典型的城市湿地。其为古黄河河道东移,鄂尔多斯台地抬升自然形成的黄河冲积平原湖滩地貌。这里集黄土高原、黄河、湖泊、芦苇、湿地等景观于一身。鸣翠湖湿地分南北两湖,生态体系完整,湖区及周边河流、湖泊、沼泽、灌渠、水稻田连片,水量充足、土壤肥沃。鸣翠湖的水资源属黄河水系,湖泊面积占湖区面积的80%,灌排水系发达,西有汉朝开挖的汉延渠,东有清代开挖的惠农渠,水源稳定性好,水量充沛,基本上不受年降水变化率的影响。湿地的生态环境可人工控制,湖底平坦,由于其水系未受工业污染,人为破坏影响因素较少,湖水四季透明,水质良好,基本完整地保持了自然生态环境。鸣翠湖作为一个典型的湿地生态系统,由沼泽、湖水、芦苇有机地形成一个适于鸟类繁衍、栖息和生存发展的生态支持系统。湖东侧大片的芦苇引来大量水禽栖息,并在此“生儿育女”,湖周边的沼泽中广布芦苇、蒲草和香蒲等,这里有丰富的小鱼小虾,成为鸟儿觅食的黄金地带。
2.2 样品采集
2.2.1 取样地点
(1)腾格里湿地:第一处(T1)位于游客比较稀少的一个码头旁边,在此处取了三个平行样本(此处用于模拟水质较好的样本,即受湿地净化后的水体);第二处(T2)位于游客较为集中的一个湖边广场,在此处采取了三个平行样本(此处用于模拟受污染的水体,即湿地污染源)。
(2)黄沙古渡湿地:第一处(H1)位于湿地污水口出口附近,在此采集了三个平行样本;第二处(H2)位于下游鸟岛附近(此处芦苇等水生植物较为丰富,土壤微生物、酶较多,用于模拟净化过程),在此采集了两个平行样本;第三处(H3)位于湿地最下游,在此采集了三个平行样本(模拟湿地净化后)。
(3)鸣翠湖湿地:第一处(M1)位于游客比较集中的码头附近,在此采集了两个平行样本(模拟湿地污染源);第二处(M2)位于湖中心一个小岛,在此采集了两个平行样本(模拟湿地净化后)。
2.2.2 取样方法与处理方法
在每处取样点随机选取距离水位边界线水面以下的土壤,用多点混合采样法采集20厘米深度的土壤样品,每处取样1 000克左右,装入无菌袋中。将采回的土样在实验室去除植物根系和石块,将每种样品充分混匀后分为2份。其中一份自然风干,过1毫米筛,用于测定土壤酶活性;另一部通过2毫米筛后,放入4℃冰箱保存,供微生物和含水量测定分析。
2.3 样品分析方法
2.3.1 土壤养分以及其他基本成分分析方法
(1)总氮含量:在室温下,样品消煮前先用高锰酸钾溶液将样品中的亚硝态氮氧化为硝态氮后,再用还原铁粉使全部的硝态氮还原转化为铵态氮,最后使用温控消化器,在加速剂硒粉-硫酸铜-硫酸钾的参与下,用浓硫酸消煮,各种含氮有机化合物经高温分解,全部转化为铵态氮。消煮液用凯氏定氮仪进行自动蒸馏及滴定,计算土壤的全氮含量。
(2)总磷含量:取两组7支50毫升具塞刻度比色管,分别向两组比色管中依次加入0.00毫升、0.50毫升、1.00毫升、3.00毫升、5.00毫升、10.00毫升、15.00毫升磷酸盐标准使用溶液。加水稀释至25毫升标线。向两组比色管中加4.00毫升过硫酸钾溶液,将比色管的盖塞紧,用纱布和绳子将玻璃塞扎紧,置于大烧杯中。将大烧杯放入120℃的电热恒温干燥箱内进行消解,30分钟后取出,冷却至室温,加水稀释至50毫升标线。分别向两组试样中加1.00毫升抗坏血酸溶液,混匀,30秒后再分别加入2.00毫升钼酸盐溶液,混匀。室温下放置15分钟后,在700纳米波长下,使用光程为30毫米的比色皿,以水作参比,测定吸光度,并绘制标准曲线。移取已混匀的土样(可根据总磷的大小取土样),并加水至5毫升,加入具塞刻度比色管中,摇匀,同时用纯水代替土样做试样空白。按标准曲线绘制步骤操作,将测得的吸光度做空白校正后代入标准曲线回归方程,得到磷含量(毫克)。
2.3.2 土壤酶活性分析方法
1.脲酶活性的测定
采用苯酚-次氯酸钠比色:精确称取0.471克硫酸铵溶于水并稀释至1 000毫升,则按1毫升含0.1毫克氮的标准画曲线时,可再将此液稀释10倍供用。吸取稀释的标准液1毫升、3毫升、5毫升、7毫升、9毫升、11毫升、13毫升,移于50毫升容量瓶中,然后加蒸馏水至20毫升。再加4毫升苯酚钠溶液和3毫升次氯酸钠溶液,随加随摇匀。20分钟后显色,定容。1小时内在分光光度计上于波长578纳米比色。以光密度值为横坐标,以氨的浓度为纵坐标绘制标准曲线。取5克风干土于50毫升三角瓶中,加1毫升甲苯,15分钟后加10毫升10%尿素液和20毫升,pH6.7柠檬酸盐缓冲液。摇匀后在37℃恒温箱中培养24小时。过滤后取3毫升滤液注入50毫升容量瓶中,然后按绘制标准曲线的显色方法进行比色测定。脲酶活性以24小时后1克土壤中NH3-N的毫克数表示。
2.过氧化氢酶活性的测定
采用高锰酸钾滴定法:过氧化氢酶促过氧化氢的分解,有利于防止它对生物体产生毒害作用。利用滴定法测定酶的活性的原理是,酶促反应的底物是过氧化氢,以KMnO4反滴定剩余的过氧化氢来表示酶的活性。测定方法是:称取2克风干土于100毫升的三角瓶中加入40毫升蒸馏水,再加入5毫升过氧化氢溶液,在复式振荡机上振荡20分钟。完毕之后加入5毫升3N的H2SO4,用慢速滤纸过滤,取25毫升滤液用0.1N的KMnO4滴定成粉红色。土壤过氧化氢酶以所消耗的KMnO4的毫克数来表示。
3.磷酸酶活性的测定
采用磷酸苯二钠比色法:取5克风干土样置于200毫升三角瓶中,加入2.5毫升甲苯,轻摇15分钟后,加入20毫升0.5%的磷酸苯二钠(碱性磷酸酶用硼酸盐缓冲液),仔细摇匀后放入37℃恒温箱中培养24小时。培养结束后,充分摇荡,将悬液用致密滤纸过滤于三角瓶中,吸取3毫升滤液于50毫升容量瓶中,加入5毫升硼酸缓冲液和4滴氯代二溴对苯醌亚胺显试剂,充分摇荡,放置30分钟,用水稀释至刻度,摇匀,溶液呈现蓝色,在分光光度计上于660纳米处进行比色测定。同时设置无土对照和无基质对照。土壤中磷酸酶活性以24小时后1克土壤中释出的酚的毫克数表示。
4.蔗糖酶活性的测定
采用3,5-二硝基水杨酸比色法:取2克风干土样置于50毫升三角瓶中,注入2.5毫升甲苯,15毫升8%的蔗糖溶液和5 m毫升pH值为5.5的磷酸缓冲液,摇匀混合物后,放入恒温箱,仔细摇匀后放入37℃恒温箱中培养24小时。培养结束后,充分摇荡,将悬液用致密滤纸过滤于三角瓶中,吸取滤液1毫升注入50毫升容量瓶中,加入3毫升3,5-二硝基水杨酸,并在沸腾的水浴锅中加热5分钟随即将容量瓶移至冰水混合物中冷却3分钟。溶液因生成3-氨基-5-硝基水杨酸而呈橙黄色,最后用蒸馏水稀释至50毫升,并在分光光度计上与波长508纳米处进行比色。土壤中蔗糖酶的活性以24小时后1克土壤中葡萄糖的毫克数表示。
2.3.3 微生物种类、数量分析方法
1.培养基的制备
(1)真菌-马丁氏(Martin)培养基:在1 000毫升的烧杯中加入300毫升蒸馏水,然后按下列顺序加入葡萄糖(10.0克)—蛋白胨(10.0克)—KH2PO4(10.0克)—MgSO4·7H2O(0.5克),不停搅拌,加热至沸腾,后取优质琼脂18.0克加入,不停搅拌至琼脂完全溶解。加孟加拉红(1/300水溶解),再补蒸馏水至1 000毫升,趁热分装于三角瓶中,每瓶150毫升左右,并将三角瓶口用封口膜扎紧,再在0.1兆帕(121℃)高压灭菌锅下灭菌20分钟,使用时待培养基融化并冷却至50℃左右,每150毫升加1%链霉素0.45毫升备用。
(2)细菌—牛肉膏蛋白胨琼脂培养基:在1 000毫升的烧杯中加入300毫升蒸馏水,然后按下列顺序加入牛肉膏(3.0克)—蛋白胨(10.0克)—NaCl(5.0克),不停搅拌,加热至沸腾,后取优质琼脂18.0克加入,不停搅拌至琼脂完全溶解,再补蒸馏水至1 000毫升,用NaOH调节pH值为7.0~7.2,趁热分装到三角瓶中,每瓶150毫升左右,并用封口膜将三角瓶口扎紧,再在0.1兆帕(121℃)高压灭菌锅下灭20分钟,备用。
(3)放线菌-高氏1号培养基:在1 000毫升的烧杯中加入300毫升蒸馏水,然后按下列顺序加入KH2PO4(0.5克)—MgSO4·7H2O(0.5克)—KNO4(1.0克)—NaCl(0.5克),边加边摇匀,再称取可溶性淀粉20.0克加入并摇匀,待清亮透明后称18.0克琼脂加入,不停搅拌至琼脂完全溶解,再补蒸馏水至1 000毫升,用NaOH调节pH值为7.2~7.4,趁热分装到三角瓶中,每瓶150毫升左右,并用封口膜将三角瓶口扎紧,再在0.1兆帕(121℃)高灭菌锅下灭菌20分钟,备用。
2.土壤稀释液的制备
称取新鲜土样10.0克,加入盛有90毫升无菌水的三角瓶中,置振荡器上振荡15分钟,即得10的-1次方浓度的土壤悬液,静置30秒后,用1毫升无菌吸管吸取10的-1次方的土壤悬液1毫升放入9毫升无菌水管中吹吸多次混匀,即得10的-2次方土壤稀释液,依次稀释至10的-7次方,即得一系列土壤稀释液(注意:稀释可用同一支吸管,或可按稀释度换新吸管,整个过程要严格按无菌操作进行,应将用过的吸管浸入盛有消毒酒精的高玻璃筒中,以免污染环境)。
3.接种与培养
取灭菌培养皿若干副,用记号笔在皿盖上标明样品号、培养基代号、接种稀释度,分离日期等,用1毫升无菌吸管由高浓度向低浓度顺序吸取稀释液,向编号相同的皿中接种,将吸管以30度角放入稀释液,迅速倒入已融化保温50℃左右的培养基,旋转培养皿使之混匀(注意:要将培养真菌、细菌、放线菌的土壤稀释液从高到低分别接种,以选择出最佳稀释度进行接种培养试验)。接种完毕后,将不同培养皿分类重叠,倒置于培养箱中培养,细菌在37℃下培养2天,真菌在27℃~28℃下培养3天,放线菌在27℃~28℃下培养6天,记录每种菌种的菌落数,得出合适的释倍数,计算出菌数。
4.菌数的计算
菌数(克干土)=计数皿平均菌落数×计数皿稀释倍数×水分系数。
水分系数=1/(1-W%)。式中,W%为自然含水量。
2.4 数据统计分析
采用SPSS17.0数据分析软件和Excel分析数据。
3.结果与讨论
3.1 不同湿地土壤的养分含量
不同湿地不同地点的土壤养分,即总磷、总氮、有机质含量以及pH值见表9。
表9

由表9可知,同一个湿地,处于或靠近污染源处的土壤样本的总磷、总氮含量一般要高于相对污染较少或远离污染源的土壤样本;有机质的变化量没有规律性。这说明湿地的污染源主要来自生活污水或者农田灌溉后的剩余水,这些水的总氮、总磷含量较高,可能主要与残留在土壤中的化肥被灌溉水冲走排入湿地有关。但是,经过湿地的净化之后,总氮、总磷含量显著下降。这说明湿地对于氮、磷有一定的处理、净化能力。
通过比对也可以发现,不同湿地的总氮、总磷含量也不相同,没有什么规律性。但是通过观察可以发现,不同湿地对总磷、总氮的净化能力也不相同。综合比对可发现,黄沙古渡湿地的净化能力要强于鸣翠湖湿地,也要强于腾格里湿地。
由于宁夏大部分土壤都是盐碱地,所以不同湿地的土壤pH都比较高。
3.2 不同湿地的土壤酶活性
不同湿地、不同地点的土壤酶活性,即脲酶、磷酸酶、蔗糖酶、过氧化氢酶的活性见表10。
表10
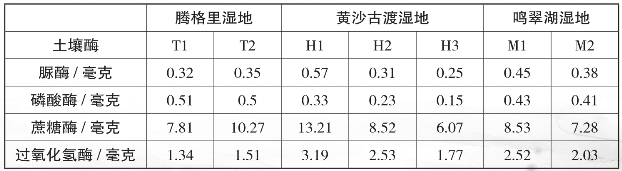
由表10可知,同一个湿地的不同位置处,脲酶、磷酸酶、蔗糖酶、过氧化氢酶的活性各不相同,而且有一个显著的规律,污染处酶的活性都相对比较高,远离污染源处酶的活性就低。这个规律可能指示出酶的活性的高低与污染物的多少有一定关系。这说明污染物,即总磷、总氮比较多的地方,一些相关的酶的活性就会升高,进而快速分解这些物质。
通过对比还可以发现,不同湿地酶的活性也是不相同的。但是同样污染源处酶的活性较高,黄沙古渡湿地酶的活性要强于鸣翠湖湿地,也要强于腾格里湿地,这一点与之前提到的三者在土壤养分含量的关系上一致,这进一步指示出污染物的含量与酶的活性强度有很大关联性。
3.3 不同湿地土壤微生物的数量
不同湿地、不同地点的土壤微生物数量,即细菌、放线菌、真菌的数量见表11。
表11
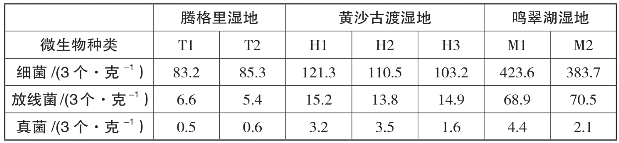
由表11可知,不同湿地环境条件下微生物的数量是不相同的,具体表现为:鸣翠湖湿地微生物总数>黄沙古渡湿地微生物总数>腾格里湿地微生物总数。这种表现可能与不同湿地的土壤类型有关。鸣翠湖湿地的土壤主要含有的是泥土,而黄沙古渡湿地和腾格里湿地主要含有的是泥沙。虽然不同湿地的微生物总数不相同,但是每种微生物所占比例基本相同。
在同一个湿地的不同取样地点,测得的微生物数量也有所差异。可以总结出,位于污染源处的取样点的微生物数量要多于其他取样点的数量。这与酶的活性分布有一定的相关性,说微生物的数量和酶的活性相互关联。
3.4 不同湿地土壤条件的差异性比较
经过SPSS软件的分析,脲酶的活性与总氮量呈现出显著的正相关性,这说明脲酶在土壤氮转化过程中作用突出,其可以在很大程度上表示出土壤的总氮含量。磷酸酶的活性与总磷量也呈现出显著的正相关性,这说明磷酸酶在土壤磷转化过程中作用突出,其可以在很大程度上表示出土壤的总磷含量。蔗糖酶与过氧化氢酶与有机质含量呈现出显著的正相关性,蔗糖酶可以在一定程度上作为有机质含量的指标。这说明,脲酶在氮的去除方面、磷酸酶在磷的去除方面都有着不可替代的作用。而且湿地的土壤酶的活性与土壤养分含量呈现出极显著的相关性,但相关性因酶的种类的不同而不同,这样的结果也正好与前期调研的文献相符合。
相关性分析表明,不同湿地的土壤的酶的活性之间存在着一定的线性相关性。其中,脲酶和过氧化氢酶呈现出极显著的相关性,这说明脲酶和过氧化氢酶能够很好地反映土壤的营养状况。脲酶和磷酸酶有显著的相关性,这说明这两种酶有共同的趋势。由以上结论可以看出,土壤酶在促进有机物转化的过程中不仅表现出专性特性,同时也存在共性关系;酶的专性作用反映了土壤中与某类酶相关的有机化合物的转化过程,而有共性关系的酶的总体活性在一定程度上反映了土壤的营养状况。
相关性分析表明,土壤中微生物的数量与土壤酶的活性显著相关。其中,脲酶、蔗糖酶与真菌显著正相关;过氧化氢酶、磷酸酶与真菌极显著正相关;脲酶、磷酸酶、蔗糖酶与细菌极显著正相关;过氧化氢酶与细菌显著正相关;磷酸酶与放线菌极显著正相关;脲酶、过氧化氢酶、蔗糖酶与放线菌显著正相关。
4.结论
(1)不同湿地的土壤养分,即总氮、总磷和有机质含量有显著差异,表现为:黄沙古渡湿地>鸣翠湖湿地>腾格里湿地,并且黄沙古渡湿地的土壤养分明显高于其他两种湿地。
(2)不同湿地的土壤酶的活性,即脲酶、磷酸酶、蔗糖酶和过氧化氢酶的活性也存在显著差异,表现为:黄沙古渡湿地>鸣翠湖湿地>腾格里湿地。
(3)同一湿地靠近污染源处的土壤养分与酶的活性同远离污染源处的土壤养分与酶的活性有显著差异。靠近污染源处的土壤养分含量多,酶的活性强;远离污染源处的土壤养分含量少,酶的活性弱。
(4)三种不同湿地的土壤酶的活性与土壤养分有密切的关系,其中脲酶、过氧化氢酶、磷酸酶的活性与土壤养分之间的相关性最好,呈显著或极显著正相关,并且这三种酶的活性也呈显著或极显著正相关,因此脲酶、过氧化氢酶、磷酸酶的活性是该地区较为理想的土壤营养状况的表征指标。
(5)土壤中微生物的数量与土壤酶的活性显著相关。其中,脲酶、蔗糖酶与真菌显著正相关;过氧化氢酶、磷酸酶与真菌极显著正相关;脲酶、磷酸酶、蔗糖酶与细菌呈显著正相关;过氧化氢酶与细菌显著正相关;磷酸酶与放线菌极显著正相关;脲酶、过氧化氢酶、蔗糖酶与放线菌显著正相关。
(6)湿地靠近污染源处的土壤养分与酶的活性与远离污染源处的土壤养分与酶的活性之间的差异可以反映出湿地净化能力的强弱,表现为:黄沙古渡湿地>鸣翠湖湿地>腾格里湿地。
5.展望
本研究主要通过对宁夏不同类型湿地土壤中磷酸酶、脲酶和过氧化氢酶的活性的测定和微生物数量的测定与污水中氮、磷去除率相关性的分析,研究将土壤酶的活性和微生物的数量作为评价净化效果和指导未来建设人工湿地种类的标准的可能性。经过显著性差异分析,可知湿地净化能力的强弱,表现为:黄沙古渡湿地>鸣翠湖湿地>腾格里湿地,进而可以将之引申为:河流湿地>湖泊湿地>沙漠湿地。因此,这在指导今后用于净化环境的人工湿地的建设方面有很强的指导意义。
参考文献
[1]杨万勤,王开运.土壤酶研究动态与展望[J].应用与环境,生物学报,2002,8(5):564-570.
[2]金兆丰,王健.我国污水回用现状及发展趋势[J].环境保护,2001(11):3941.
[3]吴晓磊.人工湿地废水处理机理.环境科学[J],1995,16(3):83-86.
[4]Max M C,Wood M,Jarvis S C.A microplate flurimetric assay for the study of enzyme diversity in soils[J].Soil Biology & Biochemistry,2001,33:633-640.
[5]孙瑞莲,赵秉强,朱鲁生.长期定位施肥对土壤酶活性的影响及其调控土壤肥力的作用[J].植物营养与肥料学报,2003,9(4):406-410.
[6]Mitsch W J,Cronk J K,Wu X,et al.Phosphorus retent ion in constructed freshwater riparian marshes[J].Ecol.Appl.,1995,5:830-845.
[7]李寒娥.人工湿地系统在我国污水处理中的应用.环境污染治理技术与设备,2004,5(7):12.
[8]陈宜瑜,吕宪国.湿地功能与湿地科学的研究方向[J].湿地科学,2003,1(1):7-11.
[9]Mitsch W J,James G.Gosselink.Wetland[M].Van Nostrand Company Inc,.2000:356-430.
[10]鲍孝容.关于我国污水资源化的研究[J].环境科学与技术,2005,28(2):51-53.
[11]梁威,胡洪营.人工湿地净化污水过程中的生物作用[J].中国给水排水,2003,19(10):28-31.
[12]Bonomo L,Pastorell G,Zambon N.Advantages and limitation of duckwead-based wastewater treatment systems.Water Science and Technology.1997,35(5):239-246.
[13]刘存歧,王伟伟,李贺鹏.湿地生态系统中土壤酶的研究进展[J].河北大学学报,2005,25(4):4.
[14]万忠梅,吴景贵.土壤酶活性影响因子研究进展[J].西北农林科技大学学报(自然科学版),2005,33(6):87-92.
[15]熊汉锋,黄世宽,陈志平,等.梁子湖湿地土壤活性初步研究[J].生态环境,2005,15(6):1305-1309.
[16]关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
[17]黄昌勇.土壤学[M].北京:中国农业出版社,2000.
[18]曹慧,孙辉,杨浩,等.土壤酶活性及其对土壤质量的指示研究进展[J].应用与环境生物学报,2003,9(1):3.
[19]姚每梅,杨晓红,郑雪虹.蔬菜大棚土壤微生物种类及数量的初步研究[J].华中农业大学学报,1997,16(4):92-93.
[20]何振立.土壤微生物量及其在养分循环和环境质量评价中的意义[J].土壤,1997,(2):61-69.
[21]梁威,吴振斌.复合垂直流构建湿地基质微生物类群及酶活性的空间分布[J].云南环境科学.2002,2(1):5-8.
[22]孙炳寅,朱长生.互花米草场土壤微生物分布及某些酶活性的影响[J].生态学报,1989,9(3):240-244.
[23]中国医学科学院卫生研究所.土壤卫生监测检验方法[M].北京:人民卫生出版社,1985:72-75.
[24]程国华,郭树凡,薛景珍,等.长期施用含氯化肥对土壤酶活性的影响[J].沈阳农业大学学报,1994,25(4):360-365.
[25]周礼恺,张志明.土壤酶活性的测定方法[J].土壤通报,1980,1(5):37-38.
[26]戴伟,白红英.土壤过氧化氢酶活度及其动力学特征与土壤性质的关系[M].北京林业大学学报,1995,17(1).
[27]周易勇,李建秋,张敏.湿地中碱性磷酸酶的动力学特征与水生植物的关系[J].湖泊科学,2002,14(2):134-138.
[28]赵兰坡,姜岩.土壤磷酸酶测定方法的探讨[J].土壤通报,1986,17(3):138-141.
[29]中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985:24-27;89-95;260-275.
[30]沈宏,曹志洪,徐本生.玉米生长期间土壤微生物量与土壤酶变化及其相关性研究[J].应用生态学报,1999,10(4):471-474.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















