一、从环境中获取微生物核酸
分析微生物群落的传统方法一般包括用选择和鉴定培养基稀释平板法进行培养检测或直接计数。直接计数可以得到现存细菌的总数,但不能给出群落的数量或多样性信息。然而,数据表明仅有少于1%的一般土壤细菌可以被培养。因此培养提供的信息只是九牛一毛。另外,所有培养基实际上都是对在其上生长细菌的选择,也就是说,培养基的选择是决定分析结果的关键。表15-6列出了不同培养基对土样明显不同的计算结果。从表中可见尽管从跨越4.9m深的一系列沉积物样品中得到的直接计数结果很相似,但培养计数却随培养基类型不同而变化。由一种营养丰富的培养基(PTYG)(由蛋白胨、胰蛋白酶酶解酪蛋白、酵母浸出物和葡萄糖组成)培养计数得到的数量比两种低营养培养基低1到3个数量级。这两种低营养培养基分别是一种1∶10倍稀释的PTYG和一种由1∶2表层土悬浮液制备的土壤浸出物琼脂。这些数据表明大多数土壤微生物生存在有限营养条件下。
以培养基培养方法分离和计算的微生物种群及群落的信息是极其重要的,但不是完整的,而以微生物核酸为基础的微生物信息则可以弥补前者的不足,并可把这二种方法结合起来,以得到尽可能多的数据,使信息更加完整、丰富。获取生态环境或培养条件下的微生物遗体物质(DNA或RNA),对进一步分析微生物是十分重要的,这里以获取DNA为例,阐述微生物遗传物质的获取。
表15-6 不同培养基对沉积物样品计数的影响

引自Balckwill and Ghiorse,1985。
①AODC,吖啶橙直接计数。
②PTYG,由蛋白胨、胰蛋白酶酶解酪蛋白、酵母提取物和葡萄糖配制的营养丰富培养基。
③稀释PTYG,1∶20稀释的PTYG培养基。
④SSA,土壤提取物琼脂。以1∶2蒸馏水悬浮表层土样,然后离心并过滤,澄清抽提液经灭菌即得该培养基。
⑤这一样品在未饱和区与饱和区界面采集。
将细菌DNA从土壤样品中分离出来(图15-4)有两种方法:
1.土壤中细胞的提取及随后的DNA回收
在这种方法中,先从样品中分离完整细胞,然后进行裂解以回收DNA。DNA回收的过程是一个连续的多步的过程。
(1)回收细胞
首先是样品(土壤或沉积物)的均质化,以便打碎聚集体和分散真菌和细菌细胞。通常将10g样品置入一种含聚乙烯基聚吡咯烷酮(PVPP)的缓冲液中,PVPP能同腐殖酸化合,从而有助于去除腐殖质,因为腐殖质会影响DNA分析,所以这一步反应非常重要。土壤或沉积物微粒以及真菌细胞都可以通过低速离心去除,接着高速离心获得细菌细胞,这一过程为差速离心。为确保回收到最大量的细菌,通常要进行多轮均质化和差速离心。
(2)裂解回收DNA
在细胞回收后,加入溶菌酶进行裂解。细胞残渣经离心去除,并从上清液中提取游离的DNA,然后进行纯化,提取的DNA量因样而异,但通常每克表层土壤的含量在1~5mg范围内。
操作得当时这种方法可回收沙壤土中细菌群体的33%左右。而富含黏土的土样回收率要低些,这是因为被紧密吸附的细菌细胞在低速离心时随土壤颗粒被去除。细胞的吸附也会影响回收特定的细菌群体。经二分裂产生新细胞的细菌新陈代谢旺盛,它们被吸附的程度较不紧密,会被优先回收,相反生长不活跃的老细胞被紧密吸附,因而易于在离心中流失。因此这一过程对细菌的选择是基于细菌的吸附性和对黏土胶体的吸附程度,而不是所有类型的细胞都以同样的效率被提取。
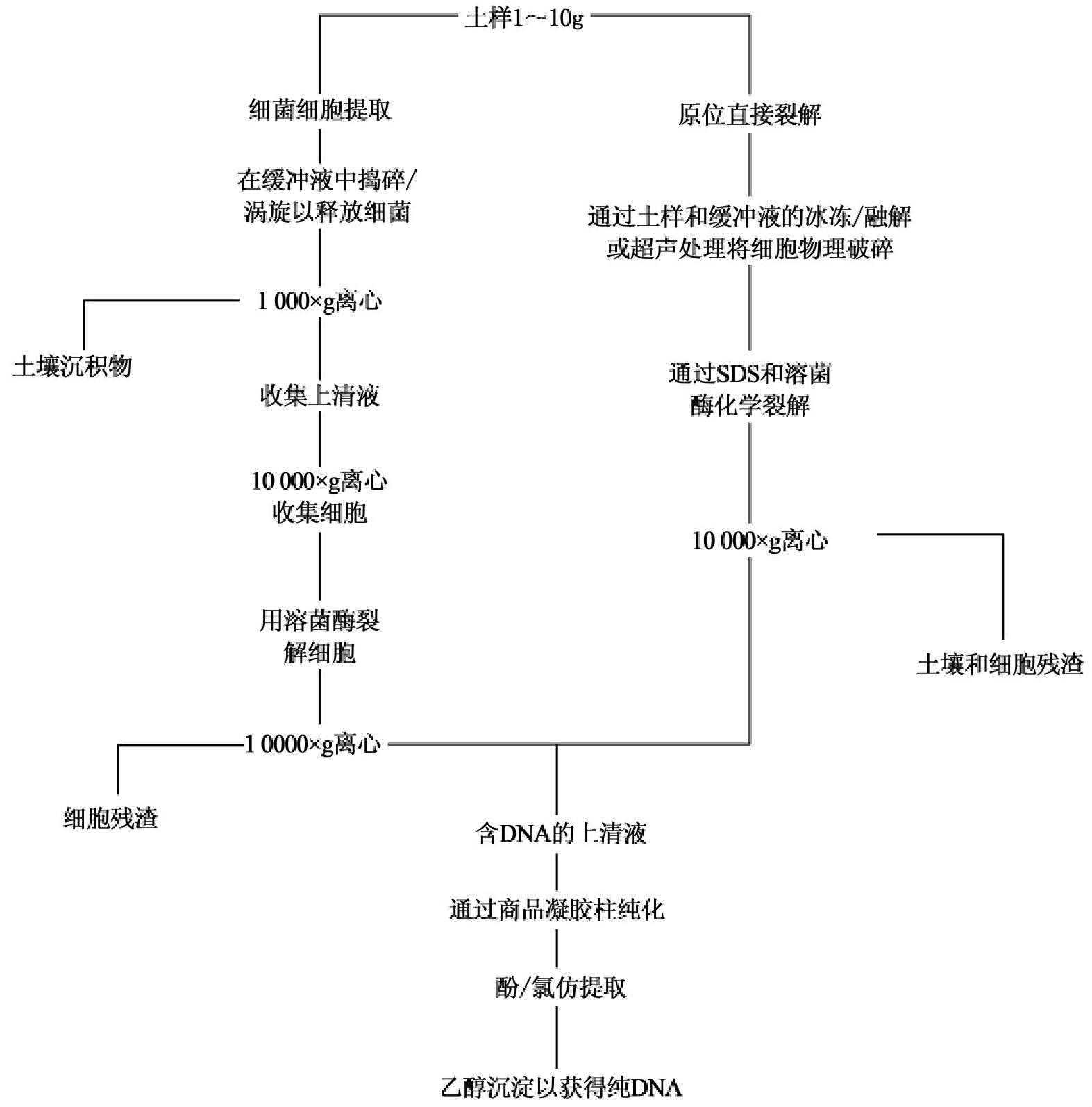
图15-4 从土样中获取群落DNA的方法
2.原位裂解及DNA回收
这种方法的特点是目标微生物在土壤中被裂解,它们的DNA在其从样品中提取之前就释放出来,裂解通常采用物理与化学处理相结合。对细菌而言,物理处理包括冻融循环、超声波破碎和玻璃研磨,化学处理经常使用去污剂,如十二烷基硫酸钠(SDS)或者溶菌酶和蛋白酶。在裂解后,细胞残片和土壤颗粒通过离心被除去,DNA被保留在上清液中。
二种方法所得的上清液的DNA能够通过离子交换树脂或凝胶柱提纯。这些步骤对除去干扰DNA分析的腐殖质非常重要。DNA样品再用苯酚-氯仿/戊醇氯化铯密度梯度离心或市售纯化试剂进一步提取纯化。纯DNA样品能用于后续的分子水平的分析。然而,不论用哪种提纯方法,提纯过程中的每一步都会导致DNA损失,因此,DNA的得率总是随其纯度的提高而降。
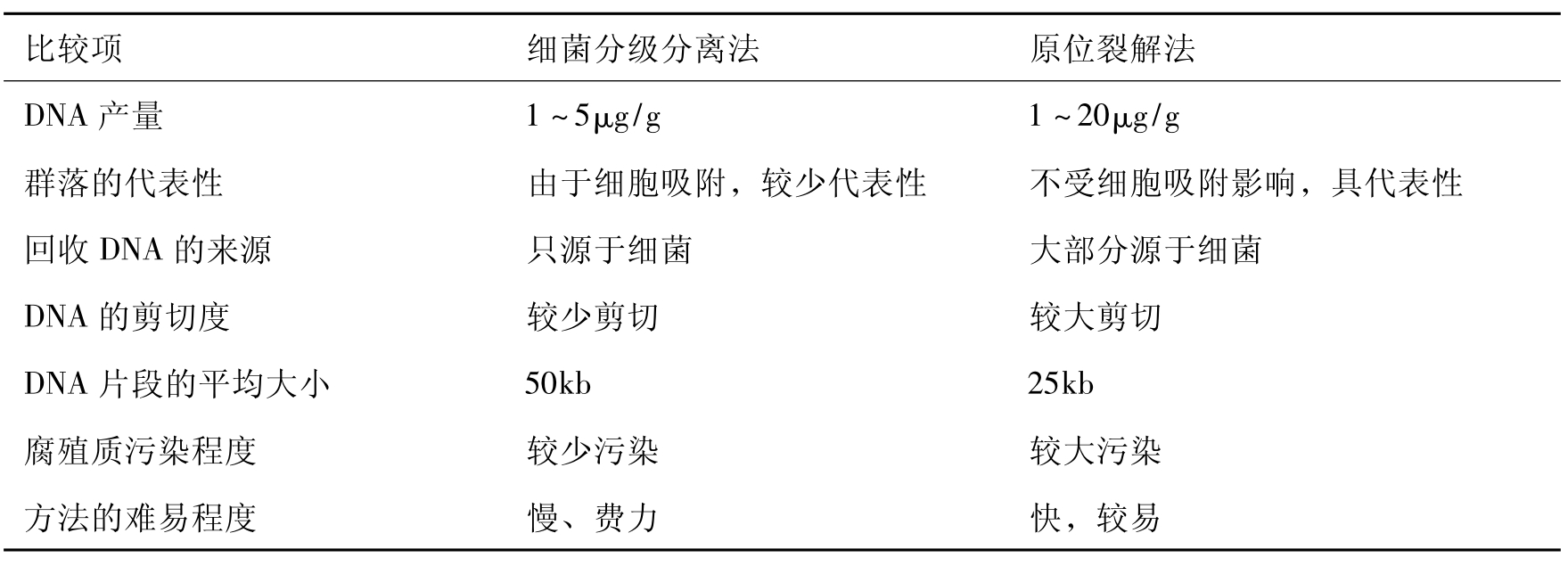
两种提取DNA的方法各有不同的特点(表15-7)。前一种方法因为在细胞裂解前细菌就同真菌分离了,这样最终就可以回收到较纯的细菌DNA。这种方法也能从土壤细菌群落中得到有活力的细胞,这些细胞能被二次抽样并且可以通过不同的途径来分析。然而需要注意的是完整的无活力的细胞也会被回收。后一种方法的主要优点是省力、快捷,并且在通常的情况下可提高NDA的回收率(1~20mg NDA/g土壤)。同时这种方法比分级分离法能更好地代表细菌群落,这是因为它不受土壤胶体吸附细菌的影响。这样直接裂解法在DNA回收中被广泛采用。然而也存在一些不足之处,主要包括:①黏土或腐鱼质胶体对裂解细胞释放DNA的吸附也能减少DNA提取的回收率;②DNA易被腐殖质污染;③DNA易被随机剪切,因而提取DNA分子量较小。有人认为通过原位裂解得到的DNA可能还包括真菌和原生动物的DNA,但是通常使用的化学药品不溶解真菌细胞,原生动物在土壤中的密度也比细菌小得多。因此,即使考虑原生动物较大的基因组,原生动物在每克土壤中含104个,似乎不会对108~109细菌提取的DNA有较大影响。
表15-7 细菌分级分离法和原位裂解法从土壤中回收DNA的比较
纯DNA样品可以通过紫外分光度法定量测定。DNA含量在260nm波长下测量吸光度达1.0时,相当于每毫升溶液中含50μg DNA。DNA纯度用260nm与280nm吸光度的比值来估算,比值大于1.7表明DNA纯度较高,最大理论值为2.0。
对于水体样品,细胞可通过适当的过滤器对一定量的水样进行浓缩。使用0.2μm滤膜过滤可捕获细菌。病毒太小,不能以大小排除过滤方法滤得,需用负电性或正电性的滤器来收集。而大一些的贾第虫属和隐孢子虫寄生虫可用纤维纸滤膜滤得。如同土壤样品,一旦这些机体从水中收集,即可进行溶解,提取DNA,并做进一步的纯化分析。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















