二、转基因动物的制作方法
自第一个转基因动物诞生以来,转基因动物方法学得到了很大发展和充实,出现了许多新颖的可行的转基因动物方法,主要方法包括以下几种。
(一)前核胚显微注射法
将外源DNA用微注射器(直径1~1.5μm)注射到动物的受精卵中,使外源DNA整合到宿主染色体中去的一整套转基因动物技术。主要包括:目的基因和表达元件的克隆及表达载体的构建、制备显微注射DNA溶液、准备卵母细胞和胚胎、显微注射DNA到受精卵的前核、注射DNA的胚胎移植到受体代孕动物、怀孕和分娩、新出生动物外源DNA的检测。
DNA显微注射溶液含有目的基因的重组质粒或黏粒,质粒经转化、培养和分离获得超螺旋DNA,经适当酶切、琼脂糖或聚丙烯酰胺凝胶电泳分离纯化和提取纯化,注射液悬浮,0.22μm滤膜过滤,注射的DNA为200~800个DNA拷贝。
显微注射有专用显微注射操作台,针头直径大约1μm,注射DNA溶液量约1~2pl。注射过的胚细胞在培养基中37~39℃保温或培养适当时间后移植到代孕动物体内。一般注射的胚细胞最好在体外培养3~7d,选择发育和形态正常的胚胎用于移植。显微注射示意图见17-1。
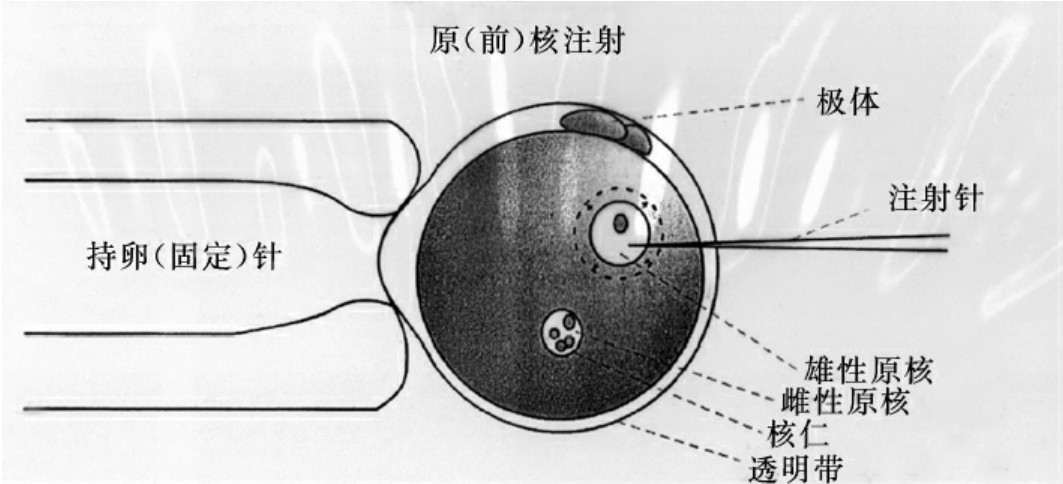
图17-1 显微注射示意图
微注射法制备转基因动物需要对供体动物进行超排卵操作,用孕马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(hCG)等黄体激素处理供体雌性可引起供体动物超排卵,随后进行受精(体内或体外),并进一步通过腹腔镜外科手术收集卵母细胞或胚胎用于DNA显微注射。
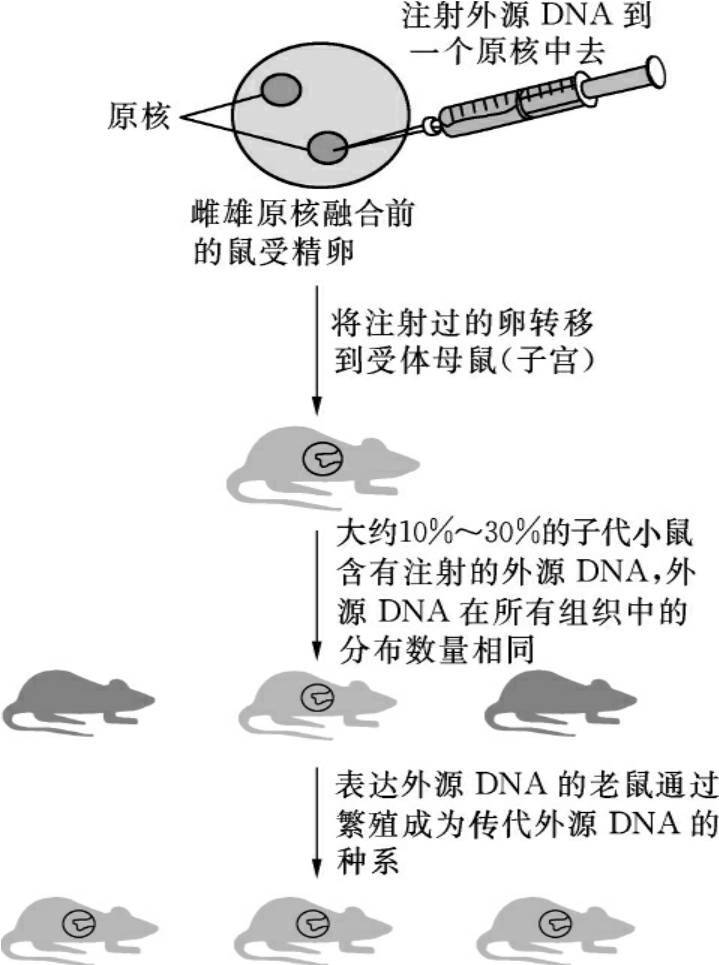
图17-2 显微注射法制备转基因小鼠
注射的卵母细胞或胚胎须移植到代孕受体动物,代孕受体动物须事先与供体同步发情,通常用前列腺素F2-α引起黄体分解,胚胎移植可以通过手术进行,大型动物也可以用非手术的方法进行。
最后是怀孕、分娩及检测。
第一个转基因小鼠就是采用显微注射的方法获得的(图17-2),相继的许多转基因动物的制备采用了显微注射前核转基因动物方法,但这一方法的主要缺点是外源基因的整合效率低,游离载体常结合在环形基因组上显示“过高”的阳性转移率,虽然可以存在于整个动物的生命期,但游离载体不能传给下一代。
(二)单细胞阶段的显微注射法制作转基因鸡
鸡的受精发生在输卵管的漏斗处,可以同时有多个精子进入卵内,但只能形成一个雄性质核,受精卵在输卵管到产蛋的这段时间内不断分裂,产蛋时的胚胎已到达囊胚期,细胞总数达到8万~10万个。因此鸡蛋产出时已不能将外源基因注射到核中。为获得早期发育鸡卵,在鸡蛋产出后2~2.75h,通过剖腹取出刚进入输卵管部的鸡卵(原核阶段),可以通过显微注射给鸡卵胚盘注射外源基因。注射后的鸡卵转移到另一个盛有蛋清和抗生素混合液的稍大一号的鸡蛋壳中,用膜封口,特制夹子固定在孵化器中孵化。
Perry(1988年)成功地从单细胞受精卵开始在体外培养,Naito等(1993年)通过显微注射单细胞受精卵获得转基因鸡,外源基因可以通过生殖传给后代。
(三)反转录病毒载体法转基因动物
反转录病毒自身可感染细胞,并能有效整合到宿主细胞染色体中去,可以用作转非病毒和细胞的DNA载体。反转录病毒有严格的寄主选择性,仅能在一种或相近种类中复制。20世纪80年代,Grittenden等用禽白血病病毒(ALV)作载体,感染刚产出的受精卵胚盘得到了转基因鸡。2000年10月Schatten等用反转录病毒载体法成功获得了第一例带有绿色荧光蛋白(GFP)基因的转基因小恒河猴——安迪(图17-3)。这只转基因猴的出现可能会有助于人们更快找出癌症、糖尿病、老年痴呆症等各种疑难病症的治疗方法,科学家还可以利用基因改造技术来防止一些可能出现的病症。
2002年AviGenics公司成功报道了通过反转录病毒载体制备了转基因鸡,并成功实现在鸡蛋蛋清中表达外源基因。

图17-3 第一只转基因猴安迪
(带有水母绿色荧光蛋白基因)
反转录病毒载体转基因动物方法的优点是感染效率高、外源基因单拷贝高整合。缺点是携带的DNA片段不超过8kb,这种载体是否存在致癌风险仍属疑问,20世纪90年代以后,这种方法逐渐被其他方法所替代。
(四)胚胎干细胞法转基因动物
胚胎干细胞(ES细胞)是胚胎内未分化的具有细胞全能性的细胞团,具有高度的潜在的分化为各种细胞类型和组织的能力。被用作外源基因载体,通过注射法注入受体胚胎囊胚形成嵌合体,发育后可形成转基因动物。最近猪的胚胎干细胞系已被成功用作制备转基因猪。
胚胎干细胞转基因动物的优点是囊胚腔容易注射,整合率高达50%,整合和表达可以在干细胞中进行检测,并且基因的转移能够在桑椹胚和囊胚期进行调控。缺点是并非所有的哺乳动物都有可操作的胚胎干细胞系。
(五)体细胞转染和胚胎克隆法转基因动物
将体细胞的细胞核移植到去核的卵母细胞中,科学家们成功获得了带有人凝血因子Ⅸ的转基因绵羊,这种方法特别适合于制备转基因动物,如转基因山羊和转基因牛等。
科学家们对这一方法的关注和使用已经超过了显微注射法,通过克隆方法制备转基因动物所需的实验动物比显微注射法大约少70%。本方法的最大优势是可以在培养基细胞上实施对细胞进行基因转移并检测外源基因的转移、整合和表达情况,选择整合和表达外源基因的细胞进行胚胎移植,成功率高。
(六)原生殖细胞介导法转基因动物
原生殖细胞(primordial germ cells,PGCs)是生殖细胞(卵母细胞和精原细胞)的前体细胞,未分化,多潜能。采用毛细管穿刺胚胎心脏转染PGCs,整合有外源基因的PGCs随胚胎发育的进行逐渐汇聚到特定组织,外源DNA只限定在性腺细胞,可用于制备转基因动物。最近有人从猪胚获得原生殖细胞并制备了高嵌合度的嵌合体猪,胚胎中的多潜能生殖细胞可以形成嵌合体动物的生殖细胞。目前很多实验室都可以较好地分离制备和培养PGCs,并对PGCs进行遗传操作,尤其是转基因鸡的研究中,有不少学者把注意力集中在PGCs上。
(七)精子载体法转基因动物
通过精子与卵细胞受精过程将外源基因带入受精卵的转基因动物方法,思路很好,但获得的受精卵效率很低,大多数情况下外源基因会发生重排。有人对精子载体法进行改进并获得转基因小鼠,先用温和的消化剂将精子的细胞膜消化掉,精子DNA经温育后直接注射到卵细胞,从而发育为带有外源基因的受精卵。成功的关键主要取决于单精子胞质内注射技术(in-tracytoplasmic sperm injection,ICSI),这一方法至今只在小鼠中成功过。利用运动的精子作载体转化外源基因技术得到了广泛发展,在此基础上诞生了精子-DNA-脂质体载体法、精子-DNA电转化载体法、精子抗体-DNA载体法。精子载体法操作简单,不需复杂设备,但整合困难,不能通过生殖传给后代,转基因动物为嵌合体。
(八)脂质体精子双载体法转基因动物
将待转移的外源基因用脂质体包埋后与精子细胞温育,然后人工授精,收集受精的鸡蛋孵化,孵化出的小鸡带有外源DNA,但外源DNA没有整合到鸡染色体中去,处于“游离”状态。上海复旦新杨生物科技有限责任公司同样采用脂质体包埋DNA与精子温育和人工授精,后代小鸡带有外源DNA的比例高达60%以上(大规模试验结果),并能在鸡蛋蛋清中检测到外源基因的表达产物,但杂交分析和配种结果显示,外源基因不整合。这一方法操作简单,适合大规模转基因试验,有可能成为大规模生产转基因动物的方法。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















