3.4.1 化学反应速率
1.化学反应的进度与反应速率的表示方法
化学反应速率就是指化学反应的快慢。通常可用单位时间内反应物浓度的减少或生成物浓度的增加来表示化学反应的速率v:
![]()
由于反应物或生成物的浓度随反应的进行不断变化,其反应速率也是不断变化的。因而用上述公式表示的反应速率v,实际上是在某一时间段Δt内的平均速率。对于指定时刻的瞬时速率则可用下式表示:
![]()
用反应物或生成物的浓度随时间的变化率来表示的化学反应速率比较直观,但有严重的局限性:当反应物与生成物的化学计量数[2]不是1时,选用不同的反应物或生成物作为测量标准,就会得出不同的v值,即在相同条件下,同一反应具有不同的反应速率。例如:

为了避免这样的麻烦,国际纯粹及应用化学会建议改用化学反应进度随时间的变化来表示化学反应的速率。
定义:在化学反应某一阶段中任何一种反应物或生成物的量的变化Δn(dn)与其化学计量数ν之商为该化学反应的反应进度ξ,其单位是mol。对于反应
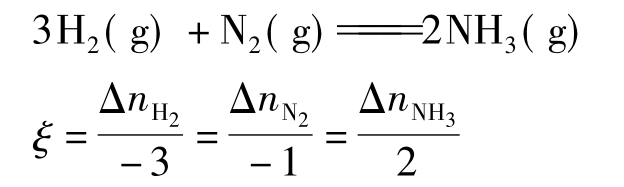
由于在反应中,反应物是减少的,其Δn为负值,而生成物是增加的,其Δn为正值。因此在计算反应进度时,规定反应物的ν取负值,生成物的ν取正值。下面举例说明化学进度的概念及其表示方法:
2H2(g)+O2(g═══)2H2O(g)
假定当上述反应进行到反应进度ξ时,消耗掉1.0mol的H2(g),即ΔnH2=-1.0mol,则按反应方程式可以推知同时消耗掉的O2(g)的量应为0.5mol,即ΔnO2=-0.5mol,而同时生成了1.0mol的H2O(g),即ΔnH2O=1.0mol,按反应进度的定义可求算ξ:
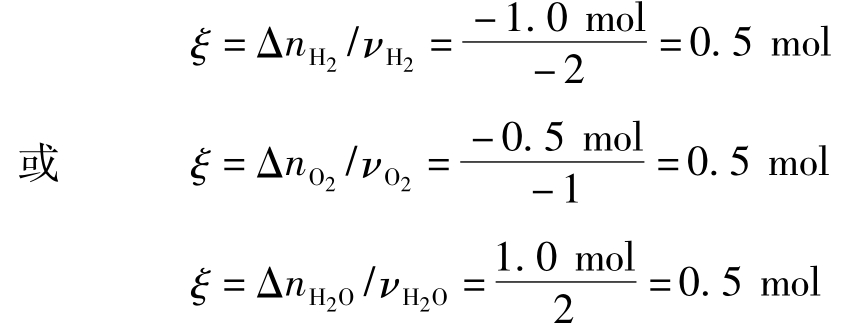
由此可知,对于任何反应,在任何指定的反应进度,不管以任何反应物或生成物作测量标准,得出的ξ值是相同的。因此,用化学反应进度随时间的变化率来表示化学反应速率6ξ,将不随测量标准不同而不同。
6ξ=Δξ/Δt或6ξ=dξ/dt
现在国际上已通用这种反应速率表达式。
2.影响化学反应速率的因素
(1)反应物浓度对反应速率的影响
化学家总结出了化学反应速率与反应物浓度间的关系,称为质量作用定律,即化学反应的速率与反应物浓度一定方次的幂成正比。例如,对于反应aA+b─→BdD+eE而言,反应速率v可表示为
![]()
式3.4-1称为质量作用定律表达式,亦称为化学反应速率方程式。式中cA、cB为反应物A、B的浓度。k称为反应速率常数,其物理意义是当反应物的浓度都等于1mol·dm-3时,该反应的速率大小。它表征了一个化学反应,在反应速率方面的本质特征。对于指定的化学反应而言,k为一个条件常数。k值与反应物浓度无关,而与温度及催化剂等因素有关。
反应速率方程式中,反应物浓度项的指数x,y,…,一般不等于相应的反应物A、B的化学计量数a、b。反应物浓度项指数的总和(x+y)值称为反应的级数。若x+y=2,则为二级反应。
通常x、y的值是通过实验求出的,可以等于0或整数,也可以是小数(或分数)。反应级数不同,表示反应速率与各反应物浓度的定量关系不同。
当反应为一步完成的简单反应时,该反应称为基元反应,其反应速率方程式中浓度项的指数才等于相应的化学计量数。即只有基元反应aA+b─→BdD+eE,其反应速率方程式才能
写作: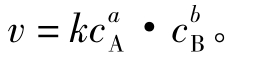
因此,通过实测反应的x、y,并与a、b相比较,就可以判断某一化学反应是否属基元反应。
大多数反应都是由多步基元反应组成的复杂反应。复杂反应的每步可单独按基元反应处理,按反应化学计量数直接写出速率方程式中相关浓度项的指数。在实际的复杂反应中,各分步反应中速率最慢的一步,决定了整个反应的速率,称为反应速率的决定步骤。当人们在实践中希望加快某反应的速率时,首先应该设法提高反应速率决定步骤的速率。
(2)温度对反应速率的影响
化学反应速率通常随温度升高而增大,但不同的反应增大的程度不同。这是因为化学反应速率常数k随温度升高而变大的缘故。阿伦尼乌斯公式表明了反应速率常数k随温度T变化的定量关系,即
![]()
式中A和B为两个常数,可由实验求得。进一步研究表明常数B与反应的活化能Ea有关。故阿伦尼乌斯公式可改写为
![]()
即B=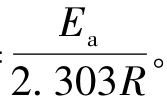 R为气体常数,其值取8.315J·mol-1·K-1。利用式3.4-2,可由两个不同的温度T1、T2时的速率常数k1、k2,求得Ea。亦可由某一温度时的反应速率常数及活化能Ea求算另一温度时的速率常数。
R为气体常数,其值取8.315J·mol-1·K-1。利用式3.4-2,可由两个不同的温度T1、T2时的速率常数k1、k2,求得Ea。亦可由某一温度时的反应速率常数及活化能Ea求算另一温度时的速率常数。
活化能Ea实质上代表了反应物分子发生反应时所必须首先克服的能垒。现代化学反应速率理论认为,化学反应的历程可以描述为:具有足够能量的反应物分子,在运动中相互接近,发生碰撞,有可能生成一种活泼的不稳定的过渡态,通常称为活化络合物或活性中间体,而后,活化络合物再分解形成生成物:
![]()
按照气体分子运动理论可知,在任何温度下反应体系中所有分子的能量总是高低不等的。这中间永远只有一部分能量足够高的分子,才可能在相互碰撞时引起化学变化,人们把这种碰撞称为有效碰撞。把那些具有足够高能量、能发生有效碰撞及化学变化的分子称为活化分子。活化分子所具有的最低能量与反应物分子的平均能量之差就是活化能。如果一个反应的活化能很小,那么反应物只需从环境中吸收少量的能量(如热和光),即能克服活化能。从定量式3.4-2也可以看出,在指定温度下,Ea越大,反应速率常数越小,反应速率也越小。
(3)催化剂对化学反应速率的影响
在工业合成氨反应中要采用铁催化剂,实验室中分解KClO3制O2需加MnO2作催化剂,植物叶子发生光合作用必须要有叶绿素作催化剂等等。催化剂是能增加反应速率而本身的组成、数量及化学性质在反应前后保持不变的物质。催化剂所起的作用称为催化作用。催化作用的本质是改变了反应的途径,生成了新的活性中间体,因而降低了反应的活化能,使反应速率增加。
催化剂的应用不仅可以提高化学反应速率,缩短反应周期,提高产品收率,降低成本,而且可以抑制副反应,提高产品纯度和质量。人们研究各类化学反应速率的特征和影响因素,很重要的目的就是为了寻找合适的催化剂,进而控制反应速率,为人类服务。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















