在酶浓度与其他因素不变的情况下,底物浓度[S]对酶促反应速度(V)的影响呈矩形双曲线(图3-3)。在[S]较低时,V随[S]的增加而增加,V与[S]呈正比,反应呈一级反应;随[S]的增加,反应速度增加的幅度逐渐下降,V的增加不再呈正比关系,反应为混合级反应;如果继续加大底物浓度,反应速度将不再增加,达到最大(Vmax),表现出零级反应,此时酶的活性中心已被底物饱和。
(一)米-曼氏方程式
中间产物学说可以解释酶被底物饱和的现象。根据中间产物学说,酶(E)首先与底物(S)结合形成酶-底物中间复合物(ES),ES再分解为产物(P)和释放出游离的酶(E)。

图3-3 底物浓度对酶促反应速度的影响
![]()
1913年Leonor Michaelis和Maud L Menten提出了酶促反应速度与底物浓度关系的数学方程式,即著名的米-曼氏方程式,简称米氏方程:

式中Vmax为最大反应速度,[S]为底物浓度,Km为米氏常数,V是在不同[S]浓度时的反应速度。当底物浓度很低 反应速度与底物浓度呈正比。当底物浓度很高,即
反应速度与底物浓度呈正比。当底物浓度很高,即 反应速度达最大速度,再增加底物浓度也不再影响反应速度。
反应速度达最大速度,再增加底物浓度也不再影响反应速度。
(二)Km与Vmax的意义
1.Km等于酶促反应速度为最大反应速度一半时的底物浓度 当反应速度为最大反应速度一半时,将V=1/2Vmax代入上述米氏方程,得Km=[S]。Km的单位是mol/L,与底物浓度的单位一样。各种酶的Km值范围大致在10-6 mol/L~10-2 mol/L之间。
2.Km值可以近似地表示酶与底物的亲和力 Km愈大表示酶与底物亲和力愈小;Km愈小表示酶与底物亲和力愈大。这表示不需要较高的底物浓度便可容易达到最大反应速度。
3.Km值是酶的特征性常数之一 Km只与酶的结构、酶所催化的底物和反应环境(温度、pH、缓冲液的离子强度)有关,而与酶的浓度无关。对于同一底物,不同的酶有不同的Km值;多底物反应的酶对不同底物的Km值也各不相同,以Km值最小者,作为该酶作用的最适底物。
4.Vmax是酶完全被底物饱和时的反应速度 与酶浓度呈正比。
(三)Km和Vmax的测定
如图3-3所示,底物浓度曲线是矩形双曲线,其图形为渐进线,很难准确地测得Km值和Vmax值。若将米氏方程式进行某种变换,将曲线作图改为直线作图,便可容易地用图解法准确求得Km值和Vmax值。
双倒数作图法又称为林-贝氏(Lineweaver-Burk)作图,是将米氏方程式等号两边取倒数,所得到的双倒数方程式称为林贝氏方程式:
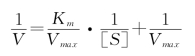
以1/V对1/[S]作图(图3-4),得一直线,其纵轴上的截距为1/Vmax,横轴上的截距为-1/Km。此作图法除用于求Km值和Vmax以外,还可用于判断可逆性抑制反应的性质。

图3-4 林-贝氏作图法
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















