二、金属化合物
在合金中,当组元元素之间不具备形成固溶体的条件或当溶质含量超过固溶体的最大溶解度时,组元间将通过相互作用而形成金属化合物。金属化合物是一种新生相,它的晶格与任一组元的晶格都不相同,而是形成自己的晶体结构。金属化合物一般可以用分子式来大致表示其组成。金属化合物与普通的化合物不同,除一般的离子键和共价键外,金属键在其形成时也参与作用,从而使它们都具有一定程度的金属性,故称为金属化合物。
金属化合物的种类很多,常见的主要有以下三种。
(一)正常价化合物
正常价化合物原子间的结合键分别以离子键、共价键或金属键为主,组成元素严格按原子价规律结合,具有严格的化合比,成分固定并可用化学式表示。通常强金属性的元素(如Mg等)与非金属或类金属元素(Sb、Bi、Sn、Pb等)能够形成这种类型的化合物,如MgS、MnS、Mg2Si、Mg2Sn、Mg2Pb等。其中MnS是钢铁材料中常见的夹杂物,而Mg2Si则是铝合金中常见的化合物。
正常价化合物具有很高的硬度,但脆性很大。在合金中,当这类化合物在固溶体基体上作合理分布时,将对合金起强化作用,可作为合金的强化相。
(二)电子化合物
电子化合物与正常价化合物不同,虽可用化学分子式表达,但不符合原子价规律。如将这类化合物的电子浓度(化合物的价电子数与原子数的比值)作统计处理时,则会发现其晶体结构与电子浓度之间有一定的对应关系,可见这类化合物的形成规律主要与其电子浓度有关,故有电子化合物之称。
当电子浓度为3/2(21/14)时,形成体心立方结构的电子化合物,称为β相。
当电子浓度为21/13时,形成复杂立方结构的电子化合物,称为γ相。
当电子浓度为7/4(21/12)时,形成密排六方结构的电子化合物,称为ε相。
但应指出,电子浓度并不是决定电子化合物结构的唯一因素,组元的原子大小及其电化学性等对其结构也有影响。合金中常见的电子化合物及其结构类型如表3-1所列。
表3-1 合金中常见的电子化合物及其结构类型
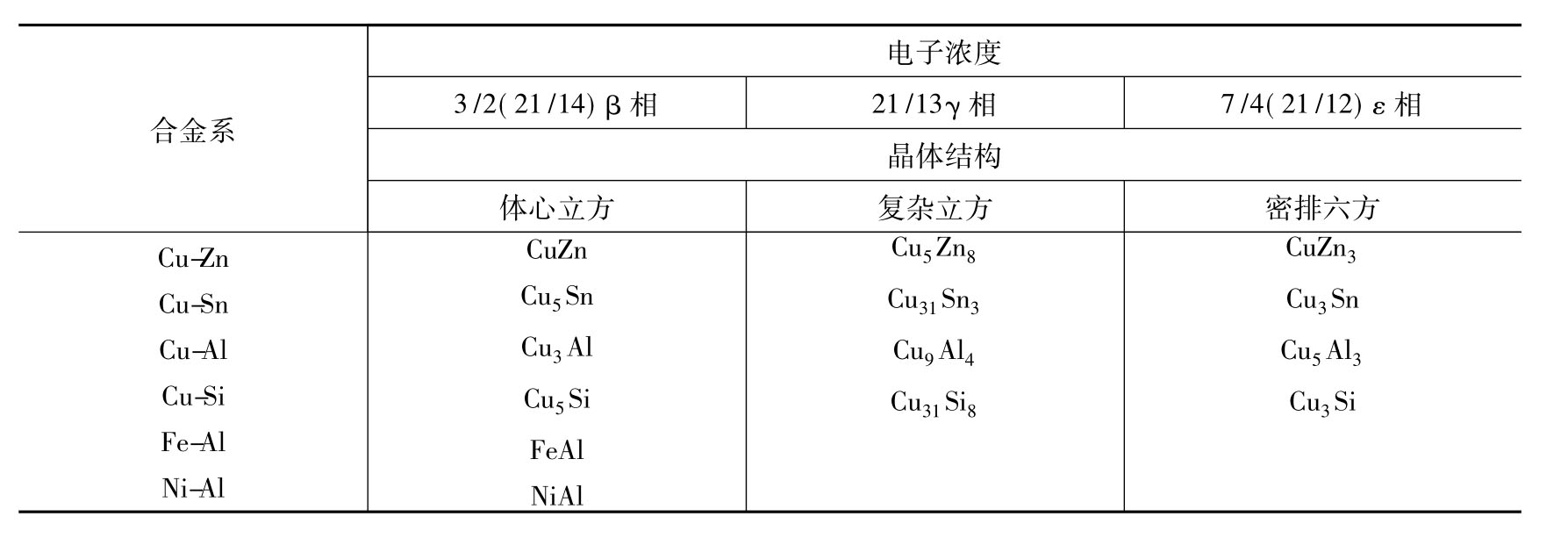
电子化合物原子之间为金属键结合,因而具有明显的金属性(如导电性等)。它们的熔点和硬度都很高,但塑性差,在许多有色金属的合金中,电子化合物是重要的强化相。如黄铜(Cu-Zn合金)中的CuZn、青铜(Cu-Sn合金)中的Cu31Sn8等。
(三)间隙化合物
这类化合物一般都是由原子半径较大的过渡族金属元素(如铁、铬、锰、钨、钒等)与原子半径较小的非金属元素(如碳、氮、硼等)所形成。例如工具钢中的VC、高碳高铬钢中的Cr7C3、不锈钢中的Cr23C6等;钢经氮化、渗硼处理后,在其表面形成的Fe4N、Fe2N、Fe2B、FeB等,都属于间隙化合物。
间隙化合物的晶体结构特点是半径较大的金属原子占据化合物晶格的正常位置,而直径较小的非金属原子按照一定规则嵌入晶格的间隙中。根据间隙化合物的结构特征可将这类化合物分为间隙相和具有复杂结构的间隙化合物两大类。
1.间隙相
间隙相是指那些晶格结构比较简单的间隙化合物,元素的比例一般能满足简单的化学式:M4X、M2X、MX和MX2(其中M代表金属元素,X代表非金属元素)。例如钨、钼、钒、钛、钽、铌等的碳化物Fe4N、W2C、VC、TiC、VC2等。
形成间隙相的条件是非金属元素的原子与金属元素的原子半径的比值R非/R金<0.59。形成间隙相时金属元素的晶格类型将发生改变,形成新的比较简单的晶格,而碳、氮等半径较小的原子则占据晶格中的空隙位置。例如,钒具有体心立方晶格,形成碳化钒(VC)时,钒则形成面心立方晶格,碳原子有规则地嵌入由钒原子组成的晶格空隙中,如图3-3所示。
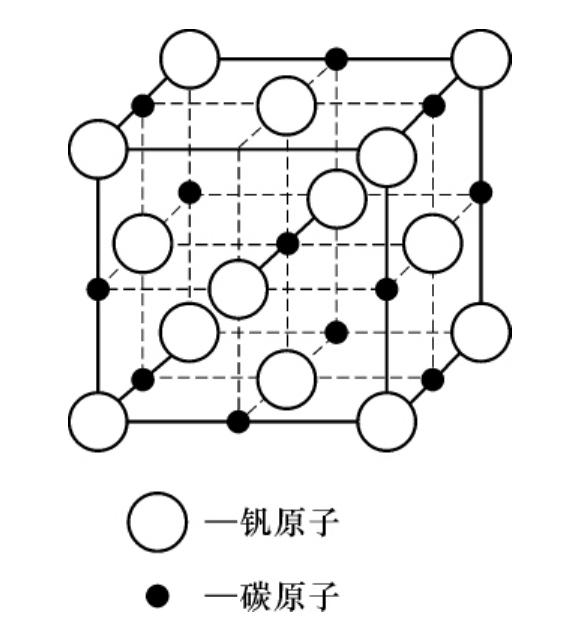
图3-3 VC的晶体结构
间隙相具有极高的熔点和硬度,具有明显的金属性,如具有金属光泽和良好的导电性等。间隙相在合金中有很大的用途。例如,在工具钢中加入少量的V形成VC可显著提高钢的耐磨性;钢中加入少量的Ti形成TiC可阻碍钢加热时的晶粒长大;高速钢之所以在高温600℃时仍能保持高硬度,也是由于其组织中含有碳化钒和碳化钨等间隙化合物。间隙相还是硬质合金的重要组成相,如TiC和WC是制造硬质合金的重要材料。此外,用渗入法或涂层法使钢的表面形成含有间隙相的薄层,可显著提高钢的表面硬度和表面耐磨性。
2.具有复杂立方晶格的间隙化合物
当非金属元素的原子与金属元素的原子半径的比值R非/R金>0.59时,所形成的化合物一般具有复杂的晶体结构。如碳钢中的Fe3C(R碳/R铁=0.63),合金钢中的Cr23C6,Cr7C3,Fe4W2C,FeB,Fe2B等均属于这一类。图3-4所示为Fe3C的晶格结构。其特点是铁原子构成空间八面体,碳原子位于八面体的中心,被6个铁原子所包围,如将每个碳原子用线条连接,则可看出碳原子单独又构成正交晶格(三个晶格常数各不相等),而各个铁原子组成的八面体间均倾斜一定的角度。
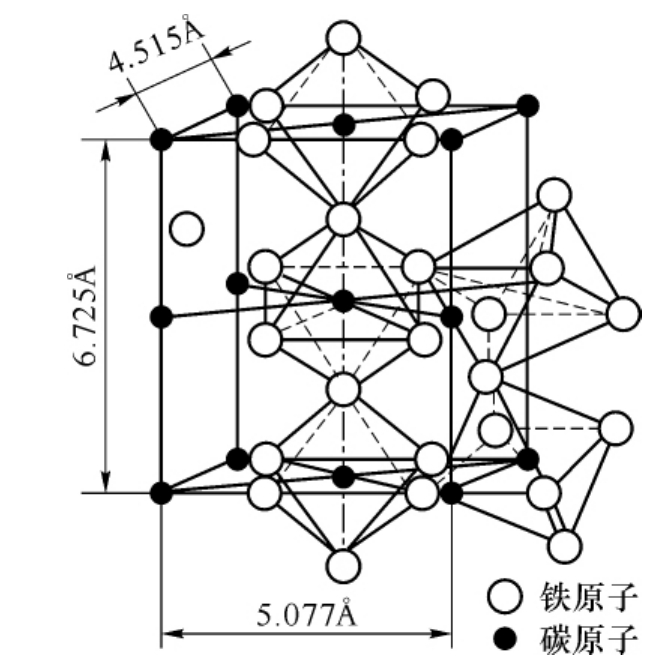
图3-4 Fe3C的晶体结构
Fe3C是钢铁材料中一种重要的间隙化合物,又称为渗碳体。Fe3C中的铁原子还可以被其他的金属元素的原子(如Mn、Cr、Mo、W等)所置换,形成以间隙化合物为基的固溶体,如(Fe,Mn)3C、(Fe,Cr)3C等,称为合金渗碳体。
具有复杂结构的间隙化合物也有很高的熔点和硬度。但与间隙相相比,它们的熔点和硬度要低些,而且加热时也较易分解。这类化合物也是碳钢及合金钢中的重要组成相。
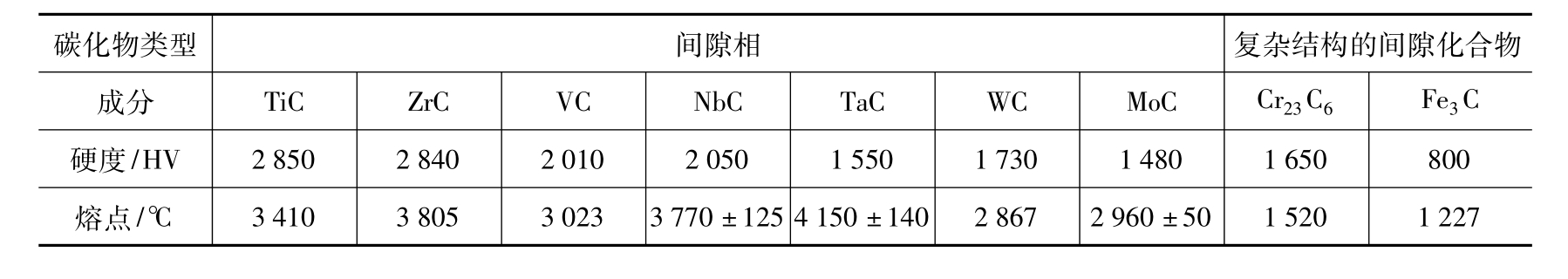
金属化合物的特点是熔点高、稳定性好、硬度高,但塑性极低、脆性很大。但当它们以细小的颗粒状或球状的均匀分布在固溶体的基体上时,将使合金的硬度、强度和耐磨性显著提高,这一现象称为弥散强化。因此,金属化合物是许多合金钢、有色金属和硬质合金中重要的强化相。工业用合金的组织绝大多数都是固溶体与少量金属化合物组成的混合物。钢中常见碳化物的硬度及熔点如表3-2所列。
表3-2 一些碳化物的硬度和熔点
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















