【根据溶度积规则,沉淀溶解的必要条件是 J<K■sp】。因此,只要能降低溶液中有关离子浓度,使J<K■sp,沉淀就会溶解,通常使用的方法有以下几种。
(一)生成弱电解质使沉淀溶解
1.生成弱酸使沉淀溶解
由弱酸所形成的难溶强电解质,如BaCO3、CaC2O4、FeS等,大多都溶于强酸。如:
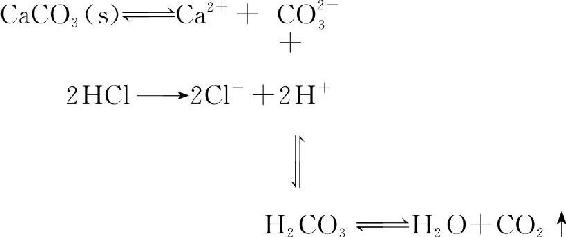
由HCl提供的H+与CO23—结合,生成弱酸H2CO3,而碳酸大部分分解为水和CO2气体,造成溶液CO23—浓度减小,J<K■sp,平衡向沉淀溶解的方向移动。因而只要有足量的HCl即可使CaCO3沉淀完全溶解。溶解总反应为:
CaCO3(s)+2H+■■■Ca2++H2CO3
总平衡常数:
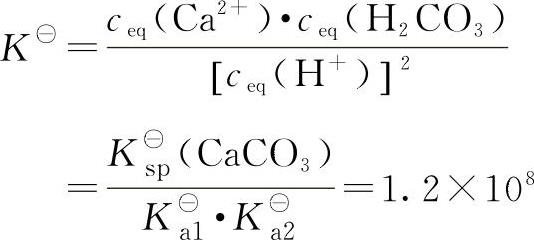
K■值很大,溶解反应进行得比较完全。难溶弱酸盐在酸中溶解的反应称酸溶反应,反应的总平衡常数称为酸溶平衡常数。显然,酸溶平衡常数的大小是由K■sp和K■a两个因素决定的,沉淀的K■sp越大,或生成的弱酸的K■a越小,K■越大,则酸溶反应进行得越彻底。反之,K■越小,则酸溶反应不完全。当K■≤10—6时,反应几乎不能进行。例如MnS和CuS的K■sp分别为2.5×10—13和6.3×10—36,前者可溶于HCl,而后者则不溶。
2.生成H2O使沉淀溶解
难溶氢氧化物,如Mg(OH)2、Cu(OH)2、Fe(OH)3、Al(OH)3等,与酸作用生成弱电解质水,降低了溶液中OH—浓度,使难溶氢氧化物的J<K■sp,平衡向沉淀溶解的方向移动。例如:
总反应式:Fe(OH)3(s)+3H+■■■Fe3++3H2O
酸溶平衡常数:
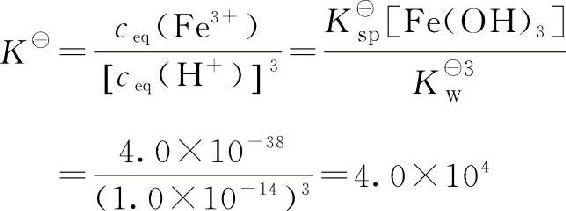
由上述酸溶平衡常数的表达式可知,难溶氢氧化物酸溶反应程度的大小,除与K■sp有关外,还与K■w有关。
3.生成弱碱使沉淀溶解
K■sp较大的难溶氢氧化物,如Mg(OH)2、Mn(OH)2等除能溶于酸外,还可溶于铵盐。例如:
由于铵盐溶液中的NH4+可与Mg(OH)2饱和溶液中的OH—结合生成弱电解质NH3·H2O,溶液中OH—浓度减小,使Mg(OH)2溶液中的J<K■sp,平衡向沉淀溶解的方向移动,Mg(OH)2沉淀溶解。溶解总反应为:
平衡常数K■不是很大,但若加足量的氯化铵,溶解还是可以进行的。此类难溶强电解质的溶解难易取决于难溶氢氧化物的K■sp和生成弱碱的电离常数K■b,K■sp越大,K■b越小,溶解越易进行;反之,则越难进行。如Al(OH)3、Fe(OH)3等K■sp较小的难溶氢氧化物沉淀可溶于强酸溶液,但不溶于铵盐溶液。
4.生成难电离的盐使沉淀溶解
PbSO4沉淀能溶于饱和NaAc溶液中,反应如下:

由NaAc提供的Ac—和Pb2+形成弱电解质Pb(Ac)2,溶液中Pb2+浓度减小,使PbSO4溶液的J<K■sp,PbSO4沉淀溶解。
(二)利用氧化还原反应使沉淀溶解
前面讨论的难溶弱酸盐的酸溶反应表明,难溶物的K■sp越小,生成弱酸的K■a越大,酸溶平衡常数越小,沉淀越难溶解。如沉淀Ag2S、CuS等,由于K■sp非常小,酸溶平衡常数很小,即使加入高浓度的非氧化性强酸也不能有效地降低S2—浓度,使沉淀溶解。因此,Ag2S、CuS等不溶于非氧化性的强酸中。但如果用氧化性的强酸,如热的稀HNO3,则可以将S2—氧化成单质S,从而大大降低S2—浓度,使Ag2S、CuS的J<K■sp,Ag2S、CuS沉淀溶解。反应可表示如下:
3CuS+8HNO3(稀)=3Cu(NO3)2+2NO↑+3S↓+4H2O
3Ag2S+8HNO3(稀)=6AgNO3+2NO↑+3S↓+4H2O
(三)生成配离子使沉淀溶解
一些难溶强电解质,既不溶于非氧化性酸,也不溶于氧化性酸,如Agc等。但它们的阳离子可以和某些配合剂生成配合物,溶液中游离的阳离子浓度大大降低,使J<K■sp,沉淀溶解。如AgCl能溶于NH3·H2O中,AgI能溶于KCN溶液中等。
其溶解的反应式可表示如下:
AgCl(s)+2NH3■■■[Ag(NH3)2]++Cl—
AgI(s)+2CN—■■■[Ag(CN)2]—+I—
这类溶解反应能否进行,进行到什么程度,除与沉淀的K■sp有关外,还与生成配离子的稳定性有关。具体的定量计算在配合物一章中讨论。
某些情况下,为使K■sp极小的难溶强电解质溶解,有时需要同时采用两种或多种方法才行。例如HgS的K■sp=4.0×10—53,必须加入王水(1体积浓HNO3+3体积浓HCl),同时利用氧化还原和生成配离子两种方法使其溶解。具体反应如下:
3HgS+2NO3—+12Cl—+8H+=3[HgCl4]2—+3S↓+2NO↑+4H2O
反应中由于S2—被HNO3氧化为单质S,Hg2+和Cl—生成[HgCl4]2—配离子,使溶液中S2—和Hg2+浓度同时被大大降低,J<K■sp,HgS沉淀溶解。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















