(一)内侧耳蜗橄榄束(MOC)传出神经递质及受体
1.乙酰胆碱 已经证实,乙酰胆碱是内侧橄榄耳蜗束(medial olivocochlear complex,MOC)最主要的神经递质。MOC兴奋时乙酰胆碱自传出神经末梢的囊泡内释放到突触间隙,与OHC底部突触后膜上的乙酰胆碱受体相结合,从而激活突触后膜的Ca2+依赖型K+通道,引起细胞内K+外流,突触后膜超极化,产生抑制性突触后电位,使OHC活动性降低。OHC细胞膜上的乙酰胆碱受体以烟碱样(N型)受体为主,同时存在毒蕈碱样(M型)受体。N型受体增加了内流的Ca2+数量,从而调控了K+外向电流。免疫组织化学染色显示,耳蜗中乙酰胆碱能神经纤维的分布由耳蜗底圈向顶圈递减。由此推测,乙酰胆碱可能在高频声刺激时发挥更重要的作用。
2.γ-氨基丁酸(GABA) 是MOCB的另一重要神经递质。免疫组织化学染色显示GABA染色阳性的神经纤维末梢在耳蜗顶圈分布占优势,底圈则未见分布。当神经兴奋时,神经末梢突触囊泡释放GABA到 OHC底部突触后膜下方,与GABA受体上α和β亚单位的GABA/苯二氮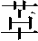 结合点结合,激活GABA受体,并引起突触后膜超极化。Plinkert等在活体OHC底部分别加入乙酰胆碱和GABA引起OHC的超极化,观察到乙酰胆碱引起OHC可逆性的缓慢的收缩,而GABA引起OHC可逆性的伸长。因此,虽然二者均被认为是抑制性神经递质,但不排除它们在对OHC活动的调控中可能具有某种平衡甚至部分相互抵消的作用。
结合点结合,激活GABA受体,并引起突触后膜超极化。Plinkert等在活体OHC底部分别加入乙酰胆碱和GABA引起OHC的超极化,观察到乙酰胆碱引起OHC可逆性的缓慢的收缩,而GABA引起OHC可逆性的伸长。因此,虽然二者均被认为是抑制性神经递质,但不排除它们在对OHC活动的调控中可能具有某种平衡甚至部分相互抵消的作用。
此外,肽类物质(脑啡肽、强啡肽、降钙素基因相关肽)和5-羟色胺也被证实与传出神经调控有关。但具体的作用机制尚待进一步研究。
(二)乙酰胆碱(ACh)对OHC[Ca2+]i的影响
郗昕等用激光扫描共聚焦显微镜研究了乙酰胆碱(acetylcholine,ACh)对豚鼠耳蜗外毛细胞胞内游离Ca2+浓度的作用,外毛细胞胞内Ca2+的分布以细胞底部稍强。ACh在OHC底部引起Ca2+的缓慢上升并维持在一个较高水平。Housley和Ashmore观察到ACh引起一个外向钾流并使细胞超极化,Fuchs和Murrow更在这一外向钾流之前观察到一个短暂的内向电流,揭示ACh引起Ca2+内流并启动Ca2+依赖的K+通道,使胞内K+外流,细胞产生超极化。最新的实验表明胞内Ca2+的参与对ACh引起的反应至关重要。ACh作用的位点可能在OHC底部突触后膜上。ACh引起的Ca2+升高速度及幅度远不及ATP,表明胞外Ca2+很可能是通过ACh受体门控的阳离子通道或者电压依赖性钙通道进入OHC,但可能并不引起胞内钙库的释放。
(三)内侧橄榄耳蜗束对OHC的调控
内侧橄榄耳蜗束可以对耳蜗毛细胞及主动机制产生作用。传出神经对毛细胞的作用是通过神经递质完成的,现已明确MOC的主要神经递质为乙酰胆碱,其突触后膜上的受体为N型和M型两种。胞内电位记录及离子通道研究结果显示,传出神经兴奋时,其末梢释放ACh,激活OHC的Ca2+依赖性K+通道,胞内K+外流,细胞膜电位超极化,OHCs的活动性降低,从而影响耳蜗内的主动机制,表现为OAEs的抑制。电刺激对侧橄榄耳蜗束(COCB)或在对侧耳给予声刺激时均使传出神经纤维兴奋而使OAEs抑制,而当传出神经被切断时,这种抑制作用则消失。对侧声刺激对OAEs的抑制作用不仅与对侧刺激声强有关,而且有频率特性。
我们成功地进行了耳蜗传出神经切断术,术后7日的豚鼠10只,经ABR初筛双耳阈值均<35dB SPL,无前庭及面神经损伤表现。将所有10只动物的右耳(手术侧)作为实验组,左耳作为对照组。自体配对比较以排除在术后恢复过程中机体应激状态对听功能的影响因素。其耳蜗功能测试结果如下。
1.DPOAE的结果 实验组20耳及对照组的20耳的DPOAE结果均显示为通过,实验组无对侧白噪声抑制,对照组给予对侧白噪声时各频率幅度下降平均值>3dB。实验组在f2=2 211Hz、3 125Hz和4 416Hz频率处耳声发射幅度低于对照组,f2=553Hz、783Hz、1 105Hz、1 560Hz、6 250Hz 和8 837Hz频率处与对照组的耳声发射幅度无差异。
2.CAP的结果 实验组与对照组均测10只耳,在最大声输出强度时,实验组CAP波的AP幅度为(128.63±73.79)μV,对照组为(71.91±30.41)μV,两组波形形状无明显差异,实验组CAP幅度高于对照组(P <0.01)。
3.CM的结果 对实验组与对照组均测10只耳,在100dB SPL刺激强度时,实验组CM幅度(12.37±6.02)μV,对照组为(8.32 ±4.63),实验组CM幅度也高于对照组(P <0.05)。
4.皮质原发反应(premier response,PR) 对实验组与对照组均测10只耳,在100dB SPL刺激强度时,实验组PR-N波幅度为(4.06±1.28)mV,对照组为(5.60± 3.15)mV,两组间无显著差异(P>0.05)。
上述结果显示:①失去耳蜗传出神经支配后的CAP幅度增高、CM幅度增高,提示耳蜗传入神经的冲动增加,OHC功能活跃。②失去耳蜗传出神经支配后的PR-N波幅度未发生有意义的改变,尚待进一步研究探讨失耳蜗传出神经支配后听中枢的重组方式。③耳蜗传出神经功能障碍可能是听觉过敏的病变原因。④失耳蜗传出神经支配后,DPOAE无明显变化,提示耳蜗传出系统抑制作用消失。
(四)耳蜗的主动机制与MOC的调控
耳蜗的主动机制决定于OHC的能动性,OHC起着“耳蜗放大器”的作用,即增加低强度声刺激时基底膜振动的幅度和增加频率选择性。OHC的这种作用可能通过细胞体的长度变化或纤毛束的摆动这两个机制来实现。而OHC又受MOC的调控。
1.幅度放大作用的机制 OHC的主动运动可直接和间接(通过引起基底膜振动幅度的增加)对内淋巴液的流动产生影响,使内淋巴液流动速度改变。IHC的纤毛受刺激后摆动的幅度增大。
2.提高频率选择性的机制 OHC及其下方的传出神经纤维都具有一定的频率选择性,即对某一特定频率的声刺激表现为最敏感,该频率为这个OHC或神经纤维的特征频率(CF)。每根传出神经都有自己的CF,并与其支配区域的毛细胞、传入神经的CF一致,在CF声音刺激时传出神经的兴奋阈在传入兴奋阈上15dB,即传出神经对传入神经的抑制作用较低,说明传出神经有极高的频率选择性和良好的灵敏度,这与传入神经纤维的有序排放结合,显著增强了听觉系统的频率辨别能力。
3.反馈保护机制 传出神经系统除了提高听觉分辨能力外,还可在噪声环境中增强对靶信号的辨别以及在过度声刺激时提供反馈性保护。心理声学实验中观察到OCB兴奋可降低噪声的掩蔽效应,当人注意某一特别信号时,其他无关信号的输入减少。试验证明切断OCB后,猴在噪声环境中对元音的识别率变差,频率识别也明显受损。而刺激OCB可导致从耳蜗到中枢一系列电生理活动的改变,包括:减小复合动作电位N1的幅值;增加耳蜗微音器电位的幅度,但不改变其输入-输出函数的非线性特性;耳声发射幅度减小;听神经元的自发性和诱发性放电减少,听神经元调谐曲线变平坦,CF阈值升高。
(五)内侧橄榄耳蜗束对传入听神经的作用
Galambos观察到在第四脑室底对COCB施行电刺激可降低CAP的幅度,抑制作用的潜伏期约为15ms,约过50ms进一步增强,对由较低声强诱发的听神经反应,抑制作用较强。在抑制作用较强的情况下,抑制效应可相当于降低听神经反应声强20~25dB,多数情况下等效于15dB。但是,刺激COCB时耳蜗微音器电位不变小,反而增大,增大的幅度可达4dB。Gifford和Guinan通过较为精细定位的电刺激证实这种作用确定是因为刺激内侧橄榄耳蜗系统的神经元而引起的。听神经单纤维记录实验表明,刺激COCB不仅使听神经单纤维放电率下降,其调谐曲线也变宽,CF阈值升高。Brown报道,刺激COCB时IHC的静息电位不变,但感受器电位受抑制,调谐曲线变化,CF阈值也升高,认为这种作用是通过OHC引起的。从实验结果看,刺激内侧橄榄耳蜗系统可能是通过对OHC的作用而影响IHC的活动,从而影响听神经的活动的。刺激停止后对N1的抑制并不马上解除,而是逐渐减弱并持续一段时间,约500ms后抑制作用才消失。
(六)耳蜗传出系统调控机制的新认识
随着对传出神经系统研究的逐渐深入,传出神经系统的重要意义也正被更多的学者关注。
近年来,中枢听觉机制对耳蜗功能的影响已成为听觉生理研究的热点。动物实验中发现电刺激听皮质特定区域的神经元,可引起耳蜗微音器电位(CM)最佳频率的改变,且受刺激神经元的CF与CM最佳频率差别越大,改变也越大。这表明中枢下行投射系统可以根据CF的对应关系,通过一种高度特异的方式调控耳蜗毛细胞,这与OCB调控毛细胞的特征一致。因此可推论,皮质下行系统对单个OCB纤维有着选择性的调制作用。另外,目前已在多种实验模型上证实听觉传入通路每一环节的病变都会导致听觉皮质的功能重组,那么,当耳蜗传出系统存在时,是否对听觉中枢的可塑性有一定的意义呢?因为当耳蜗失去传出神经支配时,其信号传入必定会发生改变,可能使神经冲动同步化不良,或传入信号特异性和灵敏度降低等。此时,听觉皮质是否会发生重组以代偿这种变化呢?蜗内直流电位是耳蜗生理活动的基础,维持此电位稳定的是K+循环及平衡。当OHC主动收缩并释放能量时,细胞膜上的Ca2+依赖性K+通道开启关闭是否受到影响?IHC、OHC、支持细胞间的细胞通讯是否发生变化?这些变化可使K+失去平衡,对蜗内直流电位产生影响。而后者的变化是否可进一步调节传入通路呢?
耳声发射的对侧声抑制效应已应用于检测耳蜗传出通路的完整性,特别是用于鉴别诊断听觉过敏与重振现象。听觉过敏的病因是否是传出神经系统损伤后对听觉传入的失抑制?而重振现象是否为OHC损伤后耳蜗的主动机制丧失?是否可以推测,有重振现象的患耳不能引出耳声发射,而听觉过敏患者的耳声发射可引出,但对侧声抑制效应消失。另外,听神经病可能与OCB相关,也需要继续研究证实。
总之,很多问题都会涉及耳蜗OHC与传出系统对传入系统的调控机制,似乎仅仅用微机械学说已不能做出满意的解释。耳蜗中是否还存在更为复杂的调控机制,值得我们进一步探讨。选择性破坏LOC或MOC分别观察其对耳蜗功能的影响是今后工作的重点。
(李兴启 侯志强 谭祖林 闻雨婷)
1 Alan J,Groff M.Charles Liberman.Modulation
of cochlear afferent response by the lateral olivocochlear system:activation via electrical stimulation of the inferior colliculus.J Neurophysiol, 2003,90:3178
2 Altschuler RA,Sheridan CE,Horn JW,et al.Immunocytochemical localization of glutamate immunoreactivity in the guinea pig cochlea.Hear Res,1989,42(2-3):167
3 Bobbin RP,Thompson MH.Effects of putative transmitters on afferent cochlear transmission.Ann Otol Rhinol Laryngol,1978,87(2Pt 1):185
4 Brown Mu,de Venecia RK,Gnan JJ.Responses of medial olivocochlear neurons,specifying the central pathways of the medial olivocochlear reflex.Exp Brain Res,2003,153(4):491
5 Brown MC,Nuttall AL,Masta RI.Intracellular recordings from cochlear inner hair cells:effects of stimulation of the crossed olivocochlear efferents.Science,1983,222(4619):66
6 Cody AR,Johnstone BM.Acoustically evoked activity of single efferent neurons in the guinea pig cochlea.J Acoust Soc Am,1982,72(1):280
7 Comis SD,Leng G.Action of putative neurotransmitters in the guinea pig cochlea.Exp Brain Res,1979,36(1):119
8 Dallos P.The active cochlea.J Neurosci,1992,12(2):4575
9 Elmar Oestreicher,Wolfgang Arnold,Klaus Ehrenberger,et al.Dopamine regulates the glutamatergic inner hair cell activity in guinea pigs.Hear Res,1997,107:46
10 Eybalin M,Pujol R.A radioautographic study of [3 H]L-glutamate and[3 H]L-glutamine uptake in the guinea-pig cochlea.Neuroscience,1983,9 (4):863
11 Felix D,Ehrenberger K.A Microiontophoretic study of the role of excitatory amino acids at the afferent synapses of mammalian inner hair cells.Eur Arch Otorhinolaryngol,1990,248(1):1
12 Felix D,Ehrenberger K.The efferent modulation of mammalian inner hair cell afferents.Hear Res,1992,64:1
13 Fettiplace R,Hackney CM.The sensory and motor roles of auditory hair cells.Nat Rev Neurosci,2006,7(1):19
14 Friedmann I,Ballantyne J.Ultrostructural Atlas of the Inner Ear.London:Butterworths,1984
15 Fuchs PA,Murrow BW.Cholinergic inhibition of short(outer)hair cells of the chick’s cochlea. J Neurosci,1992,12(3):800
16 Galambos R.Suppression of auditory nerve activity by stimulation of efferent fibers to cochlea.J Neurophysiol,1956,19(5):424
17 Gifford ML,Guinan JJ.Effects of electrical stimulation of medial olivocochlear neurons on ipsilateral and contralateral cochlear responses.Hearing Research,1987,29:179
18 Gleich O,Johnstone BM,Robertson D.Effects of L-glutamate on auditory afferent activity in view of its proposed excitatory transmitter role in the mammalian cochlea.Hear Res,1990,45(3):295
19 Godfrey DA,Carter JA,Berger SJ,et al.Levels of putative transmitter amino acids in the guinea pig cochlea.J Histochem Cytochem,1976,24 (2):468
20 Groff JA,Liberman MC.Modulation of cochlear afferent response by the lateral olivocochlear system:activation via electrical stimulation of the inferior colliculus.J Neurophysiol,2003,90:3178
21 Hill JC,Prasher DK,Luxon LM.Evidence for efferent on auditory afferent activity,and their functional relevance.Clin Otolaryngol,1997,22:394
22 Housley GD,Ashmore JF.Direct measurement of the action of acetylcholine on isolated outer hair cell of the guinea pig cochlea.Proc R.Soc Lond,1991,244:161
23 Inoue T,Matsubara A,Maruya S,et al.Localization of dopamine receptor subtypes in the rat spiral ganglion.Neuroscience Letters,2006,399:226
24 Klinke R,Oertel W.Amino acids-putative afferent transmitter in the cochlea.Exp Brain Res,1977,24,30(1):145
25 Kujawa SG,Glattke TJ,Fallon M,et al.Contralateral sound suppresses distortion product otoacoustic emissions through cholinergic mechanicsms.Hear Res,1993,68(1):97
26 Kurigama H,Jenkins O,Altschuler RA,et al.Immunocytochemical localization of AMPA selective glutamate recaptor submit in the rat cochlea.Hear Res,1994,80(2):233
27 Li xing qi,Sun jian he,Yu ning.Glutament induced modulation of free Ca2+in isolated inner hair cell of the guinea pig cochlea.Hear Res,2001,161:29
28 Li Xingqi,Sun Jianhe,Yu Ning,et al.D-AP5 blocks the increase of intracellular free Ca2+induced by glutamate in isolated cochlear IHCs.Chinese medical Journal,2002,115(1):89
29 Libermann MC.Morphological differences among radical afferent fibers in the cat cochlea:an electron-microscopic study of serial sections.Hear Res,1980,3:45
30 Liberman MC.Effects of chronic cochlear de-efferentation on auditory-nerve response.Hear Res,1990,49:209
31 Lusting LR.Nicotinic acetylchline receptor structure and function in the efferent auditory system.Anat Rec A Discow Mol Cell Evol Biol,2006,288(4):424
32 Moser T,Beuner D.Kinetics of exocytosis and endocytosis at the cochlear inner hair cell afferent synapse of the mouse.Proe Natl Acad Sci,2000,97:883
33 Mulders WH,Robertson D.Dopaminergic olivocochlear neurons originate in the high frequency region of the lateral superior olive of guinea pigs.Hear Res,2004,187:122
34 Naito S,Ueda T.Characterization of glutamate uptake into synaptic vesicles.J Neurochem,1985,44(1):99
35 Niu X,Canlon B.The signal transduction pathway for the dopamine D1receptor in the guineapig cochlea.Neuroscience,2006,137(3):981
36 Niu X,Canlon B.Activation of tyrosine hydroxylase in the lateral efferent terminals by sound conditioning.Hear Res,2002,174:124
37 Oestreicher E,Arnold W,Ehrenberger K,et al.Dopamine regulates the glutamatergic inner hair cell activity in guinea pigs.Hear Res,1997,107:46
38 Parsons TD,Sterling P.Synaptic Ribbon:Conveyor Belt or Safety Belt?Neuron,2003,37:379
39 Petralia RS,Rubio ME,Wang YX,et al.Differential distribution of glutamate recep tors in the cochlear nuclei1Hear Res,2000,147(122):592
40 Plinkert PK,Zenner HP.Speech perception and otoacoustic emissions by pre-processing sound in the inner ear.HNO,1992,40(4):111
41 Puel JL.Chemical synaptic transmission in the cochlea.Prog Neurobiol,1995,47:449
42 Puel JL.The inner hair cell synaptic complex:physiology,pharmacology and new therapeutic strategies.Audiol Neurootol,2002,7:49
43 Pujol R,Puel JL.Excitotoxicity,synaptic repair,and functional recovery in the mammalian cochlea:a review of recent findings.Ann N Y Acad Sci,1999,884:249
44 Pujor R.Lateral and medial efferents:a double neurochemical mechanicsm to protect and regulate inner and outer hair cell function in the cochlea.Br.J Audiol,1994,28(4-5):185
45 Rajan R.Centrifugal pathways protect hearing sensitivity at the cochlea in noisy environments that exacerbate the damage induced by loud sound.J Neurosci,2000,20(17):6684
46 Ricci A.Active hair bundle movements and the cochlear amplifier.J Am Acad Audiol,2003,14 (6):325
47 Ricci AJ,Crawford AC,Fettiplace R.Mechanisms of active hair bundle motion in auditory hair cells.J Neurosci,2002,22(1):44
48 Roberts WM,Jacobs RA,Hudspeth AJ.Colocalization of ion channels involved in frequency selectivity and synaptic transmission at presynaptic active zones of hair cells.J Neurosci,1990,10 (11):3664
49 Rordang L,Cestreicher E,Amold W,et al.Glutamate is the afferent neurotransmitter in the human cochlea.Acta Otolaryngol,2000,120 (3):359
50 Ruel J,Nouvian R,d’Aldin C,et al.Dopamine inhibition of auditory nerve activity in the adult mammalian cochlea.Eur J Neurosci,2001,14:977
51 Stapells DR,Gravel JS,Martin BA.Thresholds for auditory brain stem response to tones in notched noise from infants and young children with normal hearing or sensorineural hearing loss.Ear and Hearing,1995,16:361
52 Sun W,Salvi RJ.Dopamine modulates sodium currents in cochlear spiral ganglion neurons.Neuroreport,2001,12:803
53 Usami S,Osen KK,Zhang N,Ottersen OP.Distribution of glutamate-like and glutamine-like immunoreactivities in the rat organ of Corti:a light microscopic and semiquantitative electron microscopic analysis with a note on the localization of aspartate.Exp Brain Res,1992,91(1):1
54 Usami S,Ottersen OP.Differential cellular distribution of glutamate and glutamine in the rat vestibular endorgans:an immunocytochemical study.Brain Res,1995,676(2):285
55 Vallone D,Picetti R,Borrelli E.Strucrure and function of dopamine receptors.Neuroscience and Biobehavioral Reviews,2000,24:125
56 Warren EH,Liberman MC.Effects of contralateral sound on auditory-nerve responses.I.contribution of cochlear efferents.Hear Res,1989,37 (2):89
57 Zheng XY,Henderson D,McFadden SL,et al.Auditory nerve fiber responses following chronic cochlear de-efferentation.J Comp Neurol,1999, 406:72
58 侯志强,余力生,李兴启.外侧橄榄耳蜗束在内毛细胞下突触复合体中的调控作用.听力学及言语疾病杂志,2007,15(5):416
59 侯志强,余力生,李兴启,等.多巴胺对豚鼠听觉传入神经的抑制作用及其频率选择性.中华耳鼻咽喉科杂志,2008,43(8):601
60 李兴启.听觉诱发反应及应用.北京:人民军医出版社,2007
61 孙 勍,孙建和,单希征,等.谷氨酸对豚鼠畸变产物耳声发射和听性脑干反应的影响.中华耳鼻咽喉头颈外科杂志,2005,40(6):435
62 孙 勍,李兴启,单希征,等.噪声对豚鼠耳蜗电位及其超微结构的影响.中华耳鼻咽喉头颈外科,2005,12(6):373
63 孙 勍,李兴启,张国庆,等.噪声对豚鼠耳蜗外淋巴谷氨酸含量及耳蜗电位的影响.听力学及言语疾病杂志,2004,12(2):93
64 孙建和,李兴启,姜泗长,等.豚鼠耳蜗外毛细胞传出神经末梢分布乙酰胆碱脂酶的研究.中华耳鼻咽喉科杂志,1993,28(4):239
65 谭祖林,李兴启,徐先荣.谷氨酸在耳蜗信息传递中的作用.空军总医院学报,2001,17(1):40 66郗 昕,姜泗长.用共聚焦显微镜观察ACh及ATP对豚鼠耳蜗外毛细胞Ca2+的调控.生理学报,1995,47(2):105
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















