(一)实验目的及原理
检测细胞膜蛋白的流动性或胞浆蛋白进行细胞核转位的情况。一些标本或标本的不同部位如:细胞核膜、内质网和细胞质等,荧光恢复的速度非常快,荧光漂白与恢复几乎同时发生。而使用FRAP观察微观动力学的过程中,必须分为漂白和漂白后两个过程,两个过程之间的转换存在时间延迟,所以FRAP实验无法实现这些快速变化标本的动力学研究。荧光漂白丢失(fluorescence lose in photobleach,FLIP)与FRAP类似,同样在细胞上选取局部刺激区域,用强激光反复刺激,不同之处是FRAP记录的是被漂白区域的荧光恢复过程,而FLIP记录的是未被漂白区域的荧光损失过程,该技术为检查内质网、细胞核和细胞质等区室的边界提供了强有力的工具。
本部分以信号转导和转录激活因子3(nuclear receptor-mediated signal transduction pathway 3,STAT3)核转位检测为例。
(二)主要实验材料
GFP-STAT3全长质粒、转染试剂,共聚焦专用petri培养皿等。
(三)实验流程(以WI-38细胞为例)
1.细胞在共聚焦专用培养皿中培养,生长50%融合。
2.WI-38转染GFP-STAT3,孵育48h。
3.置于60倍油镜观察区域及层面,用LSCM观察GFP染色的细胞的某一层面的荧光图像。
4.根据实验需要设定扫描时间(如果恢复快速则时间间隔小一点,如果恢复慢则时间间隔长一些)。
5.以OlympusFV1000为例,按光刺激按钮;选中MAIN;选中ROI选择键;在图像上选择需要漂白的区域;选中用于漂白的激光器,一般只选405nm激光,并根据漂白情况选择漂白激光强度;输入需要漂白的时间或幅数,根据实际漂白效果,如果很快漂白则输入值低一些,如果漂白慢则输入值大一些;输入等待FRAM数,一般输入1~10个都可。
6.执行XYT扫描,SIM扫描的好处在于,可以一边执行XYT扫描,一边进行光刺激,在XYT扫描的过程中还可以调节光刺激的位置和强度等,而且可以不间断的成像。
7.获取图像和数据,计算荧光丢失速率,间接反映STAT3入核的速率。见图1-40。

图1-40 FLIP模式图
(四)典型举例
运用该技术发现衰老WI-38细胞STAT3-GFP核转位速率减慢,见图1-41。
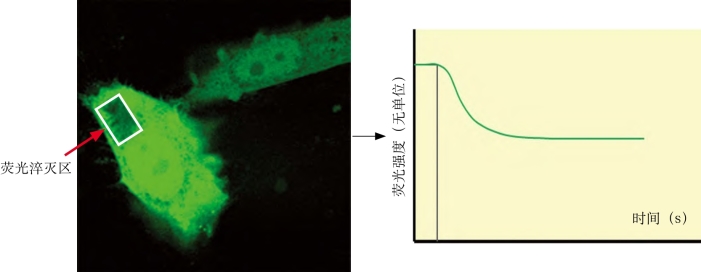
图1-41 转染GFP-STAT3的WI-38细胞(×600)及FLIP荧光淬灭曲线分析
(五)注意事项
1.细胞的选择 在荧光显微镜下尽量选择细胞密度不大(能分出细胞个数、不相连的细胞)、细胞形态完整(不畸形,反映细胞状态良好),GFP荧光不是很强的细胞。
2.同一培养皿的细胞尽量在30~40min扫完,否则由于细胞暴露在空气中时间过长将影响检测结果,或者选择配有活细胞培养系统的共聚焦显微镜。
3.淬灭时间不能过长,否则细胞内荧光消耗过度、不易恢复,影响实验结果的准确性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















