以HAc——NaAc为例:

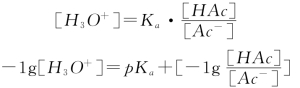
等式两边取负对数,即:
![]()
Ac-主要来自共轭碱NaAc
![]()
——缓冲溶液pH的近似计算公式(Henderson-Hasselbalch)
类似地:NaH2PO4——Na2HPO4
![]()
![]()
NH4Cl——NH3![]() 不会变化太大。取对数后是个更小的值,pH基本不变。②温度一定,溶液pH不因稀释而产生明显变化。缓冲溶液又具有一定的抗稀释作用。当缓冲溶液加水稀释时,由于共轭碱和共轭酸的浓度受到同等程度的稀释,缓冲比是不变的;在一定的稀释度范围内,缓冲溶液的pH实际上也几乎不变。
不会变化太大。取对数后是个更小的值,pH基本不变。②温度一定,溶液pH不因稀释而产生明显变化。缓冲溶液又具有一定的抗稀释作用。当缓冲溶液加水稀释时,由于共轭碱和共轭酸的浓度受到同等程度的稀释,缓冲比是不变的;在一定的稀释度范围内,缓冲溶液的pH实际上也几乎不变。
若混合前共轭酸的浓度是c酸,体积是V酸,共轭碱的浓度是c碱,体积是V碱,则缓冲溶液pH的近似计算公式可写成:
![]()
Henderson-Hasselbalch公式意义:①缓冲溶液pH主要决定于pKa,同时与共轭酸碱对浓度比有关。对于某一种缓冲液pKa一定,pH随共轭酸碱对浓度比(缓冲比)而变。外加少量酸或碱
若共轭酸碱的浓度相等,则:
![]()
若是等体积的两溶液相混合,则:
![]()
以上几种形式都称为亨德森方程式,可用以计算各种组成类型缓冲溶液的pH近似值。当用于弱酸及其对应的盐组成的缓冲溶液的pH时,pKa即弱酸的离解常数负对数,[共轭碱]即[弱酸盐]。当用于多元弱酸的酸式盐及其对应的次级盐组成缓冲溶液的pH时,共轭酸即酸式盐,pKa即该酸式盐负离子的离解常数的负对数,共轭碱即该酸式盐的次级盐。例如,NaHCO3——Na2CO3缓冲溶液的pH:
![]()
![]()
例3-1 0.1mol/L的HAc 500ml与0.2mol/L的NaAc 250mL配成缓冲溶液,计算溶液的pH。
解:把所给条件代入pH计算公式,由书后附表查得HAc的pKa=4.75,则得:
![]()
同样,NaH2PO4——Na2HPO4缓冲溶液的pH:
例3-2 将0.3mol/L HAc溶液10ml与0.1mol/L NaOH溶液10ml混合后制成缓冲溶液,试计算这个溶液的pH(2.5℃时,HAc时pKa=4.75)。

从反应看出HAc有1/3被OH-中和,生成Ac-和H2O,溶液的总体积为20ml。
则[HAc]=0.1mol/L,[Ac-]=0.05mol/L
![]()
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














